蓝莓间座壳茎溃疡病病原鉴定及生物学特性研究
李 媛, 石凌波, 费诺亚, 傅俊范, 严雪瑞
(沈阳农业大学植物保护学院,沈阳 110866)
蓝莓间座壳茎溃疡病病原鉴定及生物学特性研究
李 媛, 石凌波, 费诺亚, 傅俊范, 严雪瑞*
(沈阳农业大学植物保护学院,沈阳 110866)
在蓝莓园进行病样采集时,发现一种蓝莓茎部病害,病斑呈红褐色,溃疡状,长椭圆形。为明确该病害的病原菌种类,对病枝进行组织分离,经单孢纯化后得到菌落形态一致的7株致病菌,对供试菌株的ITS与EF1-α基因联合构建系统发育树,供试菌株与Diaporthephaseolorum处于同一分支,结合形态学特征,鉴定该病原菌为Diaporthephaseolorum。对病原菌的生物学特性研究结果表明,该菌最适培养基为PDA,最适生长温度为25℃,光照对菌丝生长无明显影响。本文首次报道Diaporthephaseolorum引起蓝莓茎溃疡病。
蓝莓; 间座壳属; 茎溃疡病; 鉴定
蓝莓Vacciniumspp.,又名越橘、蓝浆果,属于杜鹃花科Ericaceae,越橘属Vaccinium丛生灌木,果实营养丰富,20世纪80年代中期引进国内并开始大面积商业化种植栽培,随着种植面积不断扩大,蓝莓病害问题也日益严重[1-2]。
间座壳属病原菌可引起蓝莓茎溃疡病、蓝莓果腐病等多种病害,国外已报道该属危害蓝莓种有Diaporthevaccinii[3]、D.ambigua[4]、D.australafricana[4]、D.neotheicola[4]、D.passiflorae[4]、D.viticola[5]、D.asheicola[5]、D.baccae[5]和D.sterilis[5]。我国目前已报道可侵染蓝莓的种有D.vaccinii[6]和D.eres[7]。
2013-2014年在辽宁庄河市、丹东市,黑龙江伊春市,福建长汀县蓝莓园进行病样采集时发现了一种蓝莓茎部病害。病斑溃疡状,长椭圆形,红褐色,后期呈灰白色。本研究对该病害进行病原菌分离纯化以及柯赫氏法则证病,将引起该病害的病原菌与已经报道的间座壳属病原菌在形态学、分子生物学以及发病症状上进行比较,确定在我国可侵染蓝莓的间座壳属病原菌种类。
1 材料方法
1.1 病原菌分离
采用组织分离法和单孢分离法对病样进行病原菌分离和纯化[8]。用无菌水冲洗病部枝条,在病健交界处切取5 mm×5 mm组织块,用75%乙醇进行表面消毒30 s后放入0.1%升汞溶液中浸泡30 s,无菌水冲洗3次后置于PDA(马铃薯200 g,葡萄糖20 g,琼脂粉20 g,水1 000 mL)培养基上,在25℃,12 h光暗交替条件下培养3~7 d,挑取尖端菌丝纯化,培养菌株至产生分生孢子,进行单孢纯化,并将纯化后的菌株保存在PDA斜面上,于4℃下保存备用。
1.2 病原菌致病性测定
采取活体植株接种菌饼的方法对分离得到的7株菌进行致病性测定,取两年生健康蓝莓植株,对蓝莓枝条进行表面消毒,用无菌解剖刀制造环状伤口,将直径5 mm菌饼接种到伤口上,用无菌脱脂棉进行保湿处理,以无菌PDA块作为对照,重复3次[4]。置于培养箱中培养(28℃,90%RH)。培养3 d后去掉菌饼,每隔3 d统计发病情况。
1.3 病原菌鉴定
(1) 形态学鉴定:取直径5 mm的菌饼置于PDA上,在25℃、12 h光暗交替条件下培养5 ~7 d,观察菌落形态。将菌饼放置于无菌苜蓿秆+WA培养基上[9]于25℃,黑暗培养,诱导菌株产生分生孢子器,观察菌株产孢情况并测量两种类型分生孢子及产孢结构大小,每种类型的孢子及分生孢子梗测量100个并取其平均值。
(2)分子生物学鉴定:用CTAB法提取菌株总DNA,以ITS1(5′-TCCGTAGGTGAACCTGCGG-3′) /ITS4(5′-TCCTCCGCTTATTGATATGC-3′)以及EF1-728F(5′-CATCGAGAAGTTCGAGAAGG-3′)/EF1-986R(5′-TACTTGAAGGAACCCTTACC-3′)为引物分别扩增菌株ITS及EF1-α基因序列。反应体系以及反应程序参照Udayanga 等[10]的方法。扩增产物经凝胶电泳检测后送至生工生物工程(上海)有限公司进行纯化,测序。
(3) 序列分析:测序结果在NCBI/GenBank中进行比对,下载模式菌株及相关菌株序列以及蓝莓上已经报道的间座壳属菌株序列[3-4,7,10-12](表1)。用Mafft-win软件进行序列比对后,对联合基因分别采用最大简约法(MP)及贝叶斯法(BI)进行分析,以DiaporthellacorylinaCBS121124作为外群。MP分析采用PAUP4.0b10进行,bootstrap重复值采用1 000,将供试序列导入MrMTgui软件,预测出最佳进化模型,用Mrbayes软件对供试序列进行BI分析。结合系统发育分析结果,挑选与供试菌株亲缘关系较近的代表菌株序列,分别进行二次系统发育分析。
表1 用于ITS和EF1-α基因联合构建蓝莓间座壳溃疡病菌系统发育分析的相关模式菌株基因登录号
Table 1 ITS and EF1-α accession numbers in GenBank ofDiaportheisolates used for phylogenetic analyses in this study
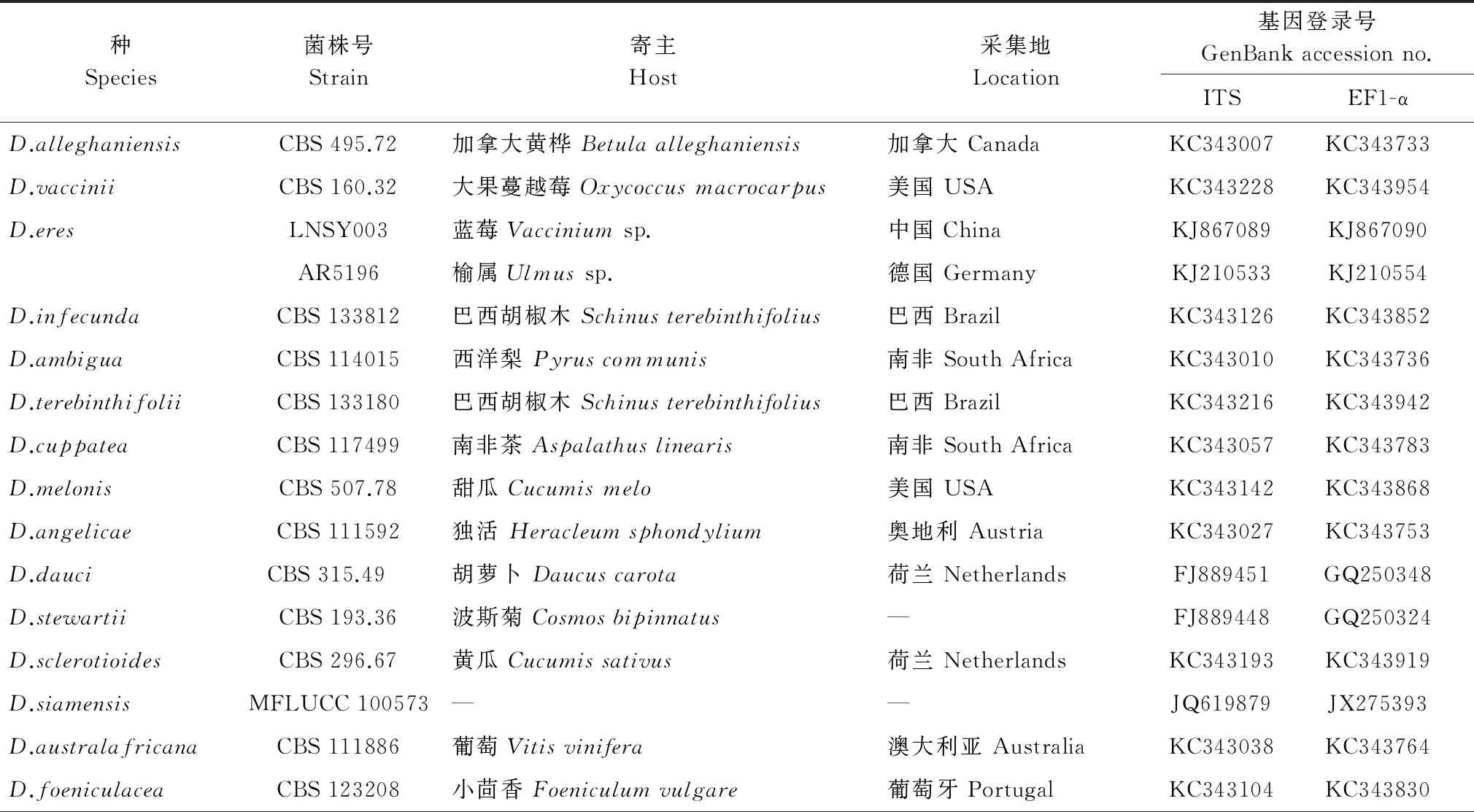
种Species菌株号Strain寄主Host采集地Location基因登录号GenBankaccessionno.ITSEF1-αD.alleghaniensis CBS495.72加拿大黄桦Betulaalleghaniensis加拿大CanadaKC343007KC343733D.vacciniiCBS160.32大果蔓越莓Oxycoccusmacrocarpus美国USAKC343228KC343954D.eresLNSY003蓝莓Vacciniumsp.中国ChinaKJ867089KJ867090AR5196榆属Ulmussp.德国GermanyKJ210533KJ210554D.infecundaCBS133812巴西胡椒木Schinusterebinthifolius 巴西BrazilKC343126KC343852D.ambiguaCBS114015西洋梨Pyruscommunis南非SouthAfricaKC343010KC343736D.terebinthifoliiCBS133180巴西胡椒木Schinusterebinthifolius巴西BrazilKC343216KC343942D.cuppateaCBS117499南非茶Aspalathuslinearis南非SouthAfricaKC343057KC343783D.melonisCBS507.78甜瓜Cucumismelo美国USAKC343142KC343868D.angelicaeCBS111592独活Heracleumsphondylium奥地利AustriaKC343027KC343753D.dauciCBS315.49 胡萝卜Daucuscarota荷兰NetherlandsFJ889451GQ250348D.stewartii CBS193.36波斯菊Cosmosbipinnatus—FJ889448GQ250324D.sclerotioidesCBS296.67黄瓜Cucumissativus荷兰NetherlandsKC343193KC343919D.siamensisMFLUCC100573——JQ619879JX275393D.australafricanaCBS111886葡萄Vitisvinifera澳大利亚AustraliaKC343038KC343764D.foeniculaceaCBS123208小茴香Foeniculumvulgare葡萄牙PortugalKC343104KC343830
续表1 Table 1(Continued)
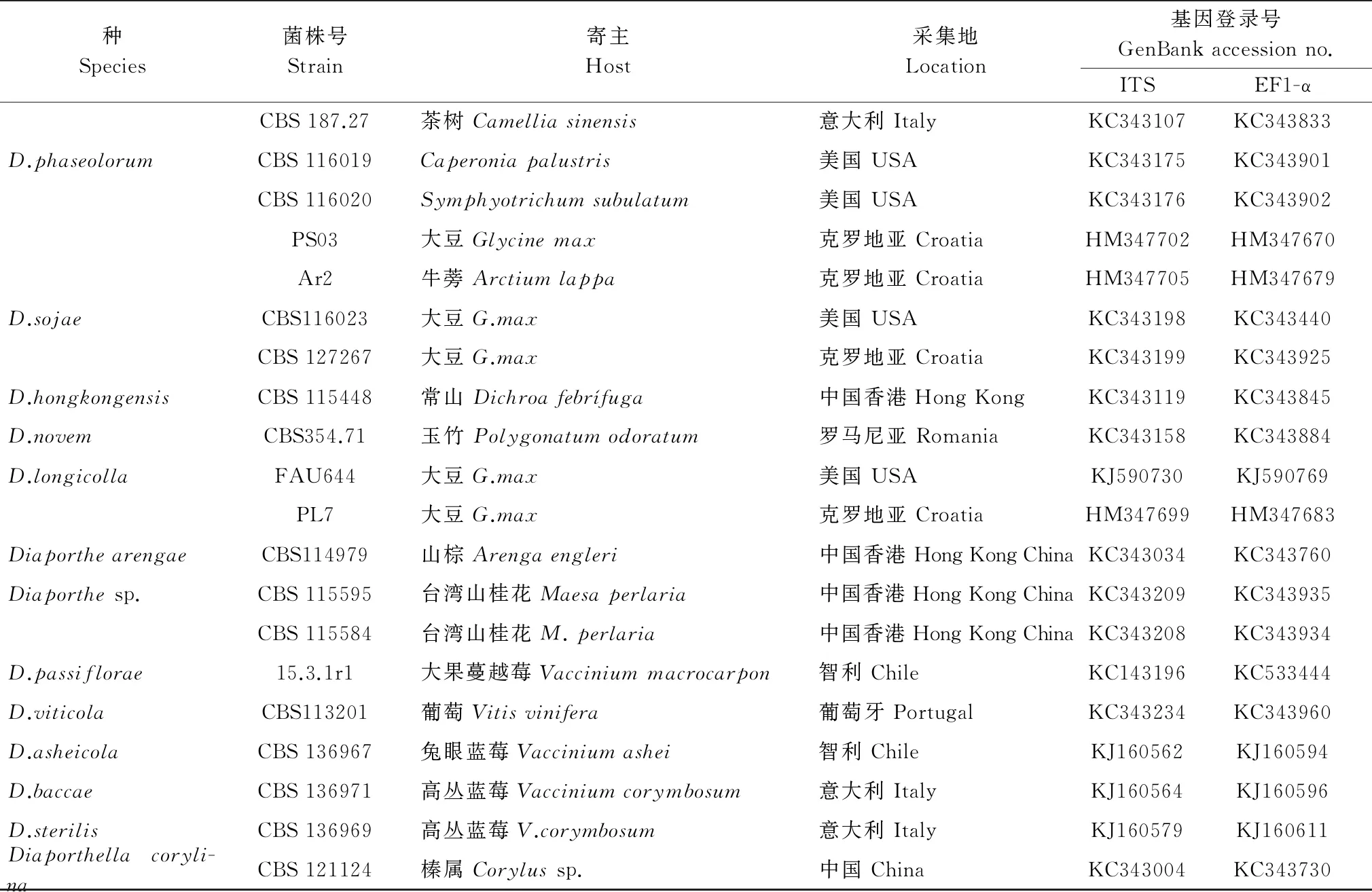
种Species菌株号Strain寄主Host采集地Location基因登录号GenBankaccessionno.ITSEF1-αCBS187.27茶树Camelliasinensis意大利ItalyKC343107KC343833D.phaseolorumCBS116019Caperoniapalustris美国USAKC343175KC343901CBS116020Symphyotrichumsubulatum美国USAKC343176KC343902PS03大豆Glycinemax克罗地亚CroatiaHM347702HM347670Ar2牛蒡Arctiumlappa克罗地亚CroatiaHM347705HM347679D.sojaeCBS116023大豆G.max美国USAKC343198KC343440CBS127267大豆G.max克罗地亚CroatiaKC343199KC343925D.hongkongensisCBS115448常山Dichroafebrífuga中国香港HongKongKC343119KC343845D.novemCBS354.71玉竹Polygonatumodoratum罗马尼亚RomaniaKC343158KC343884D.longicollaFAU644大豆G.max美国USAKJ590730KJ590769PL7大豆G.max克罗地亚CroatiaHM347699HM347683DiaporthearengaeCBS114979山棕Arengaengleri中国香港HongKongChinaKC343034KC343760Diaporthesp.CBS115595台湾山桂花Maesaperlaria中国香港HongKongChinaKC343209KC343935CBS115584台湾山桂花M.perlaria中国香港HongKongChinaKC343208KC343934D.passiflorae15.3.1r1大果蔓越莓Vacciniummacrocarpon智利ChileKC143196KC533444D.viticolaCBS113201葡萄Vitisvinifera葡萄牙PortugalKC343234KC343960D.asheicolaCBS136967兔眼蓝莓Vacciniumashei智利ChileKJ160562KJ160594D.baccaeCBS136971高丛蓝莓Vacciniumcorymbosum意大利ItalyKJ160564KJ160596D.sterilisCBS136969高丛蓝莓V.corymbosum意大利ItalyKJ160579KJ160611Diaporthellacoryli-naCBS121124榛属Corylussp.中国ChinaKC343004KC343730
1.4 病原菌生物学特性研究
将直径5 mm的菌饼分别置于不同培养基 (PDA、Czapek培养基、WA,胡萝卜培养基、蓝莓茎煎汁培养基),不同光照条件(分别在全光照、全黑暗、12 h光暗交替、24 h光暗交替),在25℃下培养,分别于5、7、9 d后测量菌落直径,每个处理重复3次。
研究不同温度对供试菌株生长状况的影响,选用5 mm的菌饼作为出发菌落直径,分别置于15、20、25、27和30℃的PDA 平板上培养,培养5、7和9 d后分别测量菌落直径,每个处理重复3次。采用软件Excel 和SPSS 17.0对数据进行整理和分析。
2 结果分析
2.1 病原菌分离
病样经过组织分离后得到菌落形态一致的7株白色菌株,菌株编号及序列登录号见表 2。
表2 从蓝莓上分离得到的茎溃疡病病原菌株
Table 2 Isolates of the pathogen of the blueberry stem canker
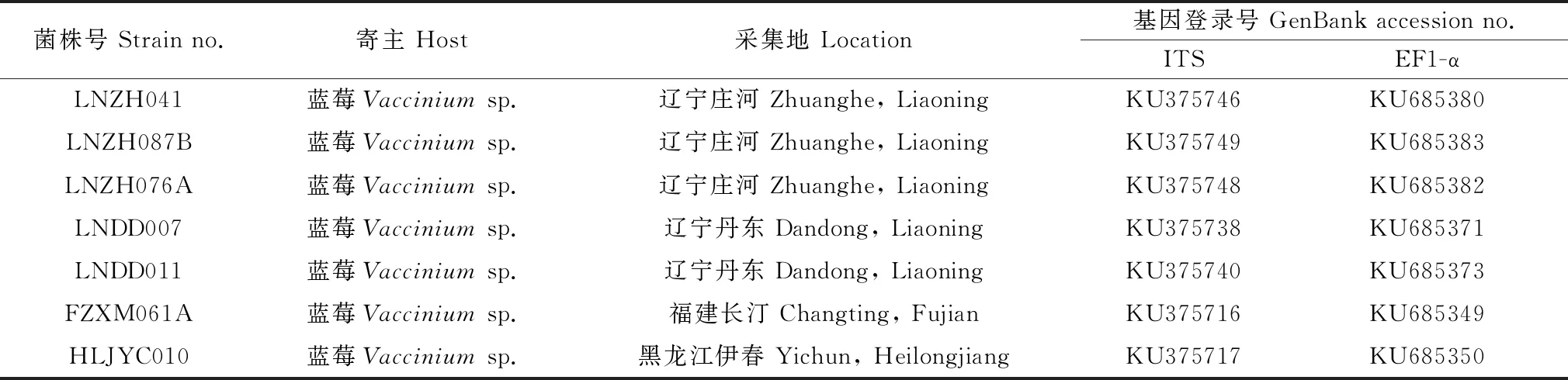
菌株号Strainno.寄主Host采集地Location基因登录号GenBankaccessionno.ITSEF1-αLNZH041蓝莓Vacciniumsp.辽宁庄河Zhuanghe,LiaoningKU375746KU685380LNZH087B蓝莓Vacciniumsp.辽宁庄河Zhuanghe,LiaoningKU375749KU685383LNZH076A蓝莓Vacciniumsp.辽宁庄河Zhuanghe,LiaoningKU375748KU685382LNDD007蓝莓Vacciniumsp.辽宁丹东Dandong,LiaoningKU375738KU685371LNDD011蓝莓Vacciniumsp.辽宁丹东Dandong,LiaoningKU375740KU685373FZXM061A蓝莓Vacciniumsp.福建长汀Changting,FujianKU375716KU685349HLJYC010蓝莓Vacciniumsp.黑龙江伊春Yichun,HeilongjiangKU375717KU685350
2.2 病原菌致病性测定
在28℃条件下,接种3 d后接种部位出现深褐色凹陷病斑,病斑长3~5 mm,病斑环茎,接种9 d后,病斑继续扩展,病斑长10~20 mm,病部中间深褐色,病斑周围淡褐色,对照不发病。将回接发病的蓝莓茎部进行再次组织分离,得到与原接种菌株相同的菌株(图1a,d)。
2.3 病原菌形态学鉴定及生物学特性
菌株在PDA培养基上,25℃、12 h光暗条件下培养7 d。菌落直径达到90 mm,菌落白色毛毡状,菌丝较为致密,形成不规则的同心轮纹(图1b)。在PDA上20 d左右可无规则散生或聚生球形或近球形黑色分生孢子器,分生孢子器顶部分泌不规则黄色分生孢子角。在苜蓿秆上培养15 d左右可以诱导出分生孢子器,通过诱导产生的分生孢子器形态与PDA上产生的分生孢子器相同(图1e,f)。镜检分生孢子器及孢子,分生孢子梗(16.04~24.57)μm×(1.92~2.42)μm(图1g),产生两种类型分生孢子,α型孢子(5.95~7.92)μm×(1.64~2.59)μm,无色透明,单孢,椭圆形,含2个油球,β型孢子(6.69~19.79)μm×(0.62~1.18)μm无色透明,单胞,线形,一端较直,另一端稍弯,没有观察到γ型分生孢子(图1c)。
在不同培养基、不同光照及不同温度条件的试验结果表明:供试菌株适宜在PDA上生长,在PDA上生长最快,7 d菌落直径90 mm。在不同温度条件下菌株生长速度快慢顺序为25℃>30℃>27℃>20℃>15℃,菌株在25℃条件下生长快,7 d菌落直径为90 mm,在15℃和20℃条件下菌丝生长速度最慢,培养9 d菌丝仍未长满整个培养皿(90 mm)。光照对菌丝生长无明显影响,在4种条件下菌丝均能正常生长。

图1 蓝莓茎溃疡病症状及病原菌形态特征Fig.1 Symptoms of the blueberry stem canker and morphological characteristics of the pathogen
2.4 分子生物学鉴定
供试菌株的ITS序列长度为555~584 bp,EF1-α序列长度为323 bp,将其与GenBank下载的模式菌株的序列进行单独及联合系统发育树分析。基于联合基因的系统发育树结果显示,供试菌株与Ar2、PS03、CBS116019及CBS116020归为一个类群(PP值1/BS值99),位于Diaporthephaseolorum种群内,与已报道的D.vaccinii、D.ambigua、D.australafricana、D.neotheicola(现已归入D.foeniculacea)、D.viticola、D.asheicola、D.baccae、D.sterilis和D.passiflorae及D.eres处于不同的分支(图2)。结合形态学特征,鉴定该病原菌为Diaporthephaseolorum。

图2 基于ITS和EF1-α基因联合构建的蓝莓间座壳溃疡病菌的系统发育树Fig.2 Phylogenetic analysis based on combined ITS and EF1-α gene sequences of the blueberry stem canker
3 结论与讨论
间座壳属真菌无性型为拟茎点霉属Phomopsis,可作为植物的致病菌及内生菌[10],也可侵染人类皮肤[13],具有广泛的寄主范围,间座壳属真菌作为致病菌通常引起植物的溃疡、枯死、根腐、果腐、叶斑病、枯萎病,可造成植物大面积枯萎[14]。
Diaporthephaseolorum可引起大豆茎溃疡病[15],也是葡萄、菜豆等重要经济作物的病原菌[11],本研究首次在蓝莓上分离到该种。现在对于间座壳属真菌的鉴定通常采用分子生物学的方法,已经有许多运用ITS序列结合形态学特征来鉴定间座壳属真菌的研究:Murali等[16]研究来自柚木Tectonagrandis叶片内的11个内生菌株的ITS序列,支持来自柚木的间座壳属菌株没有寄主专化性这一结论。但ITS序列分析也在属间显示大量的交叉,多基因联合分析比单个基因分析能够更好地对菌株进行区分。例如Santos等和van Rensburg等[14,17]运用ITS和EF1-α序列结合形态学和菌落特征将引起南非博士茶Aspalathuslinearis顶梢枯死的间座壳属菌株分为5个种。本文选择供试菌株以及相关菌株的ITS与EF1-α基因联合构建系统发育树,能够很好地将供试菌株与其近缘种(D.sojae、D.longicolla)及蓝莓上已报道的间座壳属其他种真菌进行区分。
本研究系统发育树结果显示D.vaccinii与D.eres亲缘关系较近,D.neotheicola(现已归入D.foeniculacea)与D.baccae具有较近的亲缘关系,而D.viticola和D.asheicola为D.australafricana的近缘种,此结果与Lorenzo等的研究结果一致[5]。本文报道的D.phaseolorum不仅在系统发育上与蓝莓上已报道的间座壳属菌株处于不同分支,在菌落形态、侵染症状上也存在差异,Diaporthevaccinii在PDA上生长的菌落形态具有非常明显的环状轮纹,分层明显[3],本试验菌株菌落边缘平坦,无明显分层现象。由D.ambigua,D.australafricana,D.neotheicola和D.passiflorae引起的茎部病害呈不规则病斑,病斑周围红色,病菌从嫩枝侵入造成嫩枝枯死[7]。我国报道的Diaportheeres从蓝莓枝条芽眼侵入,造成蓝莓芽枯病[7]。在国外Diaporthevaccinii主要危害蓝莓[3],我国已经报道D.vaccinii[6]和D.eres[7]两个种侵染蓝莓,造成蓝莓枝枯病和芽枯病,对蓝莓造成严重危害。本研究结果表明D.phaseolorum也可侵染蓝莓,造成蓝莓茎部溃疡病,这是在我国新发现的可以引起蓝莓病害的间座壳属真菌。
[1] 李亚东, 孙海悦, 齐孟. 我国小浆果选种、育种概况及展望[J]. 东北农业大学学报, 2012, 43(10): 1-9.
[2] 李亚东, 唐雪东, 袁菲, 等. 我国小浆果生产现状、问题和发展趋势[J]. 东北农业大学学报, 2011, 42(1): 1-9.
[3] Farr D F, Castlebury L A, Rossman A Y.Morphological and molecular characterization ofPhomopsisvacciniiand additional isolates ofPhomopsisfrom blueberry and cranberry in the eastern United States [J].Mycologia,2002, 94(3): 494-504.
[4] Elfar K, Torres R, Díaz G A, et al. Characterization ofDiaportheaustralafricanaandDiaporthespp. associated with stem canker of blueberry in Chile [J]. Plant Disease, 2013, 97(8): 1042-1050.
[5] Lombard L, van Leeuwen G C M, Guarnaccia V, et al.Diaporthespecies associated withVacciniumwith specific reference to Europe [J]. Phytopathologia Mediterranea, 2014, 53(2): 287-299.
[6] 岳清华, 赵洪海, 梁晨, 等. 蓝莓拟茎点枝枯病的病原[J]. 菌物学报, 2013, 32(6): 959-966.
[7] 严雪瑞, 王旭, 胡梦琼, 等. 蓝莓间座壳芽枯病病原菌鉴定及其生物学特性[J]. 植物病理学报, 2015, 45(5): 556-560.
[8] 方中达. 植病研究方法[M]. 第3版.北京: 中国农业出版社, 1998.
[9] Udayanga D, Castlebury L A, Rossman A Y, et al. Species limits inDiaporthe: molecular re-assessment ofD.citri,D.cytosporella,D.foeniculinaandD.rudis[J].Persoonia,2014,32(1):83-101.
[10]Udayanga D, Liu Xingzhong, Crous P W, et al. A multi-locus phylogenetic evaluation ofDiaporthe(Phomopsis)[J]. Fungal Diversity, 2012, 56(1): 157-171.
[11]Asha J D, Liu Mei, Zhang Wei, et al. Morphological and molecular characterisation ofDiaporthespecies associated with grapevine trunk disease in China[J]. Fungal Biology, 2015, 119(5): 283-294.
[12]Gomes R R, Glienke C, Videira S I R.Diaporthe: a genus of endophytic, saprobic and plant pathogenic fungi [J]. Persoonia, 2013, 31: 1-41.
[13]Mattei A S, Severo C B, Guazzelli L S, et al. Cutaneous infection byDiaporthephaseolorumin Brazil [J]. Medical Mycology Case Reports, 2013, 2: 85-87.
[14]Santos J M, Phillips A J L.Resolving the complex ofDiaporthe(Phomopsis) species occurring onFoeniculumvulgarein Portugal [J]. Fungal Diversity, 2009, 34: 111-125.
[15]Pioli R N, Morandi E N, Martinez M C, et al. Morphologic, molecular, and pathogenic characterization ofDiaporthephaseolorumvariability in the core soybean-producing area of Argentina [J]. Phytopathology, 2003, 93(2): 136-146.
[16]Murali T S, Suryanarayanan T S, Geeta R.EndophyticPhomopsisspecies: host range and implications for diversity estimates [J]. Canadian Journal of Microbiology, 2006, 52(7): 673-680.
[17]van Rensburg J C J, Lamprecht S C, Groenewald J Z, et al. Characterization ofPhomopsisspp. associated with die-back of rooibos (Aspalathuslinearis) in South Africa[J]. Studies in Mycology, 2006, 55: 65-74.
(责任编辑:田 喆)
Identification and biological characteristics of a blueberryDiaporthestem canker pathogen
Li Yuan, Shi Lingbo, Fei Nuoya, Fu Junfan, Yan Xuerui
(CollegeofPlantProtection,ShenyangAgriculturalUniversity,Shenyang110866,China)
A kind of blueberry stem canker was found in blueberry plantation and the symptoms consist of red-brown and elliptical stem canker. In order to identify the pathogen, seven isolates were obtained by isolation and purification. Phylogenetic analysis of combined ITS and EF1-α gene sequences showed that the isolates were located in the same clade withDiaporthephaseolorum. Compared with the morphological characteristics, the isolates were identified asD.phaseolorum. The biological characteristics test showed that 25℃, PDA were the best culture conditions, and it was not sensitive to light. This is the first report ofD.phaseolorumcausing diseases on blueberry.
blueberry;Diaporthe; stem canker; identification
2016-08-19
2016-09-19
公益性行业(农业)科研专项(201103037);沈阳市科技计划项目(F15-167-4-00,F15-079-3-00)
S436.639
A
10.3969/j.issn.0529-1542.2017.01.014
* 通信作者 E-mail: berrypest@126.com

