流式细胞仪在放射生物学实验教学中的应用
吴安庆, 聂 晶, 裴海龙, 张 健, 周光明
(苏州大学 放射医学与防护学院, 江苏 苏州 215123)
流式细胞仪在放射生物学实验教学中的应用
吴安庆, 聂 晶, 裴海龙, 张 健, 周光明
(苏州大学 放射医学与防护学院, 江苏 苏州 215123)
根据放射医学专业的实验教学特点,开设了第二课堂讲述流式细胞术的原理和应用,并设计了使用流式细胞仪检测X射线照射后肿瘤细胞的凋亡和周期的实验课。同时,每个星期安排固定时间让学生练习操作,熟练掌握流式细胞仪,加强学生对理论知识的理解,提高学生的科研兴趣和动手能力。
流式细胞仪; 放射生物学; 实验教学
流式细胞术是利用流式细胞仪对处在快速、 直线、流动状态中的单个细胞或生物颗粒逐个进行多参数、快速定量分析和分选的技术[1]。现代流式细胞仪产生于20世纪70年代,经过几十年的发展和完善,今天的流式细胞仪已经十分成熟,并被广泛地运用于从基础研究到临床实践的各个方面,涵盖了细胞生物学、免疫学、血液学、肿瘤学、药理学、遗传学及临床检验等领域,在各学科中发挥着重要的作用[2-4]。
苏州大学放射医学与防护学院实验教学平台,2015年购置了一台美国 BD 公司生产的型号为Verse的分析型流式细胞仪,主要应用于放射医学相关科学研究,包括X射线照射对动物及细胞急性效应和远期效应的研究工作,涉及了细胞凋亡、细胞周期、免疫细胞分型、细胞内蛋白表达、细胞表面分子、胞内游离钙离子、核酸含量、线粒体膜电位等诸多方面。现在,我们在放射生物学、放射毒理学、核医学等专业的实验教学中尝试使用流式细胞技术,带领学生利用流式细胞仪探索射线照射细胞引起的生物效应,极大激发了学生对专业课基本实验的兴趣。
1 流式细胞仪的原理
流式细胞仪主要由液流系统、光学系统、电子系统、数据处理系统和细胞分选系统 5 个部分组成。通过液压系统将经荧光物质染色的单细胞悬液压入流动室,形成极细的悬浮细胞液流与鞘液交汇、鞘液包裹逐一排列的细胞,形成中间慢、周边快的柱状流束,经过检测区时,在激光器发出的激光束照射下,细胞或分散颗粒产生散射光和荧光[3]。一般在与激光束成 0°和 90°角的方向上接收散射光,包括前向角散射光( forwardscatter,FSC ) 及 侧 向 角 散 射 光 ( side scatter,SSC ) 。FSC 主要反映细胞或分散颗粒的大小,SSC 主要反映细胞质、 胞膜、 核膜的折射情况以及细胞内颗粒的复杂程度[4]。 荧光信号包括自发荧光和特征荧光,自发荧光指样本固有的荧光分子发出的荧光,特征荧光是与细胞表面或内部待测物质结合的荧光染料发出的荧光。荧光信号的强弱反映了所测细胞表面分子的数量或细胞内物质的浓度[4-6]。光信号经过一系列滤光片和反射镜分离后,经光电倍增管接收转化为电信号,再经模/数转换器转换为可被计算机识别的数字信号,再通过控制软件对数据进行分析处理[5]。
2 仪器培训
针对我院的本科生和研究生,学院在课余时间开设第二课堂,专门介绍一些实验用大型仪器。在第二课堂向学生详细介绍流式细胞仪的结构原理及应用,解析每个系统的结构及各个系统之间的相互联系与作用,使学生对流式细胞仪有整体了解。经过第二课堂的理论培训后,带学生进入流式细胞仪实验室,实地察看仪器。首先打开仪器的外壳,逐一介绍仪器内部主要备配件,包括405/488/640 nm激光器、流动室、滤光片、光纤等。然后演示开机程序,包括打开机器主开关、 开计算机和控制软件、 添加鞘液和倾倒废液等。仪器预热稳定后,做开机前的清洗,包括冲洗鞘液的滤网、排气泡、冲洗流动室。开机程序完成后,以单色和双色实验为例,向学生演示如何使用流式细胞仪检测样本及相关调节,包括建立检测方案、 电压调节、 荧光补偿调节、样品的采集、 结果分析、 数据的导入导出等。 最后进行仪器关机及日常维护和质检。通过理论介绍和观摩学习后,学生对流式细胞术的理论知识有了一定的了解。另外,在每个星期五的下午开放流式细胞仪给学生练习操作,保证每个学生都有动手操作的机会,并能够熟练掌握仪器和软件的操作。
3 实验课设计
(1) 实验题目:使用流式细胞仪检测X射线照射对肿瘤细胞的凋亡和周期的影响。
(2) 实验目的:掌握碘化丙啶(Propidium iodide,PI)和Annexin-V荧光探针染色法测定细胞凋亡和细胞周期,了解流式细胞仪原理和使用,初步探索X射线对肿瘤细胞的杀伤效应。
(3) 实验原理:细胞凋亡是一种由基因控制的具有一定特征性形态和生化改变的细胞程序性死亡过程[7],辐射及其他因素均可诱导细胞凋亡[8]。细胞凋亡早期位于胞膜内侧的磷酯酰丝氨(phosphatidylserine,PS)会翻转到细胞膜外表面[9]。 Annexin-V 能与 PS 高亲和特异性结合,利用这一原理可以使用Annexin V 检测凋亡早期细胞[10]。碘化丙啶(propidine iodide,PI)为一种核酸染料,它不能透过正常及早期凋亡细胞的细胞膜,但是凋亡中晚期及死细胞的细胞膜已经严重破损,此时PI 可以透过细胞膜进入细胞核与核酸结合。所以Annexin-V-FITC单染的细胞是凋亡早期细胞, Annexin-V-FITC/PI 双染色的细胞是凋亡晚期细胞,利用流式细胞仪检测2种染料的荧光信号,即可得到细胞凋亡的数据[11]。细胞周期是利用PI和核酸结合,通过检测PI的荧光强度来定量细胞中核酸的含量,其中G2/M期细胞中的核酸含量是G0/G1期细胞的2倍,所以通过细胞中核酸含量可以确定细胞周期中的时相[12]。
(4) 仪器和材料:流式细胞仪,X射线机,CO2培养箱,超净工作台,低温离心机,移液器,人非小细胞肺癌细胞系A549,胎牛血清,PRMI1640,PBS(磷酸盐缓冲液),0.25%胰酶,AnnexinV-FITC(磷脂结合蛋白),PI(碘化丙啶染料),RNA酶,70%乙醇。
4 实验方法
4.1 实验一:检测X射线照射对A549细胞凋亡的影响
(1) 人非小细胞肺癌细胞A549培养。将冻存的A549细胞复苏后,接种在含10%胎牛血清的PRMI1640培养液中,放置在5% CO2培养箱中37 ℃培养。待细胞贴壁生长到80%左右,在超净工作台里面,消化细胞,将细胞传代接种在若干直径为60 mm的培养皿内,1~5×105细胞每皿。
(2) 分组。将上一步已经接种有细胞的培养皿分为2组,一组不照射,另一组照射X射线。
(3) 照射。将照射组的细胞放进X射线机中照射X射线,剂量为4 Gy。
(4) 收样。照射后2组细胞继续培养48 h后,先离心收集培养基中的漂浮细胞,然后使用0.25%胰酶消化皿底贴壁细胞,加入离心管离心,弃上清获得细胞。再用预冷的PBS洗涤细胞2次,每次均需1 000 r/min,4 ℃离心5 min。
(5) 染色。加入100 μL PBS重悬细胞,再加入5 μL Annexin-V-FITC和5 μL PI ,轻轻混匀。另外,需要做一个单染 Annexin-V-FITC和一个单染PI的样本。避光、室温反应15 min后加入400 μL PBS,混匀。
(6) 流式细胞仪检测。在仪器控制软件中建立检测细胞凋亡的程序,用单染 Annexin-V-FITC和单染PI的样本调节电压和补偿。每个样本收集1万个细胞,获取数据分析结果。
4.2 实验二:检测X射线照射对A549细胞周期的影响
(1)—(3) 步同实验一。
(4) 收样。照射后两组细胞继续培养12 h后,使用0.25%胰酶消化皿底贴壁细胞,加入离心管1 000 r/min、4 ℃离心5 min,弃上清获得细胞。
(5) 固定。各组细胞中加入预冷70%乙醇1 mL重悬细胞,于4 ℃固定过夜,或-20 ℃长期固定
(6) 染色。离心弃上清收集细胞,以1 mL的PBS洗细胞一次,再加入500 μL PBS与染料混合液(含50 μg/mL溴化丙锭(PI),100 μg/mL RNase A,0.2% Triton X-100)重悬细胞,4 ℃避光孵育30 min。
(7) 过滤。使用300目的滤网对染色后的细胞悬液进行过滤,滤除细胞团。
(8) 流式细胞仪检测。在仪器控制软件中建立检测细胞周期的程序,收集2~3万个细胞,获取数据并用ModFit软件分析。
5 实验结果分析
凋亡受阻是肿瘤发生的主要原因,诱导肿瘤细胞分化和凋亡已成为当前肿瘤治疗的热点[13]。 本实验课带领学生初步探讨了一定剂量 X 射线照射对肺癌 A549 细胞凋亡和周期的影响。凋亡的检测结果如图1所示。使用双参数散点图中的十字门将处于不同凋亡时期的细胞群体分开,x轴表示Annexin-V的荧光强度,y轴表示PI的荧光强度。结果显示X射线照射组的早期凋亡细胞比例为5.39%,晚期凋亡为4.81%,与不照射组比较,凋亡细胞明显增加。这一现象说明X射线照射细胞后,引起细胞凋亡。X射线对A549细胞周期的影响,通过ModFit软件分析,结果如图2所示,照射组的G0/G1期细胞比例为45.8%、S期为28.9%、G2/M期为25.3%,与不照射组比较,细胞周期发生了变化,出现G2/M期阻滞。
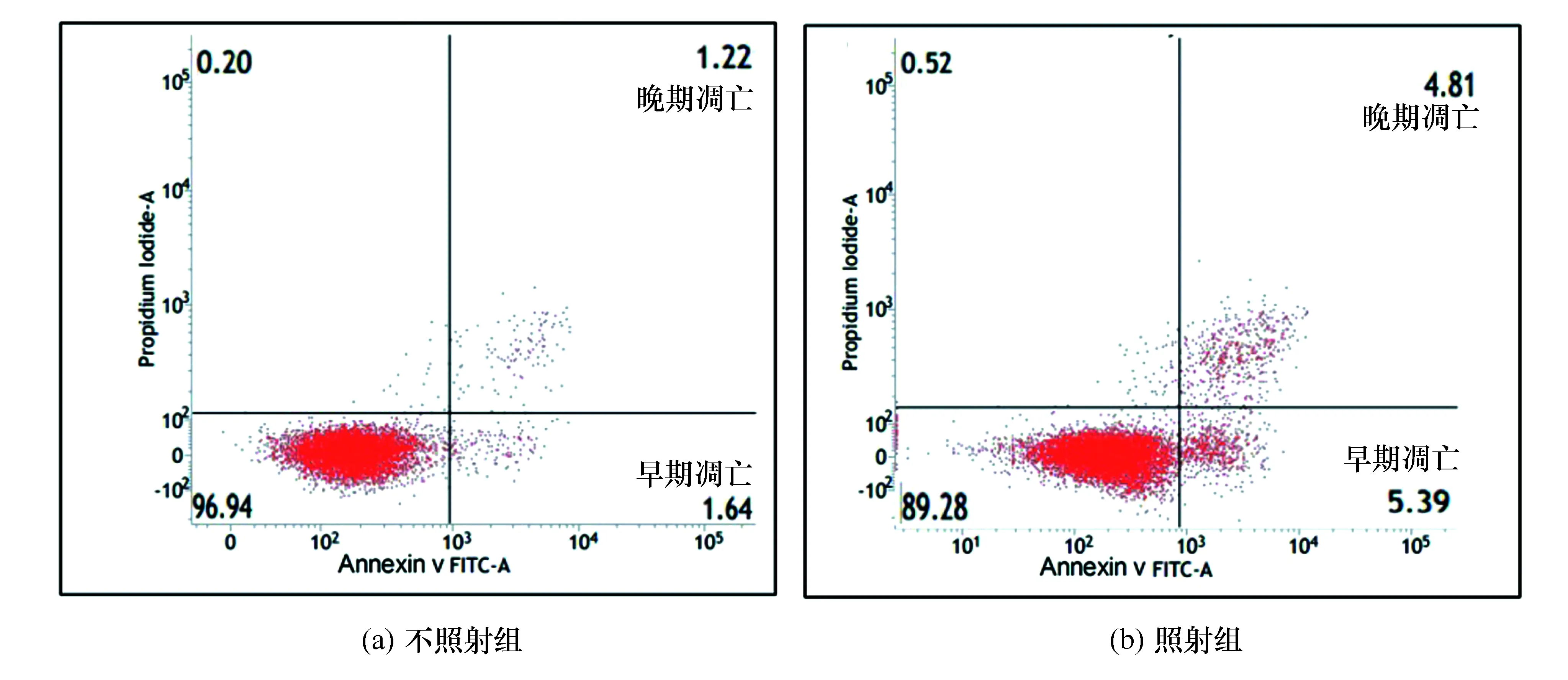
图1 X射线照射后A549的细胞凋亡

图2 X射线照射后A549的细胞周期
6 结语
将流式细胞仪应用于放射生物学的实验教学,可以让教学和科研、理论与实践有效结合。利用课余时间开设第二课堂,讲解与流式细胞仪相关的基础知识,有助于学生对仪器的全面了解。每个星期安排专门的时间供学生练习操作仪器,提高了学生的动手能力。同时,开设使用流式细胞仪检测X射线照射后肿瘤细胞的凋亡和周期的实验课,带领学生初步探索X射线治疗肿瘤的原理,可以将临床上肿瘤放疗的实践与课堂学习的理论知识有机结合,极大激发了学生的学习兴趣,有利于提高教学质量,取得较好的教学效果。同时,每个学生都学会流式细胞仪的操作,提高了仪器使用率,让现有的大型仪器更好地为教学和科研服务。
References)
[1] 王书奎,周振英.实用流式细胞术彩色图谱[M].上海:第二军医大学出版社,2004.
[2] 杜立颖,张丽君.流式细胞术新实验的开发[J].实验技术与管理,2004,21(6):17-20.
[3] 邓喜林,林跃智,李蕊,等.流式细胞术在免疫学上的应用及其发展前景[J].东北农业大学学报,2009,40(6):137-140.
[4] 李志,杨明杰,周建嫦.流式细胞术在毒理学检测中的应用[J].卫生研究,2004,33(4):504-507.
[5] 张英,黎宏宇,李莉,等.流式细胞术在实验教学中的开发与应用[J].实验室研究与探索,2013,32(7):206-208.
[6] 赵书涛,武晓东,王策,等.流式细胞仪的原理、应用及最新进展.[J].现代生物医学进展,2011,22(1):4378-4381.
[7] Kurdi M,Booz G W. Jak inhibition,but not Stat1 knockdown,blocks the synergistic effect of IFN-gamma on Fasinduced apoptosis of A549 human non-small cell lung cancer cells[J].J Interferon Cytokine Res,2007,27(1):23-31.
[8] Chen Q,Xia X,Wu S,et al.Apoptosis,necrosis,and autophagy in mouse intestinal damage after 15-Gy whole body irradiations[J].Cell Biochem Funct,2014,32(8):647-56.
[9] 丛玉隆.流式细胞仪及其临床应用[J].医学检验与临床,2006,17(4):1-2.
[10] Vermes J,Haanen C,Steffens N,et al.A novelassay for apoptosis:Flow cytometric detetion of phosphatidy lserineex pression on early apoptic cells using fluoreescine labeled Annexin V[J]. Immunol Methods,1999,184(1):39-42.
[11] 吴建勇,赵德璋.流式细胞仪检测细胞凋亡的几种方法的比较[J].重庆医科大学学报,2010,35(9):1386-1389.
[12] Lee Y M,Ting C M,Cheng Y K,et al. Mechanisms of 2-methoxyestradiol-induced apoptosis and G2/M cell-cycle arrest of nasopharyngeal carcinoma cells[J].Cancer Lett,2008,268(2):295-307.
[13] 罗利民.电离辐射对肺癌A549 细胞凋亡及细胞周期的影响[J].肿瘤学杂志,2009,15(5):401-411.
Application of flow cytometry to experimental teaching of radiobiology
Wu Anqing, Nie Jing, Pei Hailong, Zhang Jian, Zhou Guangming
(School of Radiation Medicine and Protection,Soochow University,Suzhou 215123, China)
Based on the characteristics of experimental teaching in Radiation Medicine, a second class is set up to teach principles and applications of flow cytometry, and an experimental lesson is designed for students to learn how to use flow cytometry to detect the apoptosis and cell cycle of tumor cells after X-ray irradiation.Besides,making a fixed time schedule for students to practice by themselves, can improve the students’ interest in scientific research and ability in practical operation.
flow cytometry; radiobiology; experimental teaching
10.16791/j.cnki.sjg.2017.01.044
2016-07-04 修改日期:2016-09-22
江苏省高校放射医学协同创新中心项目(SX12800114);中国博士后第59批面上资助项目(7131705016)
吴安庆(1987—),男,安徽枞阳,在职博士研究生,助理实验师,研究方向为肿瘤免疫
E-mail:aqwu115@suda.edu.cn
周光明(1970—),男,湖北枝江,博士,教授,研究方向为空间辐射生物学.
E-mail:gmzhou@suda.edu.cn
G424.28
A
1002-4956(2017)1-0184-03

