一种驴和马及狐狸源性成分快速检测方法的研究
卞如如,范阳阳,刘艳艳,霍胜楠,盛清凯,谭晴晴,张全芳,张 卉,步 迅*
(1.山东省农业科学院生物技术研究中心,山东省农业科学院应用生命科学实验室,山东济南 250100;2.山东省食品药品检验研究院,山东济南 250101;3.山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,山东济南 250100)
一种驴和马及狐狸源性成分快速检测方法的研究
卞如如1,范阳阳1,刘艳艳1,霍胜楠2,盛清凯3,谭晴晴1,张全芳1,张 卉2,步 迅1*
(1.山东省农业科学院生物技术研究中心,山东省农业科学院应用生命科学实验室,山东济南 250100;2.山东省食品药品检验研究院,山东济南 250101;3.山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,山东济南 250100)
实验旨在建立快速检测驴、马和狐狸源性成分的方法。以驴、马和狐狸的线粒体保守序列16S rRNA基因为靶基因,设计通用引物和以不同荧光素标记的特异Taq Man探针,构建与通用引物共用的阳性扩增内标(Internal Amplification Control,IAC)作为PCR监控反应体系。通过优化PCR反应体系和条件,建立能同时检测驴、马和狐狸源性成分的四重实时荧光PCR方法。结果表明:利用驴、马、狐狸、牛、猪、羊、水貂、狗、鸡、鸭、大豆、小麦、玉米等物种检测没有交叉反应,证明该方法特异性高,准确性好。该方法模板DNA检测灵敏度为0.01 ng。本研究建立的驴、马和狐狸源性四重荧光实时PCR检测体系灵敏度高、特异性强,能有效鉴别动物产品中驴、马和狐狸的源性成分,也可用作相关动物皮张真伪的鉴别方法。
16S rRNA基因;多重实时荧光PCR法;驴;马;狐狸;源性成分
驴肉享有“天上龙肉,地下驴肉”的美誉。近年来,利用廉价肉类掺假驴肉的现象层出不穷,对人类的健康造成极大威胁。为了确保食品标签真实准确,加强食品标识管理,改进食品安全和保护消费者利益,应积极开展动物源性成分检测方面的研究。目前,动物源性成分鉴别的方法主要包括物理、化学、免疫学和分子生物学方法[1],其中以分子生物学为基础的多重实时荧光PCR法成为检测的重要工具[2]。该技术可有效地检测食品中的重要性肉类物种源性成分,包括猪肉、鸡肉、牛羊肉等[3-5]。不同物种检测范围最广的也集中于肉类检测例如对驴、马源性成分的检测[6-7]。目前,对食品中动物源性的荧光定量PCR检测研究均缺乏阳性扩增内标(Internal Amplification Control,IAC)监控反应体系,无法避免由反应抑制因素而造成假阴性结果。因此,建立添加有外源扩增内标的食品中驴肉、马肉和狐狸肉的多重荧光定量PCR检测方法对食品安全的快速监管具有重要的创新实践意义。本研究以线粒体16S rRNA基因为靶基因,分别设计驴、马和狐狸源性特异性引物和探针,成功建立了能同时检测驴、马和狐狸源性成分的多重实时荧光PCR体系,同时可适用于饲料、肉类、奶类、皮毛类和动物油脂类等动物产品中的驴、马和狐狸源性成分的鉴定。
1 材料与方法
1.1 实验材料 生熟驴肉、马肉、狐狸肉、生牛肉、生绵羊肉、生猪肉、生山羊肉、生兔肉、生鸭肉、生鸡肉、生鹅肉、生鱼肉、玉米、小麦等均购自济南市农贸市场。此外,150份驴肉产品,五香驴肉、驴肉火烧、驴肉卷、酱驴肉、驴肉香肠均购自于济南市各大超市、农贸市场等。
1.2 试剂与仪器 动物组织提取试剂盒为OMEGA品牌。TaqTMHot star Version 热启动酶、dNTPs、Mg2+、DNA分子量MakerDL 2 000、电泳上样缓冲液等PCR反应试剂购自宝生物工程(大连)有限公司。引物与探针由生工生物工程(上海)有限公司负责合成。2×TaqMan Master Mix为DBI Bio science品牌。 DNA测序由山东省农科院生物技术中心测序中心完成。
ABI 7500荧光定量PCR仪为ABI公司产品,TaKaRa PCR仪为宝生物工程(大连)有限公司产品。5424 D型高速离心机为Ependorf公司产品,凝胶成像仪为BIO-RAD公司产品。
1.3 实验方法
1.3.1 样品DNA的提取 取待测样本50 g研磨充分混匀,取50 mg进行DNA提取,可依照动物组织提取试剂盒中的操作说明提取DNA。Nanodrop核酸检测仪检测DNA样本浓度和纯度,要求在1~ 20 ng/ μL,OD值1.7~1.8。

图1 驴、马和狐狸的同源性对比序列图
1.3.2 引物与探针的设计 从GenBank数据库中提取包括驴(NC_016061.1)、狐狸(NC_008434.1)和马(AY584828.1)的线粒体16S rRNA基因序列,利用DNAMan软件进行同源性比对(图1),利用Primer5和Primer3软件分别设计引物和探针,在3个物种的Consensus序列设计1对通用引物进行扩增,扩增片段为200 bp左右,在差异明显区设计3条特异性Taq Man探针分别针对驴、马和狐狸,以不同的荧光元素标记。要求设计的引物TM值在55~60℃左右,探针的TM值要高于引物TM值7~10℃,引物和探针序列、扩增片段大小见表1。
1.3.3 质粒的构建 构建内标过程依照参考文献[2]用Perl随机生成一段DNA序列,然后2头加上通用引物序列,使其在NCBI中BlAST后没有找到同源的DNA片段,形成针对驴、马和狐狸检测体系的竞争型内标DNA序列,长度为100 bp。将扩增内标DNA序列委托上海生工人工基因合成,合成片段连接到PMD18-T 载体上,转化感受态细胞DH5α,蓝白斑筛选,挑取白斑,测序验证,用NanodroP微量分光光度计检测质粒浓度,-20℃保存备用。用于扩增阳性内标的探针序列及内标序列见表1。
1.3.4 多重实时荧光PCR扩增体系和反应条件优化 单重PCR反应条件的确立:分别以驴、马和狐狸为研究对象,反应体系设定为20 μL,10×TaqMan Ma stermix 10 μL,对PCR反应参数包括引物浓度,探针浓度及PCR反应条件进行优化筛选。引物浓度为 10 μmol/L,用量梯度分别设为0.1、0.25、0.5、0.75、1.0 μL,探针浓度设为0.5、1.0、2.0、5.0 μmol/L。每次实验采取等量的模板,设定一个变量,以Ct值、荧光增量和平台期等因素作为参考依据,每个成分的浓度重复3次,若结果稳定,则可确定为最佳的浓度值。根据引物和探针的退火温度,对优化好的反应体系在“95℃ 10 min;95℃15 s;55~62℃ 35 s 45个循环”的范围内反复实验,每次实验采取等量DNA模板,每个反应条件重复实验3次,以Ct值、荧光增量和平台期等因素作为参考依据,以确定最佳的反应条件。
多重PCR反应条件的建立:按照上述单重PCR优化好的引物及探针浓度进行组合,以优化后的PCR反应条件“95℃ 10 min;{95℃ 15 s;60℃35 s} 45个循环”进行多重PCR反应,以Ct值、荧光增量和平台期及各探针的荧光信号高低等因素作为参考依据,通过调整各探针的浓度使其荧光信号高低及扩增效率尽量达到一致。
1.3.6 多重荧光PCR方法的特异性 分别从驴肉、马肉、狐狸肉、牛肉、绵羊肉、山羊肉、猪肉、兔肉、鸭肉、鸡肉、鹅肉、鱼肉、玉米、小麦中提取的基因组DNA为模板,按照上述优化的反应体系和反应条件进行荧光定量PCR,检测引物和探针的特异性,每个样本设3次平行实验。

表1 驴、马和狐狸的引物及探针DNA序列
1.3.7 多重荧光PCR方法的灵敏度使用试剂盒提取目标基因组DNA,用Nanodrop定量到50 ng,按10×梯度稀释(10-1、10-2、10-3、10-4、10-5),每个梯度均取2.0 μL为模板量(即10、1、0.1、0.01、0.001 ng)进行多重荧光PCR检测,确定其最低检出限,每个样本设3次平行实验。
1.3.8 多重实时荧光PCR方法重复性实验的检测 分别取纯驴、马和狐狸3个不同样本DNA为模板,按照上述优化好的体系和反应条件进行多重荧光PCR检测,每个样品进行3次复孔的独立重复实验,确定该方法的稳定性。
1.3.9 多重荧光PCR检测方法在市售样本中的实际检测应用 利用所建立的多重荧光PCR反应体系和反应条件,对150份市售的驴肉制品进行实际样本检测,验证此方法的使用价值和检测真实性。
2 结 果
2.1 单重荧光PCR检测方法条件优化 单重PCR反应条件确立:以驴、马和狐狸为研究对象,反应体系设定为20 μL,10×TaqMan Ma ster mix10 μL,对PCR反应参数包括引物浓度,探针浓度及PCR反应条件进行优化筛选。最终确立引物终浓度为0.5 μmol/L,各探针终浓度:驴探针MtlP终浓度为0.2 μmol/L,马特异性探针MtMP终浓度为0.1 μmol/L,狐狸探针MtHP终浓度为0.4 μmol/L,内标质控探针浓度0.1 μmol/L。PCR反应最佳反应条件为95℃ 10 min;{95℃ 15 s;60℃ 35 s} 45个循环。
2.2 多重实时荧光PCR反应体系建立 通过优化实验,选择优先选用20 μ L的PCR扩增体系包括:10×TaqMan Master mix 2.0 μ L,HS-Taq酶(5 U/ μL)0.2 μ L, Primer Mix(5 μ mol/L) 2.0 μ L,Probe Mix(2 μmol/L) 2.0 μ L,IAC DNA(1 pg/μ L) 1.0 μL,DNA模板(1~20 ng/ μ L)2.0 μ L,补水至20 μ L。多重荧光PCR体系可成功的检测驴、马和狐狸3种源性成分及内标质控,均出现明显的扩增曲线(图2)。
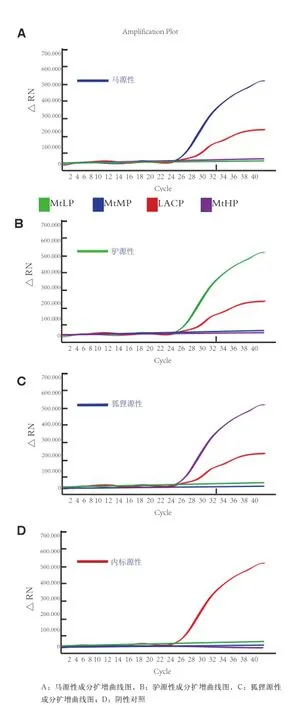
图2 引物和探针特异性结果
2.3 多重荧光PCR方法的特异性实验 通过建立的多重荧光PCR反应体系分别对14种不同物种进行特异性检测,结果显示,驴Ct值为26.32 ± 0.05,马Ct值为27.75 ± 0.02,狐狸Ct值为22.31 ±0.04,驴、马和狐狸均有扩增曲线,而其他样本均无Ct值,判定为阴性(表2)。结果表明,本研究所设计的引物和探针只对含驴、马和狐狸源性成分的物种表现出特异性,与其他检测对象无交叉反应。
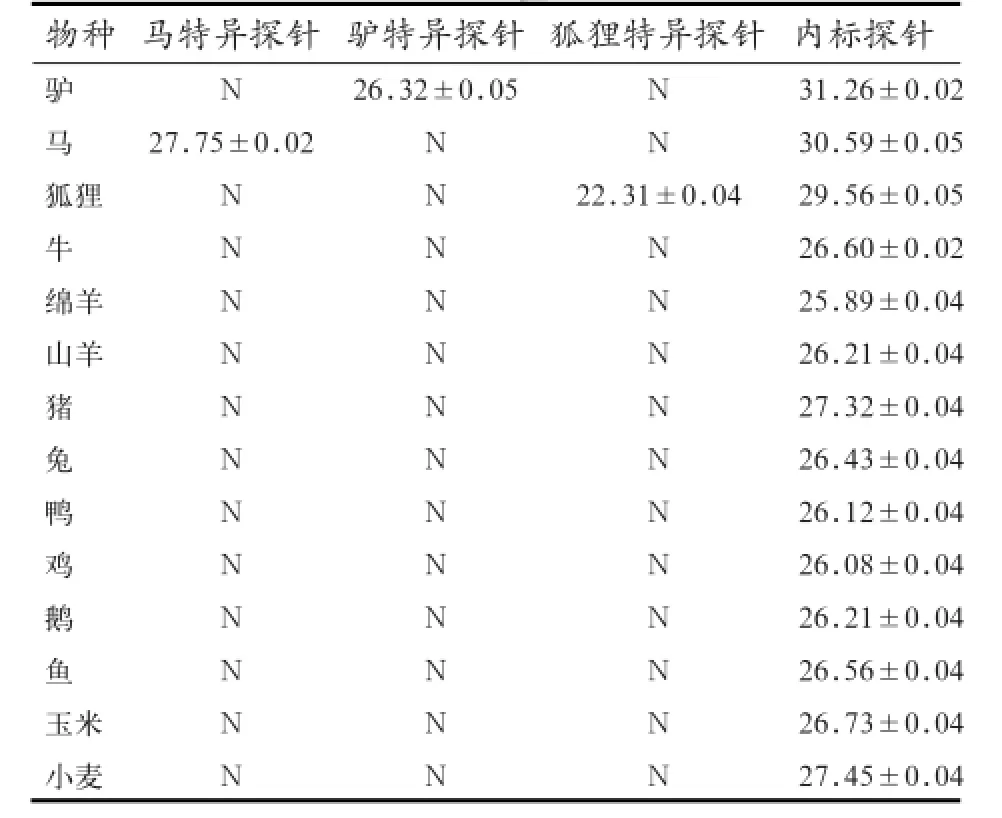
表2 多重实时荧光PCR方法的特异性检测(Ct值±SD)
2.4 多重荧光PCR方法的灵敏度实验 将已测定的驴、马和狐狸基因组DNA进行10×梯度稀释后进行多重荧光PCR检测。结果显示,当驴、马和狐狸基因组DNA模板量为0.01 ng时,均能检出扩增曲线,且扩增阈值Ct值≤35;当模板用量达到0.001ng时扩增曲线极低,因此,本研究中驴、马和狐狸源性成分检出限均为0.01 ng(图3A- C)。
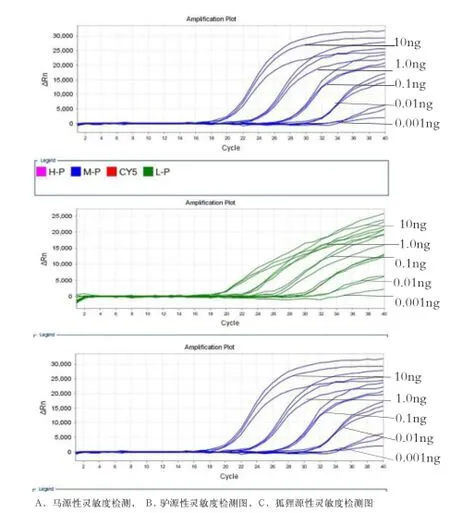
图3 马、驴和狐狸DNA灵敏度检测
2.5 多重实时荧光PCR方法重复性实验 采用多重实时荧光PCR方法对纯马,驴和狐狸样品进行源性成分的重复性检测,每个物种取3个DNA样品,每个样品进行3次独立重复实验。结果发现,每个样品的3次独立重复实验Ct值的标准方差均小于0.05。说明检测结果重复性好,检测稳定性高(表3)。
2.6 市售肉类样品的检测 根据优化的多重实时荧光PCR反应体系和反应条件,对市售的驴肉类样品进行实际的检测,发现市售驴肉产品检出狐狸肉和马肉成分。在30份鲜驴肉中5份检测出马源性成分,40份五香驴肉中检测出10份马源性成分和29份狐狸源性成分,20份五香驴肉火烧中检测出8份马源性成分和7份狐狸源性成分,酱驴肉中检测出7份马源性成分和9份狐狸源性成分,驴肉香肠中检测出5份马源性成分和9份狐狸源性成分,而20份驴肉卷中均未检出驴源性成分(表4)。综上可以证明此种检测方法有一定的使用价值。
3 讨 论
利用实时荧光PCR方法检测目标主要包括常见畜禽类源性成分[8-9]。我国食用驴肉的传统集中在北方地区,肉驴养殖业是我国近年来扶持的热兴养殖项目之一。截止目前,驴源性成分检测方法的研究报道较少,而利用多重实时荧光PCR同时检测驴、马和狐狸3种动物源性成分的未见报道。本研究在参考前人研究的基础上[10-12],分别基于线粒体16SrRNA基因设计驴、马和狐狸共用的1对通用引物和各自特异性探针,同时构建能够有效指示体系中抑制剂存在的竞争性扩增内标,建立了含有扩增内标的食品中驴肉、马肉和狐狸肉成分的TaqMan探针实时荧光PCR检测方法。
目前,多重实时荧光PCR技术鉴定动物源性成分关键技术为靶基因的正确选择。鉴于线粒体基因组结构比较简单、稳定、分子量小,每个细胞中有1 000~10 000个拷贝,容易从组织中分离提取。现在很多学者研究了mtDNA在动物种属鉴定中的应用,与核DNA分子标记相比,具有灵敏度高、精确度好、快速、降解小(加工过程中mtDNA保持较完整)、稳定容易操作等优势。在线粒体DNA中,16SrRNA基因是线粒体基因组中研究较多的基因,为生物所共有,功能相同,既含有保守序列,又含有可变序列其序列变化与进化距离相适应,被称为进化分子钟[13]。基于动物mtDNA的PCR分子标记技术的上述特点,加之多重荧光PCR的快速、灵敏、高通量等特点,因此在动物源性成分鉴别检测中的应用具有广泛的应用前景。本研究基于线粒体加工过程中保持较完整和进化保守性的优势,作为目标靶基因,设计驴、马和狐狸特异引物和探针本研究结果显示多重荧光PCR体系,通过对其引物和探针特异性检测发现,该方法特异性强,与其他物种之间无交叉反应。重复性好,对鲜肉、熟肉均能得到很好的检测结果。本研究方法的建立可以实现驴、马和狐狸3种动物源性成分的快速鉴定,检出限均达到0.01 ng,具有较高的灵敏度;进一步通过对市售产品的实际检测,证明其实际的应用价值,表明该检测体系可作为市场驴源性产品有效的检测方法。
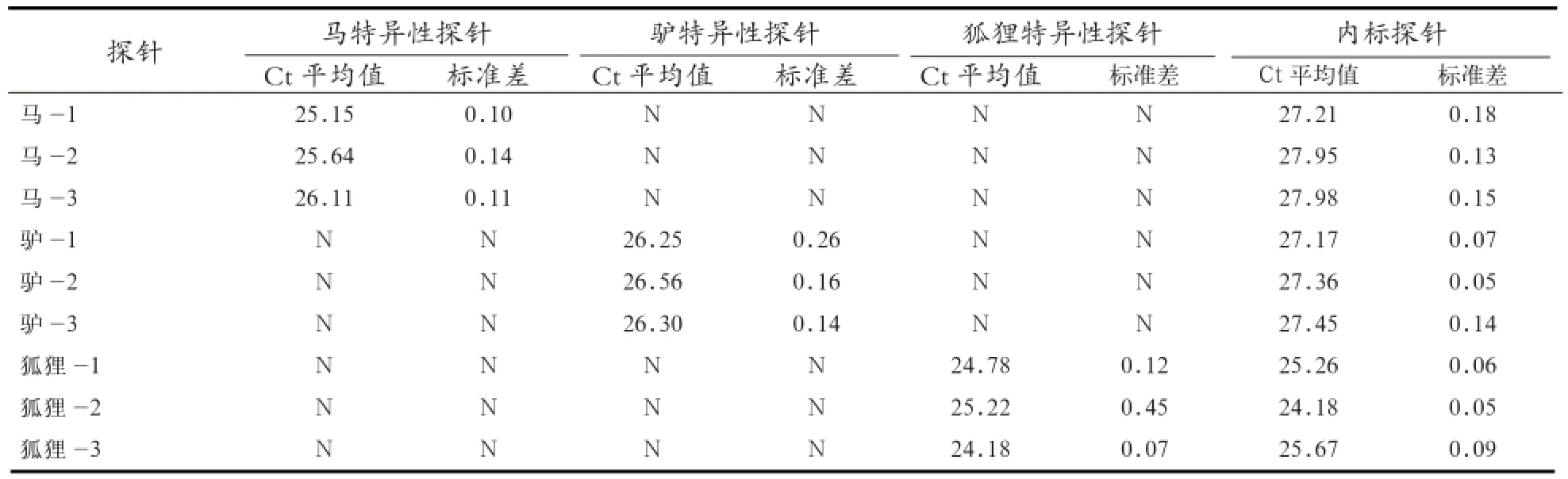
表3 多重实时荧光PCR方法检测重复性实验

表4 市售驴肉类产品检测结果
4 结 论
本研究以驴、马和狐狸的线粒体基因为靶序列,通过添加竞争型扩增内标使其在不影响体系扩增灵敏度的同时,起到有效指示假阴性的效果,从而建立的驴、马和狐狸源性四重荧光实时PCR检测体系能有效鉴别动物产品中驴、马和狐狸的源性成分,与常规PCR相比大大节约时间,操作方便,安全可靠,为其保障相关肉类、饲料、食品等产品掺假的鉴定与控制提供可靠的技术支撑。
[1] 李丽娟, 袁晓龙. 源性成分鉴别检测技术研究进展[J].动物医学进展, 2015, 36(5): 107-110.
[2] 何玮玲, 胡序建, 程欣,等. 含有扩增内标的食品中猪肉和鸡肉成分Taqman探针实时荧光PCR检测方法的建立[J].中国农业科学, 2013, 46(21):4578-4585.
[3] Zulal K, Yetiman A E, Sahin F, et al. Detection of chicken and turkey meat in meat mixtures by using real-time PCR assays[J]. J Food Sci, 2012, 77(2): 167-73.
[4] Zülal K, Ayten G, Mustafa T Y, et al. Taqman based duple -x realTime PCR approach for the detection and quantifca tion of donkey and pork adulterations in raw and heat -processed meats[J]. Ⅰnt J Food Prop, 2013, 1-24.
[5] 张全芳, 马德源, 刘艳艳,等. 利用多重 PCR技术检测羊肉中掺杂狐狸肉的方法研究[J].山东农业科学, 2014, 46(12): 4-6,10.
[6] 岳苑. 实时荧光 PCR 法检测清真食品中马,驴源性成分[J].湖北农业科学, 2014, 53(22): 5518-5522.
[7] You J, Huang L R, Zhuang J L, et al. Species-specific multiplex real-time PCR assay for identifcation of deer and common domestic animals[J]. Food Sci Biotechnol, 2014, 23(1): 133-139.
[8] 刘帅帅, 李宏, 罗世芝,等. PCR 技术在肉类掺假检验中的应用进展[J].食品安全质量检测学报, 2011, 2(6): 280-284.
[9] Kesmen Z, Gulluce A, Sahin F, et al. Ⅰdentifcation of meat species by TaqMan-based real-time PCR assay[J]. Meat Sci, 2009, 82: 444-449.
[10] Köppel R, Ruf J, Zimmerli F, et al. Multiplex real-time PCR for the detection and quantification of DNA from beef, pork, horse and sheep[J]. Eur Food Res Technol, 2011, 232(1): 151-155.
[11] Chisholm J, Conyers C, Booth C, et al. The detection of horse and donkey using real-time PCR[J]. Meat Sci, 2005, 70(4):727-732.
[12] 吴亚君, 王斌, 刘鸣畅,等. 阿胶中马和驴成分的实时荧光PCR检测[J].食品科学, 2014, 35(8): 85-88.
[13] 张娟, 宗卉, 张利. PCR-mtDNA技术鉴别检测不同动物肌肉组织和饲料中鸭源性成分[J].生物工程学报, 2008, 24(10):1832-1836.
S814.5
A
10.19556/j.0258-7033.2017-01-100
2016-07-21;
2016-09-01
山东省农业重大应用技术创新课题(鲁财农指[2014] 38号);山东省科技厅山东省优秀中青年科学家科研奖励基金计划项目 (BS2010SW024 );济南市高校院所自主创新项目(201401264)
卞如如(1992-),山东济宁人,研究实习员,研究方向为动物遗传学,E-mail: brr1992@163.com
*通讯作者:步迅(1964-),上海人,副研究员,研究方向为分子生物学,E-mail:sherry6423@126.com

