两种冷冻方法对牛卵巢组织窦前卵泡活性的影响*
王兴玲,贾 琪,刘艳丽,刘 景,郝大勇,申春艳,赵文杰
郑州大学第三附属医院生殖中心 郑州 450052
两种冷冻方法对牛卵巢组织窦前卵泡活性的影响*
王兴玲△,贾 琪,刘艳丽,刘 景,郝大勇,申春艳,赵文杰
郑州大学第三附属医院生殖中心 郑州 450052
△女,1962年2月生,博士研究生,主任医师,研究方向:生殖医学,E-mail:wangxl208@126.com
程序化冷冻;玻璃化冷冻;窦前卵泡;活性
目的:探讨两种冷冻方法对牛卵巢组织窦前卵泡活性的影响。方法:取新鲜的牛卵巢组织随机分为新鲜对照组、程序化冷冻组和玻璃化冷冻组,分别加入Liberase DH酶消化,然后挑取窦前卵泡并分类计数,用calcein AM以及ethidium homodimer对窦前卵泡进行荧光染色,鉴定窦前卵泡的活性。结果:3组各级卵泡的数量及分布差异无统计学意义(P=0.765);与新鲜对照组(91%)相比,程序化冷冻组和玻璃化冷冻组窦前卵泡中未受损卵泡所占比例(80%和78%)略有降低(P=0.012)。3组中所占比例占优势的始基卵泡中未受损卵泡率差异无统计学意义(P=0.079);与新鲜对照组相比,两冷冻组初级卵泡中未受损卵泡率有所降低(P<0.05),但两冷冻组间差异无统计学意义(P>0.05)。结论:程序化冷冻法和玻璃化冷冻法均能较好地保存卵巢组织窦前卵泡的活性。
目前通过辅助生殖技术保存女性癌症患者生育能力的方法主要有3种,即卵母细胞冷冻、胚胎冷冻和卵巢组织冷冻[1-2]。卵母细胞冷冻和胚胎冷冻往往需要患者通过超促排卵来获取较多的卵母细胞,以提高其冷冻的效率。但超促排卵会引起患者体内雌激素水平升高,可能加重其病情同时延迟癌症的治疗;且对月经尚未来潮的青春期患者进行超促排卵治疗尚存在伦理方面的争议。因此对于青春期前、激素依赖性肿瘤及化疗不能延后的女性癌症患者,卵巢组织冷冻复苏移植是目前惟一可选择的生育能力保存方式[3-4]。然而,有研究[5]表明卵巢组织移植有可能将原肿瘤灶重新植入体内;而窦前卵泡周围有基底膜包围,因此移植窦前卵泡可能是一个更安全的选择[6]。目前冷冻保存卵巢组织的方法有两种:程序化冷冻法和玻璃化冷冻法。其中,程序化冷冻是冷冻卵巢组织的常规方法[7],而玻璃化冷冻能较好地保存卵巢组织内的卵泡以及其分泌功能[8]。Rahimi等[9]研究表明玻璃化冷冻并移植卵巢组织后细胞凋亡率高于程序化冷冻组,然而更多的研究者[10-11]就形态完整的卵泡和凋亡率之间比较并未发现二者之间的区别。该研究通过程序化冷冻法和玻璃化冷冻法冷冻牛卵巢组织,解冻后分离窦前卵泡,用荧光染色评估其活性,并与新鲜对照组比较,以探讨两种冷冻方法对卵巢组织窦前卵泡活性的影响。
1 材料与方法
1.1 实验试剂 二甲基亚砜(Sigma公司),PBS、不含钙镁的PBS(DPBS)(Gibco公司),细胞活性/细胞毒性试剂盒(Molecular Probes公司),Liberase DH(Roche公司),人血清白蛋白(HSA)、取卵-胚胎处理液(G-MOPS)(Vitrolife公司),终止液(DPBS+体积分数10%HSA),冷冻液(0.4 mL HSA+1.0 mL DMSO+8.6 mL G-MOPS),玻璃化冷冻液及解冻液试剂盒(KITAZATO公司)。
1.2 标本收集与处理 牛剖腹后,立即无菌取卵巢,用生理盐水冲洗3遍后放入生理盐水中,于冰盒中、4 h内转运回实验室。
用生理盐水再次冲洗牛卵巢组织2次,除去卵巢周围组织以及血管和髓质,将处理好的卵巢皮质剪成0.5 cm×0.8 cm×0.3 cm的组织块,并随机分为新鲜对照组、程序化冷冻组和玻璃化冷冻组,每组5块。将新鲜对照组的组织块加入Liberase DH酶消化,然后挑出窦前卵泡计数并行荧光染色,将程序化冷冻组和玻璃化冷冻组组织块分别冷冻,14 d后复苏,同法消化和进行荧光染色并分级计数。卵泡分级参照文献[12]:始基卵泡为卵母细胞周围包绕一层扁平的前颗粒细胞;初级卵泡为卵母细胞周围包绕一层立方形的颗粒细胞;次级卵泡为卵母细胞周围包绕两层或两层以上立方形的颗粒细胞;窦状卵泡为卵母细胞周围包绕两层以上的颗粒细胞,卵泡内有窦腔形成。将挑出的窦前卵泡培养于100 μL的DPBS(含2 μL的calcein AM和5 μL的ethidium homodimer)中,在37 ℃黑暗环境中放置45 min,然后在荧光显微镜下观察卵泡的活性并分为4类。未受损卵泡:卵子和颗粒细胞均存活;轻微受损卵泡:死亡颗粒细胞的比例<10%;中度受损卵泡:颗粒细胞有10%~50%受损;死亡卵泡:卵子或是>50%的颗粒细胞死亡。
1.3 统计学处理 采用SPSS 21.0处理数据,计数资料采用χ2检验或Fisher精确概率检验,检验水准α=0.05。
2 结果
2.1 3组窦前卵泡的分布情况 3组共随机挑出窦前卵泡484个,其外观呈圆形或卵圆形,卵泡外膜完整;其中始基卵泡263个(54%),初级卵泡177个(37%),次级卵泡44个(9%),未见窦状卵泡。3组窦前卵泡分布差异无统计学意义。见表1。
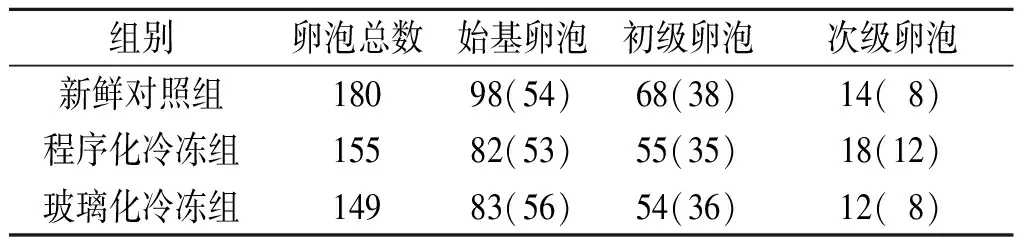
表1 3组窦前卵泡的分类 个(%)
χ2=1.839,P=0.765。
2.2 3组窦前卵泡的活性情况 窦前卵泡的活性分类见图1。新鲜对照组未见中度受损卵泡,程序化冷冻组和玻璃化冷冻组仅见少量中度受损卵泡。与新鲜对照组相比,程序化冷冻组和玻璃化冷冻组未受损卵泡所占比例有所降低,轻微受损卵泡和死亡卵泡所占比例升高,结果见表2。3组未受损卵泡的分类比较见表3。由表3可知,3组中所占比例占优势的始基卵泡中未受损卵泡率差异无统计学意义;与新鲜对照组相比,两冷冻组初级卵泡中未受损卵泡率有所降低,但两冷冻组间比较差异无统计学意义。

V1:未受损卵泡;V2:轻微受损卵泡;V3:中度受损卵泡;V4:死亡卵泡。图1 荧光染色后荧光显微镜下窦前卵泡的活性分类(×400)
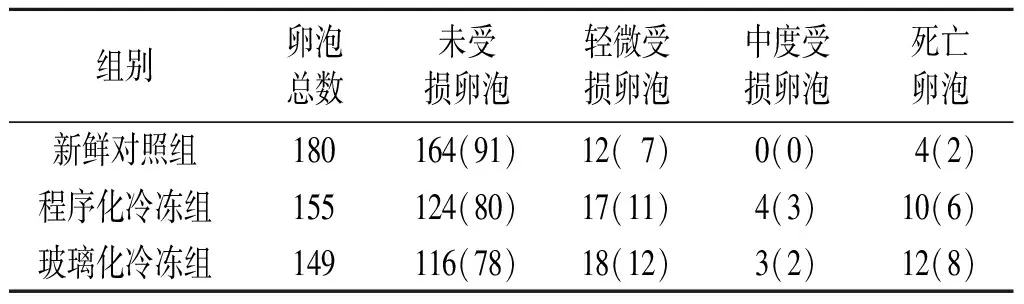
χ2=12.901,P=0.012。

表3 3组窦前卵泡分类中未受损卵泡所占比例的比较 个(%)
*:与新鲜对照组相比,P<0.05;△:次级卵泡在窦前卵泡中所占比例低,未行统计学分析。
3 讨论
卵巢组织的冷冻方法包括程序化冷冻法和玻璃化冷冻法。程序化冷冻法使用低浓度冷冻保护剂,在程序冷冻仪的控制下缓慢降温脱水,避免细胞内冰晶形成。玻璃化冷冻法是近年来新兴的冷冻方法,该方法应用高浓度冷冻保护剂,使其充分渗透到细胞内,提高胞浆黏稠度,并快速降温,使细胞玻璃化,减少甚至避免细胞内外冰晶形成。但目前两种冷冻方法的优劣仍然还有争议。
目前国内研究大多是通过组织学检测评估不同冷冻方法对窦前卵泡形态的影响。该研究通过程序化冷冻法或玻璃化冷冻法冷冻牛卵巢组织后,用酶解法消化卵巢组织,分离出窦前卵泡,用荧光探针calcein AM和ethidium homodimer进行活力染色,从而观察程序化冷冻法和玻璃化冷冻法对窦前卵泡活性的影响。研究结果显示,新鲜对照组、程序化冷冻组和玻璃化冷冻组随机挑出的窦前卵泡的数量和分布差异无统计学意义;荧光染色后可见,新鲜对照组未受损卵泡所占比例稍高于两冷冻组,轻微受损卵泡和死亡卵泡也较两冷冻组少,说明冷冻解冻过程中,卵巢组织受到一定的损伤。由表1知窦前卵泡中始基卵泡所占比例最高,3组均在50%以上。结合表3结果可知,3组始基卵泡中未受损卵泡率差异无统计学意义,说明冷冻对始基卵泡活性的影响较小,这与Fabbri等[13]研究的冷冻对颗粒细胞的影响较大,体积小、代谢率低、颗粒细胞少的始基卵泡冷冻效果较好一致。此外,研究结果还显示,新鲜对照组初级卵泡中未受损卵泡率较两冷冻组高,分析原因为初级卵泡和次级卵泡的体积较始基卵泡大,颗粒细胞多,所以在冷冻时更易发生损伤。由于卵巢皮质内含有大量的始基卵泡,同时始基卵泡比其他卵泡更能耐受冷冻过程,冷冻后存活率高,所以今后对始基卵泡的生长发育进行研究将有广阔的前景。
此外,程序化冷冻组和玻璃化冷冻组始基卵泡和初级卵泡中未受损卵泡率差异均无统计学意义,说明两种冷冻方法均能较好地保存卵巢皮质中窦前卵泡的活性,这与Sanfilippo等[10]研究的两种冷冻方法对卵巢组织内窦前卵泡形态以及凋亡的影响的结果一致。
但是该研究仅限于观察冷冻复苏后窦前卵泡的存活情况,未对窦前卵泡进行体外培养,在今后的研究中,作者拟将窦前卵泡移入由藻酸盐基质凝胶构成的三维培养系统中培养,进一步观察程序化冷冻和玻璃化冷冻对窦前卵泡生长发育的影响,从而进一步地评估两种冷冻方法对窦前卵泡发育潜能的影响。
综上所述,程序化冷冻和玻璃化冷冻卵巢组织后分离出的窦前卵泡的活性虽稍低于新鲜对照组,但均能较好地保存卵巢组织内窦前卵泡的活性。
[1]乔杰,龙晓宇,高江曼,等.人类生育力保护的机遇与挑战[J].中国实用妇科与产科杂志,2016,32(1):8
[2]SALAMA M,WINKLER K,MURACH KF,et al. Female fertility loss and preservation:threats and opportunities[J].Ann Oncol,2013,24(3):598
[3]DEMEESTERE I,SIMON P,DEDEKEN L,et al.Live birth after autograft of ovarian tissue cryopreserved during childhood[J].Hum Reprod,2015,30(9):2107
[4]SALAMA M,WOODRUFF TK.New advances in ovarian autotransplantation to restore fertility in cancer patients[J].Cancer Metastasis Rev,2015,34(4):807
[5]DOLMANS MM,LUYCKX V,DONNEZ J,et al.Risk of transferring malignant cells with transplanted frozen-thawed ovarian tissue[J].Fertil Steril,2013,99(6):1514
[6]LUYCKX V,DOLMANS MM,VANACKER J,et al.A new step toward the artificial ovary: survival and proliferation of isolated murine follicles after autologous transplantation in a fibrin scaffold[J].Fertil Steril,2014,101(4):1149
[7]DONNEZ J,DOLMANS MM,PELLICER A,et al.Restoration of ovarian activity and pregnancy after transplantation of cryopreserved ovarian tissue:a review of 60 cases of reimplantation[J].Fertil Steril,2013,99(6):1503
[8]WANG TR,YAN J,LU CL,et al.Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification[J].Hum Reprod,2016,31(4):763
[9]RAHIMI G,ISACHENKO V,TODOROV P,et al.Apoptosis in human ovarian tissue after conventional freezing or vitrification and xenotransplantation[J].Cryo Letters,2009,30(4):300
[10]SANFILIPPO S, CANIS M, SMITZ J, et al. Vitrification of human ovarian tissue: a practical and relevant alternative to slow freezing[J]. Reprod Biol Endocrinol,2015,13:67
[11]KLOCKE S,BÜNDGEN N,KÖSTER F,et al.Slow-freezing versus vitrification for human ovarian tissue cryopreservation[J].Arch Gynecol Obstet,2015,291(2):419
[12]WANG TR,YAN LY,YAN J,et al.Basic fibroblast growth factor promotes the development of human ovarian early follicles during growth in vitro[J].Hum Reprod,2014,29(3):568
[13]FABBRI R,PASQUINELLI G,BRACONE G,et al.Cryopreservation of human ovarian tissue[J].Cell Tissue Bank,2006,7(2):123
(2016-04-18收稿 责任编辑徐春燕)
Influence of 2 freezing methods on preantral follicular viability of bovine ovarian tissue
WANGXingling,JIAQi,LIUYanli,LIUJing,HAODayong,SHENChunyan,ZHAOWenjie
ReproductiveCenter,theThirdAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
program freezing;vitrification freezing;preantral follicle;viability
Aim: To investigate the influence of 2 freezing methods on the preantral follicular viability of bovine ovarian tissue. Methods: Pieces of fresh bovine ovarian tissue were randomly allocated into fresh control group, program freezing group and vitrification freezing group; ovarian tissue was digested by Liberase DH, then randomly picked preantral follicles and counted.Follicular viability was assessed by double fluorescent labelling with calcein AM and ethidium homodimer staining.Results: There were no significant differences in the number or distribution of preantral follicles among the 3 groups(P=0.765).Compared with the fresh control group(91%), the percentage of undamaged follicles in the preantral follicles was slightly lower in the program freezing group(80%) and vitrification freezing group(78%)(P=0.012). There were no significant differences in the rate of undamaged follicles in primordial follicles which were superior in the number(P=0.079); the rate of undamaged follicles in primary follicles in the 2 freezing groups was slightly lower than that in the fresh control group(P<0.05), but the differences between the 2 freezing groups were not significant(P>0.05) .Conclusion: The 2 freezing methods both can better maintain the viability of preantral follicles.
10.13705/j.issn.1671-6825.2017.01.018
*河南省国际科技合作计划项目 152102410060
R71

