藻蓝蛋白对氧化应激相关疾病防治作用的研究进展
刘 琪, 李文军, 唐志红, 秦 松, 杜振宁
藻蓝蛋白对氧化应激相关疾病防治作用的研究进展
刘 琪1, 李文军2, 唐志红3, 秦 松2, 杜振宁1
(1. 烟台大学 药学院, 山东 烟台 264005; 2. 中国科学院 烟台海岸带研究所, 山东 烟台 264003; 烟台大学 生命科学学院, 山东 烟台 264005)
过去的40年, 氧化应激在多种疾病的发生及恶化进程中的重要作用受到广泛关注。机体受到有害刺激后产生的氧化应激与动脉粥样硬化、肝炎、肺炎、阿尔兹海默病、白内障等多种疾病的发生有关, 减轻氧化应激来防治以上疾病成为一种新思路。藻蓝蛋白作为从藻类中提取的天然产物, 常被用作保健品及食品添加物, 研究发现藻蓝蛋白可通过消除自由基、减轻氧化应激防治多种疾病。本文将藻蓝蛋白对氧化应激相关疾病的治疗或预防作用进行了综述, 对其应用前景进行展望, 为该活性蛋白的应用提供参考。
氧化应激; 藻蓝蛋白; 作用机制
越来越多的研究表明, 氧化应激与多种疾病的发生与发展有关。生活节奏加快、人们压力增加、环境污染严重、居住环境中有害物质增多、接受紫外照射, 及身体的炎症等, 这些与人们日常生活密切关联的因素都可以导致体内产生过多的活性氧, 产生氧化应激诱发疾病。氧化应激(oxidative stress, OS)是指机体在遭受有害刺激后, 体内高活性的物质活性氧自由基(reactive oxygen species, ROS)产生过多, 体内的氧化与抗氧化失去平衡, 并倾向于氧化, 可引起DNA氧化损伤、中性粒细胞炎性浸润、蛋白质异常表达, 从而引发多种疾病[1]。寻找一种可以减轻氧化应激达到防治疾病效果的药品或功能性食品成为亟待解决的问题。藻蓝蛋白(Phycocyanin, PC)是一种多功能的天然产物, 具有抗氧化、抗炎、抗肿瘤等作用[2], 许多研究表明, 藻蓝蛋白可通过减轻氧化应激, 在一定程度上减少疾病的发生, 减缓疾病的恶化进程[3]。相对于很多化学药物, 藻蓝蛋白是一种无毒无害的天然产品[4], 是防治氧化应激相关疾病的一种较好的选择。本文整理了氧化应激可能引起的疾病及藻蓝蛋白对其防治作用及机理, 为藻蓝蛋白作为功能性食品或药品在与氧化应激相关疾病中的合理应用提供了参考。
1 氧化应激与疾病
机体在正常的生理条件时, 细胞正常的氧化还原过程会产生一定量的活性氧, 同时也存在一系列的抗氧化物质来保持氧化系统和抗氧化系统的平衡, 机体的抗氧化酶和抗氧化物质包括酶性抗氧化物, 如能消除生物体在新陈代谢过程中产生的有害物质的超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶、谷胱甘肽还原酶及谷胱甘肽过氧化物酶; 非酶抗氧化剂如过度金属蛋白、泛醌还原物及维生素等, 都可清除ROS,从而达到机体氧化系统与抗氧化系统的平衡。氧化应激则是机体的氧化和抗氧化能力失衡, 使得机体组织或细胞内的氧自由基增多或因清除能力降低而导致ROS在组织内或细胞内大量蓄积, ROS的过量累积会引起一系列的氧化损伤导致多种疾病发生(图1)。机体发生氧化应激后, 会产生多种毒性代谢产物, 如脂质发生过氧化反应的终产物丙二醛(MDA)是一种毒性终产物, 可以引起生命大分子如蛋白质、核酸等发生交联聚合从而产生细胞毒性, 其含量直接反映体内脂质过氧化的强度和速率, 间接反映了机体清除自由基的能力。
大量研究表明, 在肿瘤、心脑血管疾病、Ⅱ型糖尿病、白内障、老年痴呆等大量疾病的发病过程有明显的ROS反应增强, 同时氧化应激损伤指标(如血清中MDA)水平显著升高[5], 因此, 使用高活性、多功能抗氧化剂, 清除ROS、减轻氧化应激反应成为治疗多种疾病的新思路[1]。

图1 氧化应激与多种疾病的关系
2 藻蓝蛋白概述及减轻氧化应激反应的关系
藻蓝蛋白是一种捕光色素蛋白——广泛存在于蓝藻和红藻中, 能高效的捕获光能。螺旋藻藻蓝蛋白通常由两个亚基组成, 亚基的分子质量均在15 kD左右。藻蓝蛋白发色团的四吡咯结构类似于动物红细胞血红素结构, 肽链上共价结合一个开链的四吡咯环辅基, 开链的四吡咯化合物和脱辅蛋白通过硫键结合。螺旋藻藻蓝蛋白水溶性强, 在溶液中呈蓝色, 在620 nm处有特殊吸收峰, 可以用620280表示其纯度[6]。藻蓝蛋白除有抗氧化、抗炎、抗肿瘤等特性, 宋璐非等[7]对天然藻蓝蛋白对大鼠的长期毒性进行试验, 实验结果证明, 藻蓝蛋白无毒性。王雪青等[4]实验证明, 藻蓝蛋白酶解肽对正常细胞无毒性。
1998年Romay等[8]第一次对藻蓝蛋白在体内外作为抗氧化剂的潜力做了较为全面的评价, 通过实验发现藻蓝蛋白能够有效的清除羟自由基和烷氧自由基。1999年Romay等[9]报道, 藻蓝蛋白可作用于吞噬细胞呼吸爆发时, 通过减少自由基(·OH, H2O2, RO·)和过多的过氧化物抑制鲁米诺在碱性条件下的氧化发光反应。随后对于藻蓝蛋白生理活性近20年的研究中, 也多围绕其抗氧化活性进行研究, 藻蓝蛋白可清除体内过多ROS, 增加抗氧化相关酶活性等特性[10], 这些机制均与氧化应激导致机体氧化系统与抗氧化系统失衡有关, 所以, 藻蓝蛋白有治疗由氧化应激引起的多种疾病的潜能(图2)。
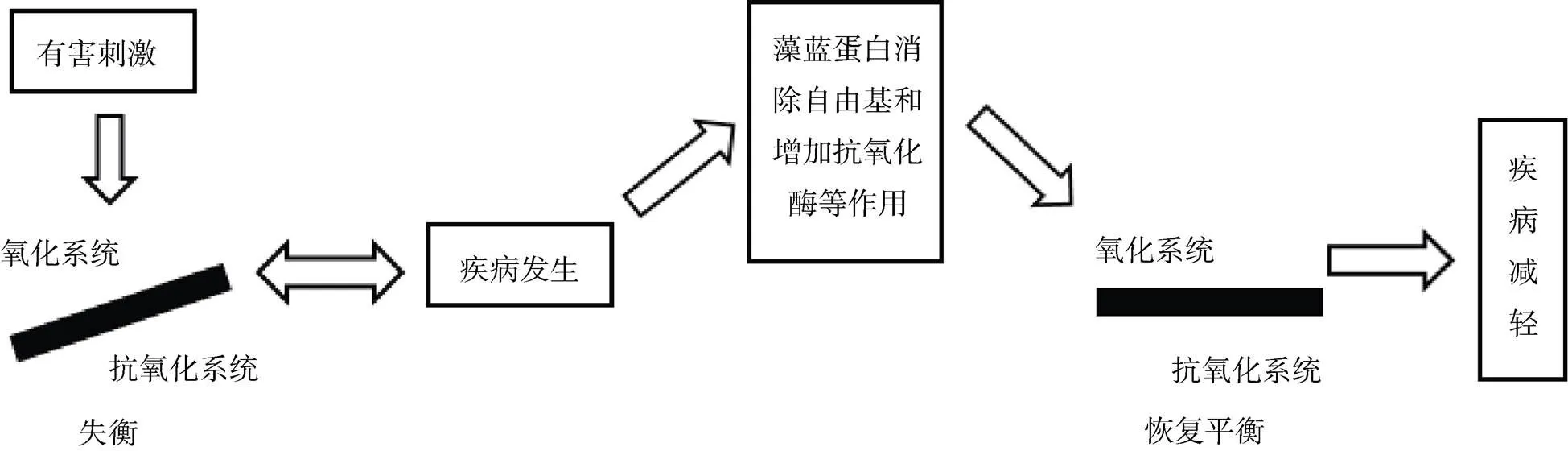
图2 藻蓝蛋白减轻氧化应激相关疾病
3 藻蓝蛋白对氧化应激相关疾病的作用研究
3.1 藻蓝蛋白对氧化应激引起的动脉粥样硬化的作用及机制
氧化应激参与的动脉粥样硬化(Atherosclerosis, As)的发生、发展是一个复杂的过程, 作为动脉粥样硬化的病因之一, ROS与其他致病因素通过协同作用, 造成血管的微损伤, 同时也对血管壁细胞有毒性作用, 经测定表明, 当模型动物或患者的血液中自由基和脂质过氧化产物增加时, 血液中的LDL等容易被ROS攻击和修饰, 而修饰后的成分有更强的致动脉硬化作用, 研究者在患者和模型动物的血液和病灶处检测到修饰后的成分, 证明ROS可能是导致动脉粥样硬化的原因之一[11]。
与动脉粥样硬化相关的ROS有多种来源, 如尼克酰胺腺嘌呤二核苷酸氧化酶、内皮型一氧化氮合成酶、黄嘌呤氧化酶、髓过氧化物酶, 其中血管内生成ROS的主要酶体是尼克酰胺腺嘌呤二核苷酸氧化酶[12]。藻蓝蛋白可以通过减弱氧化应激对动脉粥样硬化有一定的治疗作用, 据Riss等[13]报道, 口服螺旋藻藻蓝蛋白可通过提高体内抗氧化酶的水平、抑制活性氧自由基, 从而增加血浆的抗氧化能力, 同时也降低了尼克酰胺腺嘌呤二核苷酸氧化酶的表达, 减少了ROS的产生, 减轻了由氧化应激引起的动脉粥样硬化。血红素加氧酶-1可以分解代谢血红素, 产生强效抗氧化胆红素, Strasky等[14]实验发现, 小鼠口服藻蓝蛋白可以激活血红素加氧酶-1, 增加载脂蛋白E基因缺失小鼠动脉粥样硬化病变中血红素加氧酶-1的表达, 减轻病变, 同时藻蓝蛋白也可以调节氧化应激和内皮细胞功能紊乱的标记蛋白, 如内皮型一氧化氮合酶和尼克酰胺腺嘌呤二核苷酸氧化酶等, 为藻蓝蛋白减轻动脉粥样硬化病变提供了新思路。
3.2 藻蓝蛋白对氧化应激引起的肝病的作用及机制
氧化应激可导致膜脂质过氧化从而改变生物膜活性, 破坏酶活性, 并在细胞因子TNF-α和NF-κB等共同作用下, 对肝脏造成损伤。所以, 氧化应激在脂肪肝、病毒性肝炎、肝纤维化等肝脏疾病的发病和发展机制中起到不可忽视的作用[15]。目前, 对于脂肪肝复杂的发病机制中, 得到普遍接受的理论是Day等[16]提出的二次打击学说: 第一次打击是由胰岛素抵抗和脂肪代谢失衡引起的肝细胞中脂肪的堆积; 第二次打击是环境应激物和代谢应激物损伤肝细胞线粒体产生氧化应激, 并在多种细胞因子的作用下引起脂肪性肝炎, 并可能引发进一步的脂肪性肝纤维化和脂肪性肝硬化。虽然肝病的发病机制比较复杂, 并未完全解释清楚, 但氧化应激在其中起到重要作用, 研究证明, 过多的ROS可以破坏肝内的氧化系统, ROS能启动生长转化因子β(tansforming growth factorβ、TGFβ)、NK-κB、白细胞介素-8(interleukin-8, IL-8), ROS的增加也会引起细胞内ATP衰竭, 线粒体氧化容量受损, 这将影响乙醛的氧化, 使乙醛在肝脏内不断累积, 对肝脏造成损伤[14]。所以, 氧化应激与多种肝病息息相关, 减轻氧化应激, 可以减轻肝损伤。
Pak等[17]对口服藻蓝蛋白减轻大鼠非酒精性脂肪肝的研究结果表明, 藻蓝蛋白可以发挥抗氧化、抗炎的共同作用有效阻止非酒精性脂肪肝的发病进程。非酒精性脂肪肝模型组的大鼠肝线粒体产生的ROS、炎症因子等明显增高, 而藻蓝蛋白治疗组的ROS等较空白对照组并无明显变化, 这表明, 藻蓝蛋白可通过减轻氧化应激和炎症来抑制非酒精性脂肪性肝病的发展进程。Xia等[18]对藻蓝蛋白对酒精性脂肪肝的保护作用研究结果表明, 给小鼠灌胃藻蓝蛋白可以抑制血清中丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(asparate ainotransferase, AST)活性, 降低甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, CHOL)、低密度脂蛋白(low-density lipoprotein, LDL), 并可增加肝脏中SOD, 减少丙二醛(malondialdehyde, MDA), 从而减轻氧化应激。Ou等[19]经过体内及体外实验证明, 藻蓝蛋白(灌胃)也可通过清除ROS, 增强SOD和谷胱甘肽过氧化物酶(GSH-Px)的活性来减轻CCl4造成的肝损伤。
3.3 藻蓝蛋白对氧化应激引起的白内障的作用及机制
白内障(Cataract)是最常见的眼部疾病之一, 患者由于晶状体蛋白质变性浑浊, 导致视物模糊视力下降, 严重的可能导致失明[20]。白内障的发病机制复杂, 与高龄、家族遗传、理化损伤及免疫炎症反应等密切相关[21], 其中, 白内障患者氧化指标的变化引起学者注意, 患者局部的氧化和抗氧化系统的失衡产生氧化应激反应, 可能是晶状体蛋白质变性导致白内障的原因之一, 所以减轻氧化应激水平也是治疗白内障的一种有效途径[22]。
藻蓝蛋白作为一种抗氧化物质也对白内障起到了一定的改善作用, Kothadia等[23]发现藻蓝蛋白可以通过增加GSH的表达、消除自由基来减轻半乳糖引起的白内障。Kumari等[24]用亚硒酸钠诱导大鼠发生白内障, 随后对大鼠口服藻蓝蛋白进行治疗, 研究结果表明, 藻蓝蛋白可以调节抗氧化酶表达, 增加抗氧化酶活性, 减少氧化应激反应, 降低了亚硒酸钠诱导的白内障恶化程度。
3.4 藻蓝蛋白对氧化应激引起的神经疾病的作用及机制
发生氧化应激时, 过多的ROS使神经元细胞膜发生脂质过氧化反应, 同时增加细胞膜的通透性, 神经元细胞发生毒性水肿的可能性增加, 对神经元产生损伤[25]。研究表明, 在衰老、帕金森、抑郁动物模型中, 氧化应激指标SOD含量下降、MDA含量上升, 动物体内氧化应激加剧, 这说明, 氧化应激可能是三种疾病的共同基础。另外, 也有研究表明氧化应激在脑缺血再灌注损伤、阿兹海默病[26]及癫痫等神经系统疾病中扮演重要角色[27-28]。所以, 对神经疾病患者进行抗氧化干预治疗也可达到比较好的治疗效果。
Min等[29]实验表明, 通过鼻腔给予小鼠藻蓝蛋白可以保护受到氧化损伤的大脑。Rimbau等[30]研究表明, 口服藻蓝蛋白可以通过消除自由基减轻癫痫症状。红藻氨酸可产生大量活性氧自由基, 导致大鼠癫痫, Rimbau等[30]用红藻氨酸致大鼠癫痫, 并用藻蓝蛋白进行干预, 发现藻蓝蛋白可以消除自由基, 保护神经元, 减轻癫痫。Bermejo-Bescós等[31]报道藻蓝蛋白可以保护处于氧化应激状态下的SH-SY5Y神经细胞, 铁可以导致SH-SY5Y神经细胞发生氧化应激反应, 而藻蓝蛋白的加入可以激活抗氧化相关酶, 如SOD、CAT、GSH-Px等减轻氧化应激反应, 从而保护SH-SY5Y细胞。Bermejo-Bescós的实验结果也预示着, 藻蓝蛋白可能对由自由基引起的神经损伤起到保护作用, 在阿尔兹海默病和帕金森病中起到良好作用。
3.5 藻蓝蛋白对氧化应激引起的肾脏疾病的作用及机制
氧化应激也可引发肾脏疾病的发生, ROS的增多, 氧化应激水平提高, 可以使肾小球通透性增加, 使得血浆蛋白更易沉淀于基底膜, 使肾脏血管硬化; 另外, ROS也可在细胞外基质沉积, 导致系膜区扩张, 对肾脏造成损伤。糖尿病肾病是糖尿病的并发症之一, 氧化应激反应也在糖尿病肾病中起到了一定的作用, 在高血糖环境下, 高血糖可抑制肾脏中抗氧化酶(SOD、CAT、GSH-Px)的表达, 导致肾脏组织中氧化应激水平提高, ROS积累过多, 对肾脏造成损伤[32]。
Zheng等[33]实验结果表明, Ⅱ型糖尿病小鼠口服10周藻蓝蛋白后肾脏中NADPH氧化酶(氧化应激标记物)表达降低, 同时减少蛋白尿和减轻肾系膜扩张的情况, 这说明藻蓝蛋白可以通过减轻氧化应激反应预防糖尿病肾病的发生。Shukkur[34]实验结果表明, 藻蓝蛋白对线粒体通透性有保护作用, 在犬肾细胞中, 藻蓝蛋白降低草酸诱导的活性氧(ROS)和脂质过氧化(LPO)反应, 从而预防因草酸引发细胞内氧化应激反应而造成的细胞损伤。
3.6 藻蓝蛋白对氧化应激引起的肺部疾病的作用及机制
引起肺部疾病的氧化应激反应主要有两个因素, 一是外源性因素, 如烟雾、环境污染物、化学物质等, 他们自身含有大量自由基, 可直接刺激呼吸道及肺, 引起细胞及器官损伤; 另一个因素为内源性因素, 主要是肺微循环中的中性粒细胞被激活, 释放大量ROS, 造成细胞和组织损伤, ROS还可以上调或者激活NK-κB, 加重炎症反应, 并同TNF-α、ET-1等因子直接刺激成纤维细胞的增殖, 严重者造成肺纤维化[35]。据Sun等[36-37]文献报道腹腔注射藻蓝蛋白可以通过提高肺组织和血浆中的超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)降低组织中羟脯氨酸(HYP)和丙二醛(MDA), 来减轻百草枯造成的大鼠肺损伤, 病理切片及免疫组化结果显示, 藻蓝蛋白可以通过降低氧化反应水平减缓百草枯诱导的肺纤维化进展[37]。另外, 周定耕等[38]给模型小鼠腹腔注射藻蓝蛋白, 发现藻蓝蛋白对脓毒性肺损伤有保护作用, 脓毒急性肺损伤模型大鼠的肺组织中的过氧化物明显增高, 而藻蓝蛋白可以明显减少过氧化物的量, 促进蛋白激酶B(Akt)磷酸化, 诱导转录因子E2相关因子2(Nrf2)并上调血红素氧合酶(HO-1), 而HO-1可以通过多种途径降低肺组织中超氧化物的含量, 发挥对脓毒症急性肺损伤的大鼠的保护作用。
3.7 藻蓝蛋白对辐射引起的氧化应激损伤的作用及机制
藻蓝蛋白除与上述氧化应激相关疾病有关外, 也可能运用到辐射保护方面, 当细胞或者组织受到射线辐照时, 细胞或组织因产生大量自由基而发生氧化应激现象, 对细胞或组织造成损伤[39-40], Zhang等[41]发现可通过调节氧化应激水平减少辐射造成的肺损伤。张成武等[42]在小鼠接受致死量60Coγ射线照射前5天连续给小鼠腹腔注射藻蓝蛋白, 实验发现, 与单纯辐射组相比, 藻蓝蛋白干预组的小鼠30 d的存活率显著提高, 并能促进辐射后小鼠造血功能的恢复。Ivanova等[43]通过体外实验发现, 相对于只受辐照的淋巴细胞, 辐照并且用藻蓝蛋白孵育过的细胞过氧化物歧化酶(SOD)、过氧化氢酶和谷氨酸转移酶均上升, 这表明, 藻蓝蛋白通过降低由于辐射造成的氧化应激, 来控制细胞早期的辐射反应。现在有许多研究证明, 通过调节减轻氧化应激反应可以减轻放射造成的组织损伤, 目前对于藻蓝蛋白对辐照后组织损伤保护及保护机制的研究还较少, 本课题组也正在此方面进行研究。
4 总结与展望
综上所述, 氧化应激与多种疾病有关, 可能是心血管系统、消化系统、呼吸系统、神经系统等疾病的共同发病机制[44], 而藻蓝蛋白可以作为一种抗氧化剂调节体内抗氧化系统与氧化系统的失衡, 下调氧化应激水平, 达到治疗疾病的效果。另外, 本课题组也对重组藻蓝蛋白的抗氧化活性进行研究, 研究表明, 不同的重组蛋白对不同类型的自由基清除能力不同[45], 而重组藻蓝蛋白在氧化应激相关性疾病的应用研究偏少, 相对于天然藻蓝蛋白, 科研工作者赋予重组藻蓝蛋白更多的特性(如稳定性更高), 重组藻蓝蛋白在疾病中运用值得进一步研究。
现今对藻蓝蛋白的药理作用研究较多, 但是对其药代动力学的研究较少, 藻蓝蛋白通过不同方式给药后如何在体内分布及代谢途径等都有待研究。另外, 藻蓝蛋白作为大分子物质, 通过灌胃方式给药, 进入体内后可能会被不同的消化酶水解, 究竟藻蓝蛋白的多种药理学作用是蛋白本身还是分解后产物起效也将是未来藻蓝蛋白研究的一个新方向。随着分离纯化的技术日渐成熟[46], 纯度更高的藻蓝蛋白已经运用到保健品或候选药物的研究中, 同时, 藻蓝蛋白具有无毒多功能的特点, 其应用前景将十分广阔。
[1] Spector A. Review: Oxidative stress and disease[J]. Journal of Ocular Pharmacology and Therapeutics, 2000, 16(2): 193-201.
[2] 王庭健, 林凡, 赵方庆, 等. 藻胆蛋白及其在医学中的应用[J]. 植物生理学通讯, 2006, 42(2): 303-307. Wang Tingjian, Lin Fan, Zhao Fangqing, et al. Phycobiliprotein and its application in medicine plant[J]. Physiology Communications, 2006, 42(2): 303-307.
[3] 夏冬, 孙军燕, 刘娜娜, 等. 藻蓝蛋白抗氧化作用及其药理活性研究进展[J]. 海洋科学, 2015, 39(7): 130- 135. Xia Dong, Sun Junyan, Liu Nana. Research progress of the antioxidant activity of Phycocyanin and its application[J]. Marine Sciences, 2015, 39(7): 130-135.
[4] 王雪青, 邓伟, 杨进芳, 等. 藻蓝蛋白酶解肽的分离纯化及其细胞毒活性[J]. 食品科学, 2012, 33(1): 136- 140. Wang Xueqing, Deng Wei, Yang Jingfang, et al. Purification and cytotoxicity of C-Phycocyanin(C-PC) fromplatensis and its tryptic peptides[J]. Food Science, 2012, 33(1): 136-140.
[5] Hybertson B M, GAO B, BOSE S K, et al. Oxidative stress in health and disease: The therapeutic potential of Nrf2 activation[J]. Molecular Aspects of Medicine, 2011, 32(4-6): 234-246.
[6] 陈志桃, 王立兴, 林维钦, 等. 螺旋藻藻蓝蛋白的研究进展[J]. 海峡药学, 2003, 15(6): 1-5.Chen Zhitao, Wanglixing, Lin Weiqing, et al. Advances of studies on the phycocyanininstrait[J]. Pharmaceutical Journal, 2003, 15(6): 1-5.
[7] 宋璐非, 刘冰, 赵勇, 等. 天然藻蓝蛋白对SD大鼠的长期毒性研究[J]. 中国医药导报, 2012, 9(33): 15- 17, 21. Song Lufei, Liubing, Zhao Yong, et al. Chronic toxicity study of Phycocyanin on Sprague Dawley rats[J]. China Medical Herald, 2012, 9(33): 15-17, 21.
[8] Romay C, Armesto J, Remirez D, et al. Antioxidant and anti-inflammatory properties of C-phycocyanin from blue-green algae[J]. Inflammation Research, 1998, 47(1): 36-41.
[9] Romay C. Phycocyanin extract reduces leukotriene B4 levels in arachidonic acid-induced mouse-ear inflammation test[J]. Journal of Pharmacy and Pharmacology, 1999, 51(5): 642-642.
[10] Wu Q, Liu L, Miron A, et al. The antioxidant, immunomodulatory, and anti-inflammatory activities of: an overview[J]. Archives of Toxicology, 2016, 90(8): 1817-1840.
[11] Vogiatzi G, Tousoulis D, Stefanadis C. The role of oxidative stress in atherosclerosis[J]. Hellenic Journal of Cardiology , 2009, 50(5): 402-409.
[12] 王全伟, 凡文博, 王智昊, 等. 氧化应激与心血管疾病关系的研究进展[J]. 中国老年学杂志, 2014(1): 270- 273. Wang Quanwei, Fan Wenbo, Wang Zhihao, et al. Research progress on the relationship between oxidative stress and cardiovascular disease[J]. Chinese Journal of Gerontology, 2014(1): 270-273.
[13] Riss J, Decorde K, Sutra T, et al. Phycobiliprotein C-phycocyanin fromplatensis is powerfully responsible for reducing oxidative stress and NADPH oxidase expression induced by an atherogenic diet in hamsters[J]. Journal of Agricultural and Food Chemistry, 2007, 55(19): 7962-7967.
[14] Strasky Z, Zemankova L, Nemeckova I, et al.platensis and phycocyanobilin activate atheroprotective heme oxygenase-1: a possible implication for atherogenesis[J]. Food and Function, 2013, 4(11): 1586-1594.
[15] Zhu R, Wang Y, Zhang L, et al. Oxidative stress and liver disease[J]. Hepatology Research, 2012, 42(8): 741- 749.
[16] Day C P, James O. Steatohepatitis: A tale of two “hits”? [J]. Gastroenterology, 1998, 114(4): 842-845.
[17] Pak W, Takayama F, Mine M, et al. Anti-oxidativeandanti-inflammatory effects of spirulina on rat model ofnon-alcoholic steatohepatitis[J].Journal of Clinical Biochemistry and Nutrition, 2012, 51(3): 227-234.
[18] Xia D, Liu B, Luan X, et al. Protective effects of C-phycocyanin on alcohol-induced acute liver injury in mice[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(2): 399-404.
[19] Ou Y, Zheng S, Lin L, et al. Protective effect of C-phycocyanin against carbon tetrachloride-induced hepatocyte damage in vitro and in vivo[J]. Chemico-Biological Interactions, 2010, 185(2): 94-100.
[20] Alfawaz A, Alrashidi S, Kalantan H, et al. Cataract surgery under systemic infliximab therapy in patients with refractory uveitis associated with Behcet disease[J]. Annals of Saudi Medicine, 2014, 34(4): 328-333.
[21] Miric D J, Kisic B M, Zoric L D, et al. Influence of cataract maturity on aqueous humor lipid peroxidation markers and antioxidant enzymes[J]. Eye, 2014, 28(1): 72-77.
[22] Kaur J. The oxidative stress in cataract patients[J]. Journal of Clinical and Diagnostic Research, 2012, 6(10): 1629-1632.
[23] Kothadia A D, Shenoy A M, Shabaraya A R, et al. Evaluation of cataract preventive action of phycocyanin[J]. International Journal of Pharmaceutical Science & Drug Research, 2011, 3(1): 42-44.
[24] Kumari R P, Sivakumar J, Thankappan B, et al. C-Phycocyanin modulates selenite-induced cataractogenesis in rats[J]. Biological Trace Element Research, 2013, 151(1): 59-67.
[25] Buonocore G, Perrone S.Free radicals and brain damage in the newborn[J]. Biology of the Neonate, 2001, 79(3-4): 455-458.
[26] Benchekroun M, Romero A, Egea J, et al. The antioxidant additive approach for alzheimer’s disease therapy: new ferulic (lipoic) acid plus melatonin modified tacrines as cholinesterases inhibitors, direct antioxidants and nuclear factor (erythroid-derived 2)-like 2 activators[J]. Journal of Medicinal Chemistry, 2016, 59(21): 9967-9973.
[27] Carmonaaparicio L, Zavalatecuapetla C, et al. Status epilepticus: Using antioxidant agents as alternative therapies[J].Experimental & Therapeutic Medicine, 2016, 12(4): 1957-1962.
[28] Cui J, Chen X, Zhai X, et al. Inhalation of water electrolysis-derived hydrogen ameliorates cerebral ischemia–reperfusion injury in rats – A possible new hydrogen resource for clinical use[J]. Neuroscience, 2016, 335: 232-241.
[29] Min S K, Park J S, Luo L, et al.Assessment of C-phycocyanin effect on astrocytes-mediated neuroprotection against oxidative brain injury using 2D and 3D astrocyte tissue model [J].Scientific Reports, 2015, 5: 1-11.
[30] Rimbau V, Camins A, Romay C, et al. Protective effects of C-phycocyanin against kainic acid-induced neuronal damage in rat hippocampus[J].Neuroscience Letters, 1999, 276(2): 75-78.
[31] Bermejo-Bescós P, Piñero-Estrada E, Villar delFresnoÁ M. Neuroprotection byplatensis protean extract and phycocyanin against iron-induced toxicity in SH-SY5Y neuroblastoma cells[J]. Toxicology in Vitro, 2008, 22(6): 1496-1502.
[32] 刘华, 齐磊, 白洁. 糖、脂代谢及氧化应激与糖尿病肾病的相关性[J]. 生命的化学, 2011, 31(1): 78-81. Liu Hua, Qi Lei, Bai Jie. Correlation between glucose, lipid metabolism and oxidative stress in diabetic nephropathy[J]. Chemistry of Life. 2011, 31(1): 78-81.
[33] Zheng J, Inoguchi T, Sasaki S, et al. Phycocyanin and phycocyanobilin fromplatensis protect against diabetic nephropathy by inhibiting oxidative stress[J].American Journal of Physiology Regulatory Integrative and Comparative Physiology, 2013, 304(2): 110-120.
[34] Farooq S M, Boppana N B, Devarajan A, et alC-phycocyanin confers protection against oxalate- mediated oxidative stress and mitochondrial dysfunctions in MDCK Cells [J]. Plos One, 2014, 9(4): 1-9.
[35] Villegas L. Oxidative stress and therapeutic developmentin lung diseases [J]. Journal of Pulmonary & Respiratory Medicine, 2014, 4(4): 1-21.
[36] Sun Y, Zhang J, Yan Y, et al. The protective effect of C-phycocyanin on paraquat-induced acute lung injury in rats [J]. Environmental toxicology and pharmacology, 2011, 32(2): 168-174.
[37] Sun Y, Zhang J, Yu G, et al. Experimental study on the therapeutic effect of C-phycocyanin against pulmonary fibrosis induced by paraquat in rats [J]. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2012, 30(9): 650-655.
[38] 周定耕, 詹向阳, 张永虎, 等. 藻蓝素对脓毒性急性肺损伤大鼠血红素氧合酶-1表达的影响及分子机制[J]. 中南医学科学杂志, 2014, 42(2): 125-128. Zhou Dinggeng, Zhan Xiangyang, Zhang Yonghu, et al. Effect of C-phycocyaninon heme oxygenase-1 expressionand its molecular mechanismin acute lung injury septic rats[J]. Medical Science Journal of Central South China, 2014, 42(2): 125-128.
[39] Selzer E, Hebar A. Basic principles of molecular effects of irradiation[J]. Wiener Medizinische Wochenschrift, 2012, 162(3-4): 47-54.
[40] Kim J H, Jenrow K A, Brown S L. Mechanisms of radiation-induced normal tissue toxicity and implications for future clinical trials[J]. Radiation Oncology Journal, 2014, 32(3): 279-286.
[41] Zhang Y, Zhang X, Rabbani Z N, et al. Oxidative stress mediates radiation lung injury by inducing apoptosis[J]. International Journal of Radiation Oncology Biology Physics, 2012, 83(2): 740-748.
[42] 张成武, 曾昭琪, 张媛贞, 等. 钝顶螺旋藻多糖和藻蓝蛋白对小鼠急性放射病的防护作用[J]. 营养学报, 1996, 18(3): 327-331.Zhang Chengwu, Zheng shaoqi, Zhang Yuanzhen, et al.The protective effects of polysaccharide and C-phycocyanin fromplatensis on acute radiation injury in mice[J]. Acta Nutrimenta Scienca, 1996, 18(3): 327-331.
[43] Ivanova K G, Stankova K G, Nikolov V N, et al. The biliprotein C-phycocyanin modulates the early radiation response: A pilot study [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2010, 695(1-2): 40-45.
[44] 杨玲, 许速. 氧化应激与疾病发生的相关性[J]. 西南国防医药, 2012, 22(11): 1268-1270. Yang Ling, Xu Su. Correlation between oxidative stress and disease[J]. Medical Journal of National Defending Forces in Southwest China, 2012, 22(11): 1268-1270.
[45] 韩璐, 葛保胜, 林秀坤, 等. 几种重组别藻蓝蛋白的抗氧化活性[J]. 海洋科学, 2007, 31(8): 71-75. Han Lu, Ge Baosheng, Lin Xiukun, et alAntioxidant activity of several recombinant phycocyanin[J]. Marine Sciences , 2007, 31(8): 71-75.
[46] 赵静, 祁岩, 王月华, 等. 藻蓝蛋白分离纯化技术及其影响因素分析[J]. 食品与发酵工业, 2014, 40 (10): 168-174. Zhao Jing, Qi Yan, Wang Yuehua, et al.Isolation and purification of phycocyanin and analysis of its influencing factors[J]. Food and Fermentation Industries, 2014, 40(10): 168-174.
(本文编辑: 康亦兼)
Research advances in the preventative and therapeutic effects of phycocyanin on oxidative stress-related diseases
LIU Qi1, LI Wen-jun2, TANG Zhi-hong3, QIN Song2, DU Zhen-ning1
(1. College of Pharmacy, Yantai University, Yantai 264005, China; 2. Yantai Institute of Coastal Zone Research Chinese Academy of Sciences, Yantai 264003, China; 3. College of life science, Yantai University, Yantai 264005, China)
Oxidative stress, which has attracted extensive research attention for over forty years, plays a crucial role in the occurrence and deterioration of various diseases. The oxidative stress resulting from harmful stimulation is related to many diseases, e.g., atherosclerosis, hepatitis, pneumonia, Alzheimer’s disease, and cataracts. In this study, oxidative stress alleviation is presented in a new form to realize the prophylaxis and therapy of the above diseases. Phycocyanin, a natural product extracted from algae, is often used in health products and food additives. Research has found that phycocyanin has a beneficial effect in preventive treatments in different ways, such as the elimination of free radicals and reduction of oxidative stress. Here, we review the important role of phycocyanin in the prevention and cure of oxidative stress-related diseases and discuss the prospects for its application, which provide a reference for phycocyanin use in the future.
oxidative stress; phycocyanin; mechanism
Mar. 7, 2017
R963
A
1000-3096(2017)10-0132-07
10.11759/hykx20170307001
2017-03-07;
2017-05-18
海洋公益性行业科研专项经费资助(201205027)
[National Special Research Fund for Non-Profit Marine Sector]
刘琪(1991-), 女, 山东烟台人, 硕士研究生, 研究方向主要从事药学研究, 电话: 0535-2109089, E-mail: liuqi_panda@163.com; 杜振宁(1960-), 男, 通信作者, 教授, 博士, 研究方向为微生物与生化药学研究, 电话: 0535-2109089, E-mail: zhenning.du@163.com

