GC-MS联合二维核磁对文蛤多糖Fr.2A组分结构的解析
何永峰, 钱建瑛, 李 恒, 陆震鸣, 许正宏, 史劲松
GC-MS联合二维核磁对文蛤多糖Fr.2A组分结构的解析
何永峰, 钱建瑛, 李 恒, 陆震鸣, 许正宏, 史劲松
(糖化学与生物技术教育部重点实验室, 江南大学 药学院, 江苏 无锡 214122)
采用GC-MS联合二维核磁的方法, 对文蛤均多糖结构进行解析。运用双酶辅助水提的方法, 提取文蛤粗多糖(MMPX), 分离纯化得到文蛤均多糖, 并通过气质联用技术(GC-MS)和核磁共振波谱(1D, 2D NMR), 对文蛤均多糖的结构进行了分析。结果表明, 从文蛤中提取得到文蛤粗多糖(MMPX), 经分离纯化得到高纯度文蛤均多糖Fr.2A, 其单糖组成为葡萄糖(Glc)。GC-MS分析发现, Fr.2A存在三种残基单元1, 4-Glc、T-Glc和1, 4, 6-Glc, 摩尔比为5.58︰1.26︰1.0; 核磁共振波谱分析表明, Fr.2A是以-(1→4)与少量-(1→6)连接为主链, 并存在少量的-(1→6)和-(1→4)支链的新型水溶性D型吡喃葡聚糖。
GC-MS; 核磁共振; 多糖; 结构解析
多糖参与多种生物生理活动, 如细胞间的识别及信息传递、生物体的生长发育和机体能量代谢等。现代研究已证明, 多糖具有多种生物活性, 如降血糖、抗凝血、抗肿瘤及免疫调节功能等[1-4], 在医药开发领域具有广泛的应用前景。多糖的功能与其结构密切相关, 多样性和特异性的结构是其生物功能的基础[5-7]。通过对多糖结构的分析, 能够找到其生物功能的依据, 也是深入了解多糖作用机制的前提。由于多糖在糖基组成、连接方式、构型和支化度上具有多样性[8], 采用经典方法解析结构复杂的多糖仍具有较高难度[9]。随着核磁共振技术的不断发展, 尤其是高分辨率核磁图谱及二维核磁分析方法的普遍应用, 为多糖结构的精细解析提供了强有力的技术支持[10]。
文蛤(L.)是我国沿海潮间带常见的蛤类, 不仅肉质鲜美, 而且还具有很高的药用价值, 具有清肺化痰, 软坚散结, 利水消肿, 制酸止痛, 敛疮收湿和抗疲劳之功效[11]。文蛤的组织提取液对艾氏瘤型、肝癌腹水型和肝癌实体型有较高的抑制率[12]。已有较多研究认为[12-15], 文蛤多糖是文蛤中具有抑制肿瘤和免疫活性的一个重要成分。研究文蛤多糖的方向主要集中在提取方法和药理活性评价, 而结构方面相对较少。本实验在进行文蛤多糖提取分离时, 发现不同提取方法所得的多糖组分的分子质量和糖基的组成差异较大。为寻找更具活性价值的多糖组分, 需要对获得的分离组分进行较为精细的结构分析。本文以气质联用(GC-MS)结合二维核磁为主要手段, 对文蛤均多糖组分Fr.2A的结构进行鉴定, 以期为多糖类化合物的结构表征及构效关系研究提供参考。
1 材料与实验方法
1.1 材料
文蛤软体, 购于南通昌华水产食品有限公司, –20℃下储存备用。
1.2 试剂
胰蛋白酶(2 500 U/mg), 木瓜蛋白酶(6 000 U/mg)购自国药集团化学试剂有限公司; 右旋糖酐标准品购自sigma公司; 其他化学试剂均为国药试剂公司的分析纯。
1.3 仪器
SpectraMax酶标仪(美国Molecular Devices公司); 旋转蒸发仪(德国Heidolph公司); 冷冻干燥机2.5 L Traid(美国LABCONCO公司); AKTA purifier 900蛋白纯化系统(美国GE集团); DEAE Sepharose Fast Flow阴离子交换柱和Superdex G 75葡聚糖凝胶柱(美国GE集团); 高效凝胶渗透色谱仪HLC- 8320GPC EcoSEC(美国怀雅特技术公司); 三重四级杆气质联用仪GC-MS TSQ8000(美国赛默飞世尔科技有限公司); 核磁共振波谱仪NMR 600M(德国布鲁克AXS公司)。
1.4 文蛤多糖的提取及纯化
采用双酶法(胰蛋白酶和木瓜蛋白酶)辅助提取文蛤粗多糖[13]; 对文蛤粗多糖进行全波长扫描, 确定最适检测波长; 采用两步层析策略, 多糖进行分离纯化, 分别为弱离子交换层析(DEAE-FF)和分子排阻层析(葡聚糖凝胶柱G75), 得到了组分Fr.2A。
1.5 单糖组成分析
采用离子色谱仪(ICS-5000型), 色谱柱为CarboPA20, 脉冲安培检测器; 流动相分别采用水、250 nmol/L NaOH溶液、1 mol/L NaAc溶液, 流速0.5 mL/min。
1.6 分子质量及纯度检测
高效凝胶渗透色谱法(HPGPC), 色谱仪为HLC- 8320 GPC EcoSEC, 色谱柱为Ultrahydroge Linear (300 mm×7.8 mm ID×2), 采用2410示差折光检测器。流动相为0.1 mol/L NaNO3, 流速为0.8 mL/min; 采用Epower 色谱工作站和GPC软件对多糖样品平均分子质量进行计算, 以右旋糖酐标准品进行曲线校正。
1.7 红外光谱分析
取2 mg Fr.2A与KBr混合、研细、压片, 在4 000~500 cm–1范围内进行扫描。
1.8 GC-MS分析
1.8.1 样品预处理
采用改良的Hakomori法对样品甲基化[16]: 先称取经P2O5干燥的样品50 mg, 加入10 mL无水二甲亚砜, 搅拌使多糖充分溶解; 再加入200 mg干燥的NaOH粉末, 搅拌使之溶解, 反应1 h; 然而加入6 mL碘甲烷, 搅拌反应1 h, 最后加入2 mL水终止反应。反应全程通入氮气进行保护。将反应液减压蒸干去除有机试剂, 再使用去离子水透析24 h。将透析液浓缩、冻干。重复上述步骤3次。样品采用红外光谱检测, 当其3 400 cm–1波长附近的羟基峰完全消失, 表示甲基化完成。
酸水解: 取5 mg甲基化样品加入2 mL 体积分数90% 甲酸, 100℃水解6 h, 减压蒸干, 加入3 mL甲醇再减压蒸干, 重复3次。溶解于2 mL水中, 加入25 mg 硼氢化钠室温反应2 h, 滴加乙酸至溶液pH呈酸性, 减压浓缩蒸干, 加3 mL甲醇和少量乙酸减压蒸干, 重复此步骤4次, 最后一次不加乙酸。
乙酰化: 干燥后样品加2 mL乙酸酐, 100℃衍生化1 h, 减压蒸干, 反复加甲苯(3 mL)减压蒸干, 重复3次; 再溶于氯仿中, 加3 mL水洗涤3次, 最后收集氯仿层用无水硫酸钠干燥, 浓缩至0.3 mL, 得到了部分甲基化糖醇乙酸酯衍生物。
1.8.2 GC-MS检测
采用毛细管色谱柱(HP-5, 0.25 mm×30 m); MSD检测器; 色谱条件: 柱温从140℃升至250℃, 2℃/min; 进口温度: 250℃; 载气: 氦气; 载气流速: 1.0 mL/min; 上样量: 1 μL。
1.9 核磁共振分析
称取干燥样品80 mg, 用D2O(99.96%)溶解样品, 冻干, 重复3次, 使样品中的氢完全被氘氢置换; 再用500 μL D2O溶解, 转移至核磁管中进行检测, 在室温下记录一维NMR(1H-NMR、13C-NMR)和二维NMR(1H-1H COSY、HSQC、HMBC)图谱[17-20]。
2 结果与讨论
2.1 文蛤多糖的提取、分离纯化及理化性质分析
胰蛋白酶和木瓜蛋白酶双酶法联合水解文蛤软体, 提取文蛤多糖[13], 得到文蛤粗多糖MMPX; 经全波长扫描发现, MMPX在215 nm处有吸收, 并经苯酚硫酸法验证为多糖组分, 因而采用该波长作为检测波长。经阴离子交换(DEAE-FF)柱初步分离, 并以0~0.4 mol/L浓度的NaCl溶液进行样品洗脱, 得到了分离度良好的五个组分(图1, Fr.1-5), 进一步对Fr.2组分进行凝胶色谱(Superdex G75)纯化, 得到峰形对称性较好的多糖组分Fr.2A(图1, Fr.2A)。
经高效凝胶过滤色谱法分析, Fr.2A平均分子质量为882 kDa, 纯度达到100%; 离子色谱法对其单糖组成分析表明, 主要由葡萄糖组成。因此, 可对Fr.2A进行结构分析。
2.2 Fr.2A的 FT-IR 分析
Fr.2A在3406.43 cm–1处吸收为-OH伸缩振动; 1 153.41、1 079.83、1 023.84 cm–1处吸收是糖环C—O—C的特征骨架振动; 在2 926.06 cm–1和1 373.26 cm–1的吸收是C—H的伸缩振动和变角振动; 在929.21 cm–1处有吸收, 为D型吡喃环的伸缩振动; 849.53 cm–1处吸收, 是异头端基的特征吸收。根据红外光谱的上述特征吸收, 可以初步推测Fr.2A是主要由-D-吡喃糖组成的多糖。

图1 文蛤多糖(Fr.2A)纯化洗脱曲线

图2 Fr.2A的FT-IR谱图
2.3 Fr.2A的GC-MS分析
多糖经甲基化、酸水解、乙酰化后, 可以得到甲基化的糖醇乙酸酯衍生物, 再利用GC-MS分析, 可以获得有关单糖残基的类型、糖环形式以及羟基的取代情况等多种结构信息。Fr.2A经上述衍生化, 其碎片离子峰经由化学质谱库中检索和分析, 可确定其由三种残基组成: 1, 4-Glc、1, 4, 6-Glc和1-Glc, 三者的摩尔比约为5.58︰1︰1.26, 且都是吡喃型糖(表1)。1, 4-Glc含有2个连接点, 其相对百分含量高, 是糖链的主体, 而1, 4, 6-Glc也是位于主链结构上的糖基, 且其6位存在支化连接; T-Glc包含了主链的末端糖基, 也包含了大量与主链6位连接的侧位糖基。由此可以大致推测出Fr.2A是一条由1, 4糖苷键连接的线性多糖, 其主链存在6位修饰的葡萄糖, 但也并不能完全排除其他支链修饰的可能。
表1 Fr.2A 的甲基化分析结果

Tab.1 Result of Fr.2A methylation
2.4 Fr.2A的核磁分析
由于FT-IR谱图在提供糖构型解析上还不够精确, 因此不能完全排除其他糖构型的存在, 同时在上述衍生化分析时, 可能存在衍生不完全、碎片结构单元丢失等问题, 因此, 要精确推测Fr.2A的结构, 还需要借助核磁共振波谱进一步确认, 具体是确认糖的与构型。
2.4.1 糖基的构型确定
在1H-NMR谱中, 大部分氢信号集中在3.0×10–6~ 4.0×10–6之间, 在此区域的谱峰重叠, 不易进行归属; 但异头氢所在区域能够获得较好的分离度, 可作为糖构型的重要判据。在Fr.2A的1H-NMR图谱(图3)中可以看到4个端基氢信号, 化学位移依次为5.35(A)、5.17(B)、4.92(C)和4.60(D), 其中A和B端基氢的化学位移>5.0×10–6, 可以确定其是来自-构型的异头氢, 而C、D端基氢的化学位移<5.0×10–6, 通常属于-构型; 但在多糖等复杂构型的化合物中, 也有可能是-端基氢的高频偏移, 需要通过二维核磁的近程相关谱(HSQC)耦合常数3JC, H进一步判断, 其判定依据为:构型3JC, H在170 Hz, 而构型3JC, H在160 Hz左右。
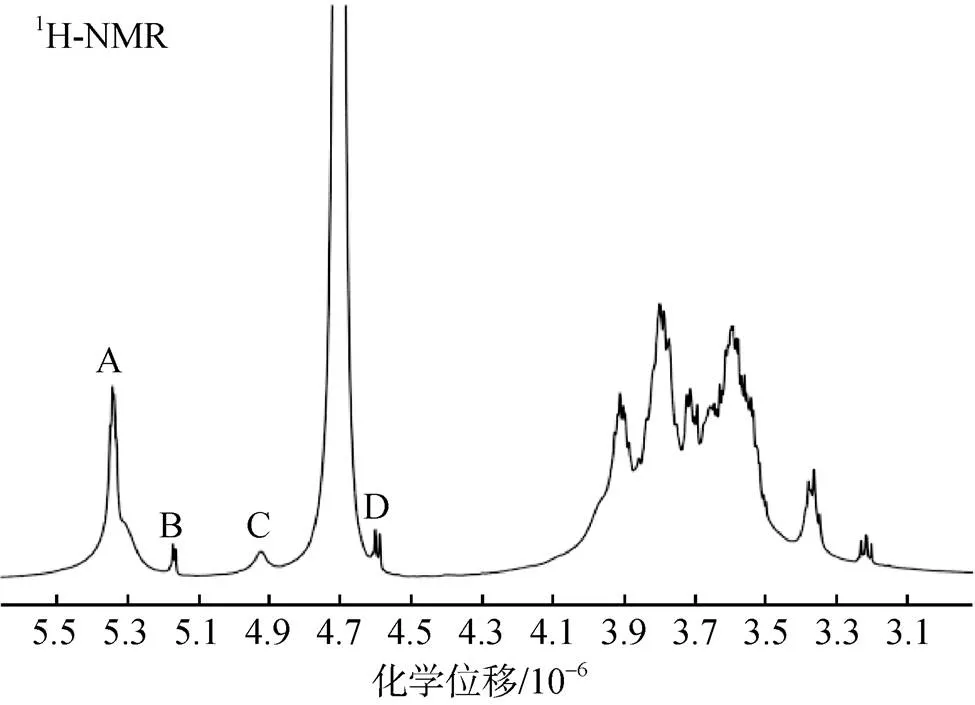
图3 Fr.2A的1H-NMR谱图
HSQC反映的是异核单量子近程相关, 可以确定的是同一位点的H与C的耦合关系, 根据从1H-1H COSY谱中已经识别的氢的化学位移, 在HSQC谱找到与氢相连碳的化学位移。根据Fr.2A的HSQC谱图(图4)从已经确定氢的化学位移推测出相连碳的化学位移, 对A(H1, C1)、B(H1, C1)、C(H1, C1)、D(H1, C1)、…、D(H6, C6)进行归属。通过HSQC图谱中异头碳与对应异头氢的化学位移计算3JC, H耦合常数, 其中C的3JC, H=170 Hz, D的3JC, H=160 Hz, 表明C为构型, D为构型。
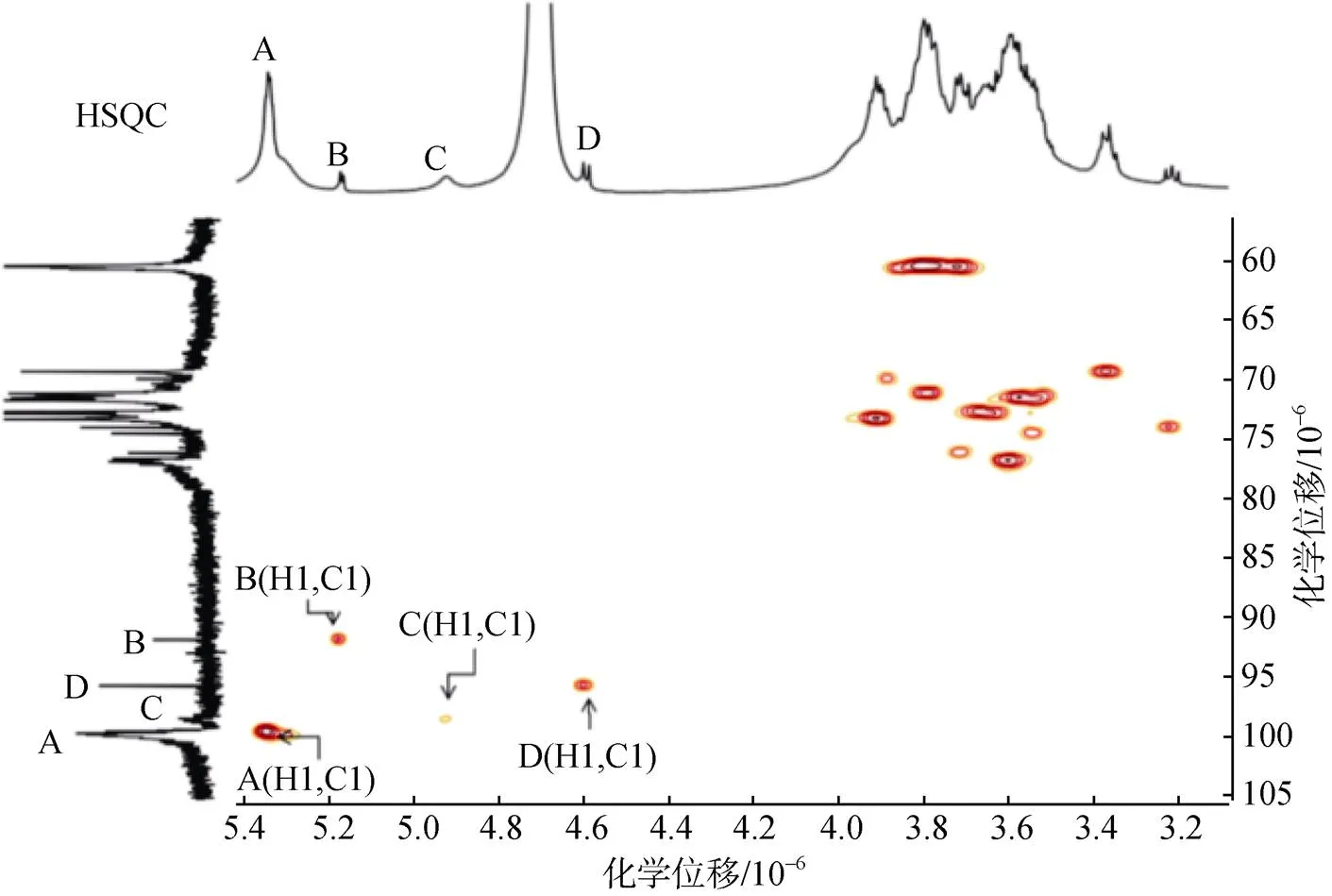
图4 Fr.2A的HSQC谱图
多糖分子的一维碳谱(13C-NMR)中, 异头碳的化学位移集中在90.00×10–6~112.00×10–6, 其中80.00×10–6~ 90.00×10–6区间为呋喃型糖环信号, 80.00×10–6~ 55.00× 10–6为C2-C6的信号区, 一般情况下通过异头碳信号数目来确定糖残基数目, 异头碳区域出现的信号为对应的或构型。在Fr.2A的13C-NMR图谱(图5)中, 同样存在4个异头碳信号, 化学位移依次为99.59×10–6、98.61× 10–6、95.74×10–6和91.83× 10–6, 与一维氢谱中4个异头氢相符, 说明存在4种糖残基, 且都为吡喃型糖环(化学位移), 这与FT-IR和GC-MS结果相符。

图5 Fr.2A的一维碳谱图
2.4.2 连接方式确定
GC-MS的结果初步给出了Fr.2A的连接方式, 主要包括1, 4糖苷键连接和1, 6糖苷键两种方式。如果能够通过核磁图谱获得主要糖基C、H的化学位移, 就可以较为准确地推测出连接方式。
由异头氢的化学位移出发, 在二维氢-氢相关谱(1H-1H COSY)中找到与异头氢交叉的信号峰和相邻氢的耦合关系, 确定相邻氢的化学位移, 依次可以找到其余的氢的化学位移; 根据已经确定的氢的化学位移, 可以在HSQC中找到与相应氢化学位移交叉的信号峰, 确定与氢对应碳的化学位移。因此可对所有的碳和氢的化学位移进行归属(图6、表2)。
HMBC反映的是异核远程相关信息, 可以确定糖环之间的连接方式。根据Fr.2A的HMBC谱(图7), 并结合氢与碳化学位移归属表(表2), 发现A-H1与A-C4, A-H1与C-C4, A-H1与C-H6, B-H1与C-H6, A-H4与A-C1, C-H4与A-C1, D-H1与C-C4, C-H4与D-C1具有相关耦合关系, 确定A与A之间通过1→4连接, A与C之间通过1→4, 1→6连接, D与C之间通过1→4连接, B与C之间通过1→6连接。

图6 Fr.2A的1H-1H COSY谱图

表2 Fr.2A的1H-NMR和13C-NMR化学位移信号归属
糖残基异头氢信号峰面积大小, 反映的是该残基在多糖中含量的多少。对残基异头氢峰面积进行积分, 得到A︰(B+D)︰C=5.54︰1.21︰1.0, 这与GC-MS分析残基比例相吻合, 其中B与D的峰面积比为1︰1。因此, 可以进一步确定残基A为1, 4)--D-Glc, 残基B为1)-- D-Glc, 残基C为1, 4, 6)-- D-Glc, 残基D为1)--D-Glc, 并可推断出残基A, B, C, D的最简摩尔比为11︰1︰2︰1。因此, 多糖Fr.2A可能的结构单元如图8所示。

图7 Fr.2A的HMBC谱

图8 Fr.2A 的结构单元
3 结论
本实验采用GC-MS联合二维核磁共振波谱(1H-1H COSY、HSQC、HMBC)的方法, 对文蛤多糖Fr.2A结构进行解析, 发现Fr.2A是一种以-(1→4), 以及少量-(1→6)连接为主链, 并伴随着少量-(1→ 6)和-(1→4)支链的新型水溶性D型吡喃葡聚糖。
动物体内的以-(1→4)连接为主的多糖大多由糖原衍生而来, 其修饰方式通常-(1→6)葡聚糖的侧链修饰, Fr.2A也属这种类型, 但本文通过二维核磁图谱的精确分析, 发现在侧链糖基上还存在少量的-(1→4)葡聚糖进一步修饰, 使其结构更为复杂。关于-(1→4)-D-Glc支链结构的存在, 在海蛏、河蚌等来源的多糖中也有报道[20-21], 但之前研究并没有明确。
[1] 代荣, 刘如明, 肖建辉. 菌类中药多糖降血糖效应机制研究进展[J]. 中国中药杂志, 2015, 40(2): 174-179.Dai Rong, Liu Ruming, Xiao Jianhui. Research progress on hypoglycemic effect and its mechanism of action of medicinal fungal polysaccharides[J]. China Journal of Chinese Materia Medica, 2015, 40(2): 174-179.
[2] 刘潇潇, 刘丽丽, 赵小亮, 等. 沙蚕()硫酸多糖的结构表征及抗凝血活性研究[J]. 中国海洋药物, 2016, 35(6): 1-6. Liu Xiaoxiao, Liu Lili, Zhao Xiaoliang, et al. Structrure characterization and anticoagulant activities of a sulfated polysaccharide from[J]. Chinese Journal of Marine Drugs, 2016, 35(6): 1-6.
[3] 王凯, 綦慧敏, 李玉磊, 等. 孔石莼多糖及其硫酸酯化衍生物抗肿瘤活性的体外实验研究[J]. 中国海洋药物, 2014, 33(2): 19-23. Wang Kai, Qi Huiming, Li Yulei, et al. The study ofand its derivative on anti-Tumor activity in vitro[J]. Chinese Journal of Marine Drugs, 2014, 33(2): 19-23.
[4] 王竹清, 张凯, 侯虎, 等. 皱纹盘鲍性腺多糖的提取及其体内免疫调节活性研究[J]. 中国海洋药物, 2015, 34(2): 34-38. Wang Zhuqing, Zhang Kai, Hou Hu, et al. Extraction of polysaccharides fromino gonad and immunomodulating activity in vivo of polysaccharides[J]. Chinese Journal of Marine Drugs, 2015, 34(2): 34-38.
[5] 牛庆凤, 王斌, 李涛, 等. 一种新型乌贼墨糖胺聚糖的分离纯化、理化性质及其抗氧化活性研究[J]. 中国海洋药物, 2015, 34(3): 59-64. Niu Qingfeng, Wang Bin, Li Tao, et al. Separation, purification and analyses on physicochemistry properties, antioxidative activity of a novel glycosaminoglycans from[J]. Chinese Journal of Marine Drugs, 2015, 34(3): 59-64.
[6] 郭浩杰, 杨严格, 安乐, 等. 中药多糖的分子修饰及其药理活性研究进展[J]. 中草药, 2015, 46(7): 1074- 1080. Guo Haojie, Yang Yange, An Le, et al. Research progress in molecular modification and pharmacological activity of Chinese materia medica polysaccharides[J]. Chinese Traditional and Herbal Drug, 2015, 46(7): 1074-1080.
[7] 孟思彤, 徐艳芝, 王振月. 多糖的化学修饰对其生物活性影响研究进展[J]. 天然产物研究与开发, 2014(11): 1901-1905. Meng Sitong, Xu Yanzhi, Wang Zhenyue. Research progress on chemical modification of polysaccharide and their biological activities[J]. Natural Product Research and Development , 2014(11): 1901-1905.
[8] 李绍平, 吴定涛, 赵静. 糖谱及其在中药多糖质量控制中的应用[J]. 中国中药杂志, 2015, 40(17): 3505- 3513. Li Shaoping, Wu Dingtao, Zhao Jing. Saccharide mapping and its application in quality control of polysaccharides from Chinese medicines[J]. China Journal of Chinese Materia Medica, 2015, 40(17): 3505-3513.
[9] 徐航, 朱锐, 刘玮, 等.多糖高级结构解析方法的研究进展[J]. 药学进展, 2015(5): 364-369. Xu Hang, Zhu Rui, Liu Wei, et al. Research progress in analytical methods for Aadvanced structures of polysaccharides[J]. Progress in Pharmaceutical Sciences, 2015(5): 364-369.
[10] 郭涛, 李洁, 郭甜甜, 等. 盐碱地植物内生真菌SXH- 69胞外多糖的分离、化学组成和结构特征[J]. 中国海洋药物, 2015(6): 23-27. Guo Tao, Li Jie, Guo Tiantian, et al. Isolation, chemical components and structural characterization of extracellular polysaccharides produced by the saline-alkali plant endophytic fungus SXH-69[J]. Chinese Journal of Marine Drugs, 2015(6): 23-27.
[11] 严晓丹, 钱建瑛, 许泓瑜, 等. 文蛤不同极性提取物对糖尿病小鼠降血糖作用的研究[J]. 中国海洋药物, 2015, 34(5): 71-76. Yan Xiaodan, Qian Jianying, Xu Hongyu, et al. Hypoglycemic effect of different extracts fromin diabetic mice[J]. Chinese Journal of Marine Drugs, 2015, 34(5): 71-76.
[12] 袁强, 袁弘. 文蛤多糖对小鼠调节血糖和抗应激功能的影响[J]. 中国现代应用药学, 2007, 24(2): 113-114. Yuan Qiang, Yuan Hong. Effect of Meretrix polysaccharides on blood sugar regulation and stress response in the experimental diabetic rats[J]. Chinese Journal of Modern Applied Pharmacy, 2007, 24(2): 113-114.
[13] Li Li, Li Heng, Qian Jianying, et al. Structural and Immunological Activity Characterization of a Polysaccharide Isolated fromLinnaeus[J]. Marine drugs, 2015, 14(1): 6.
[14] Lin Song, Chen Xiaolin, Liu Xiaodong, et al. Characterization and comparison of the structural features, immune-modulatory and anti-avian influenza virus activities conferred by three algal sulfated polysaccharides[J]. Marine Drugs, 2015, 14(1): 4.
[15] Du Zhengcai , Hou Xiaotao, Huang Qing, et al. Progress of Chemical Composition and Pharmacological Effects ofLinnaeus[J]. Animal Husbandry and Feed Science, 2014, 6(5): 287-290.
[16] 刘丽丽. 酸性多糖甲基化分析方法的改进[D]. 青岛: 中国海洋大学, 2014. Liu Lili. Improvement of methods for Methylation Analysis of Acidic polysaccharides[D]. Qingdao: Chinese Marine University, 2014.
[17] 王林强. 核磁共振在多糖结构解析中的应用[D]. 上海: 华东师范大学, 2013. Wang Linqiang. Application of the NMR Techniques in Structural Analysis of Polysaccharides[D]. Shanghai: East China normal University, 2013.
[18] 何宇愿, 谢璐为, 杜冠峰, 等. 狗肝菜多糖P1A的结构解析[J]. 中国中药杂志, 2015, 40(8): 1489-1492. He Yuyuan, Xie Luwei, Du Guanfeng, et al. Studies on structure characteristic of polysaccharide P1A from[J]. China Journal of Chinese Materia Medica, 2015, 40(8): 1489-1492.
[19] 殷秀红. 紫贻贝(Linnaeus)多糖的提取分离及结构研究[D]. 青岛: 中国海洋大学, 2011. Yin Xiuhong. Extraction, Isolation and Structural Characterization of Polysaccharides fromLinnaeus[D]. Qingdao: Chinese Marine University, 2011.
[20] Yuan, Qingxia, et al. Structural Characterization and Immunostimulatory Activity of a Homogeneous Polysaccharide from[J]. Journal of Agricultural & Food Chemistry 63.36(2015): 7986-7994.
[21] 栾晓红. 两种海蛏多糖的提取、分离和结构分析[D]. 青岛: 中国海洋大学, 2015. Luan Xiaohong. Extraction, separation and structural characterization of polysaccharides from two species of[D]. Qingdao: Chinese Marine University, 2015.
[22] 林双喜. 河蚌多糖的生物学活性研究[D]. 福州: 福建农林大学, 2007. Lin Shuangxi. Studies on biological properties of polysaccharides from[D]. Fuzhou: Fujian Agriculture and Forestry University, 2007.
(本文编辑: 康亦兼)
The structure ofLinnaeus polysaccharide Fr.2A characterized by GC-MS and 2D NMR
HE Yong-feng, QIAN Jian-ying, LI Heng, LU Zhen-ming, XU Zheng-hong, SHI Jin-song
(Key Laboratory of Carbohydrate Chemistry and Biotechnology, ministry of Education; School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, China)
In this study, the structure of a polysaccharide is analyzed using GC-MS combined with two-dimensional NMR. A polysaccharide from the clamLinnaeus (MMPX) was prepared using double enzyme- assisted water extraction, and its purity was analyzed and characterized using GC-MS and 1D and 2D NMR. The result showed that Fr.2A, extracted and purified fromLinnaeus, is a type of highly purified polysaccharide. The GC-MS analysis demonstrated that Fr.2A had three types of residue: 1, 4-Glc), T-Glc), and (1, 4, 6-Glc, and that the molar ratio of these residues was 5.58︰1.26︰1.0. The NMR spectrum results demonstrated that the main chain in Fr.2A was-(1→4) with a small amount of-(1→6) included, and that the branch was linked with less-(1→6) and-(1→4), which is a novel water-soluble D-glucan.
GC-MS; 2D NMR; polysaccharide; structural characterization
Mar. 20, 2017
R931
A
1000-3096(2017)10-0050-08
10.11759/hykx20170320003
2017-03-20;
2017-07-18
国家海洋公益性行业科研专项经费项目(201305007); 江苏省重大科技成果转化项目(BA2015006)
[National Marine public welfare industry research foundation of China, No.201305007; The transformation project for major scientific and technological achievements in Jiangsu Province, No.BA2015006]
何永峰(1989-), 男, 湖南道县人, 硕士研究生, 主要从事海洋活性多糖相关的研究, E-mail.15061888901@163.com; 史劲松, 通信作者, 男, 教授, 主要从事酶工程及天然活性物质开发研究, E-mail.shijs@163.com

