温州地区妊娠月份特异性血清甲状腺功能参考值范围制定及意义
胡迎春 王连云 王剑平 麻艳艳 丁红香 王玉环*
临床和基础研究证明,甲状腺疾病可导致不良的妊娠结局,并可能对后代的远期认知及发育产生不良影响[1]。研究已证实妊娠期甲状腺功能的参考值范围不同于一般育龄妇女[2]。美国甲状腺学会(ATA)指南建议,本单位或者本地区需要建立妊娠早、中、晚期特异的血清甲状腺功能指标参考值范围(A级)[3]。中华医学会《妊娠和产后甲状腺疾病诊治指南》[4]推荐,各个地区应建立该地区妊娠期特异的血清甲状腺功能指标参考值范围。我国学者报道了济南、郑州、广州、北京等地区妊娠期特异性血清甲状腺指标的参考范围,不同地区促甲状腺激素(TSH)上限差异较大。温州地处沿海地区,碘摄入水平不同于其他地区[5],尚未建立温州地区妊娠月份特异性血清甲状腺功能参考值范围。建立温州地区妊娠月份特异性甲状腺功能参考值范围,将有利于温州地区妊娠期甲状腺疾病的诊断及治疗。
1 临床资料
1.1 一般资料 采用横断面调查方法,收集2015年1月至2016年7月在本院就诊产检的妊娠期妇女,检测甲状腺功能,包括游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)、TSH、甲状腺过氧化酶抗体(TPOAb)、甲状腺球蛋白抗体(TgAb),并随访这些妊娠期妇女的妊娠结局。筛选上述人群中符合美国临床生化研究院(NACB)推荐标准:单胎妊娠、无不良妊娠结局、无产科合并症及并发症的孕妇768例。根据妊娠期的不同,分为早期妊娠(Tl期,孕6~12+6周)284例,中期妊娠(T2期,孕13~27+6周)356例,晚期妊娠(T3期,孕28周~分娩)128例。入选标准:依据美国临床生化研究院(NACB)的入选标准,妊娠期血清甲状腺功能参考值制定来自下述条件的正常人群:(1)无甲状腺疾病家族史、既往史或其他自身免疫性疾病史者。(2)无服用影响甲状腺功能的药物(雌激素除外)史者。(3)TPOAb、甲状腺球蛋白抗体(TgAb)阴性者(免疫化学发光等敏感测定方法)。(4)无可见或者可触及的甲状腺肿者。(5)无妊娠剧吐、滋养层细胞病、子痫前期、糖尿病者。(6)单胎妊娠者。(7)温州地区常住人口(本市连续居住>5年)者。所有孕妇均详细登记年龄、月经史和末次月经、预产期、居住地(农村或城镇)。孕周的计算根据末次月经推算,对于末次月经不详和月经周期不规则的孕妇,根据孕早期B超结果推算孕周。排除标准:(1)无法正确核对孕周的妊娠妇女。(2)吸烟、酗酒、吸毒的孕妇。
1.2 方法 (1)问卷调查及标本收集:所有入选对象在首次产检时填写问卷调查表,接受体格检查,抽取空腹肘静脉血3 ml于干燥管,血样充分凝集后超速离心,取上清液并置-20℃保存待测。(2)入选对象的基本特征:平均年龄25.4岁(19~40岁),T1、T2、T3期年龄中位数分别为26.3、25.4、24.5岁。T1、T2、T3期的孕次中位数均为1.0次,既往产次中位数均为0次。T1、T2、T3期平均孕周分别为(11.6±1.1)、(15.9±3.4)、(37.1±3.4)周。(3)实验室检查:应用德国西门子公司高效能 ADVIA Centaur XP 全自动免疫分析系统测定入选人群血清中的TSH,FT4,FT3。试剂盒的普通人群参考值范围:TSH:0.55~4.78 mU/L,FT4:0.89~1.76ng/dl,FT3:2.30~4.20 pg/ml。 采 用罗氏公司Cobas E602 检测仪电化学发光法检测血清TPOAb、TgAb。以试剂盒提供的界值TPOAb>34 IU/ml,TgAb>115IU/ml判断为阳性。根据NACB入选标准要求,排除TPOAb、TgAb阳性孕妇。质量控制:该项目由专人负责样品收集、实验室检测和质量控制工作。每次实验均带内质控样品。各指标测定指定由本院专业人员进行,检测各指标的质控品由试剂厂家提供,质控品的监测结果符合标准。根据检测结果,分别制定参考范围。计算方法遵循NACB的建议:妊娠期TSH和FT4参考值建立选择95%可信区间,即2.5th为下限和97.5th为上限。由此制定温州地区T1期、T2期和T3期血清TSH、FT4、FT3的参考值范围。本项目已通过温州医科大学附属第二医院临床研究伦理委员会的审查。
1.3 统计学方法 采用SPSS 21.0统计软件。对数据资料进行正态性检验,符合正态的计量资料以(表示,不符合正态的计量资料以中位数(M)和第2.5、97.5百分位数(P2.5、P97.5)表示,数据资料行方差齐性检验,符合方差齐性的资料,多组间比较采用单因素方差分析,非正态分布资料进行对数转换,对数转换后仍不符合正态分布的组间比较采用Kruskal-Wallis检验。P<0.05为差异有统计学意义。
2 结果
2.1 温州地区妊娠月份特异性血清TSH、FT4、FT3的中位数及参考范围 T1、T2、T3期血清TSH的中位数及参考范围[M(P2.5、P97.5)]分别为 1.21(0.11~3.99)mU/L、1.33(0.13~4.11)mU/L 和 1.78(0.42~4.74)mU/L。早孕期TSH水平较中、晚孕期偏低,T1期与T2期比较,差异无统计学意义(P=0.115);T2期与T3期比较,T1期与T3期比较,差异有统计学意义(P均<0.05)。FT4值在整个孕期呈下降趋势。各期之间比较差异均有统计学意义(P均<0.05)。比较T1期、T2期、T3期血清FT3水平,可见FT3值在整个孕期呈逐渐下降趋势。T1期最高,T2期、T3期逐渐降低。各期之间比较差异均有统计学意义(P均<0.05)。见表1。
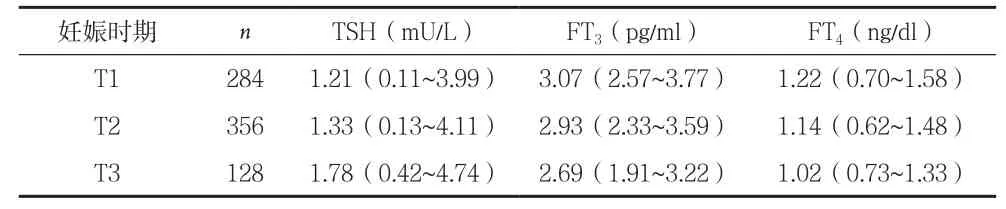
表1 不同孕期血清TSH、FT3、FT4的参考范围[M(P2.5-P97.5)]
2.2 不同甲状腺功能参考值范围下亚临床甲状腺功能减退(亚临床甲减)孕妇的患病率比较 三种不同甲状腺功能参考值范围下亚甲减患病率的比较:纳入的768例数据,采用2011年ATA指南标准和本实验室标准及试剂盒标准筛查各孕周段妊娠期亚临床甲减的患病率。(1)2011年ATA标准组:ATA推荐的T1期 TSH 水平为 0.1~2.5 mU/L,T2期 0.2~3.0mU/L;T3期0.3~3.0 mU/L,以血清TSH水平,T1期>2.5 mU/L,T2、T3期>3.0 mU/L,血清FT4水平在非妊娠期正常范围内为妊娠合并亚甲减。(2)试剂盒标准组:甲状腺功能的正常参考值为:TSH:0.55~4.78 mU/L,FT4:0.89~1.76 ng/dl,FT3:2.30~4.20 pg/ml。T1、T2 期、T3期,血清 TSH>4.78 mU/L,FT4水平在 0.89~1.76ng/dl,为妊娠合并亚甲减。(3)本实验标准组:本组获得妊娠月份特异性血清甲状腺功能参考值血清TSH范围:T1期 1.21(0.11~3.99)mU/L ;T2 期 1.33(0.13~4.11)mU/L;T3期 1.78(0.42~4.74)mU/L。T1期 TSH>3.99 mU/L,T2期 >4.11mU/L,T3期 >4.74mU/L,FT4对应期别范围内,T1期1.22(0.70~1.58)pg/ml,T2期1.14(0.62~1.48)pg/ml,T3 期 1.02(0.73~1.33)pg/ml,为妊娠合并亚甲减。
应用本研究标准的妊娠期特异性参考值范围,T1期、T2期、T3期亚临床甲减的患病率分别为2.8%、2.24%、2.34%;按2011年ATA亚甲减标准诊断的孕妇T1期、T2期、T3期亚临床甲减的患病率分别为9.15%、8.14%、13.28%,即每期>5%的孕妇可能会过度诊断为亚临床甲减;采用试剂盒参考值标准,孕妇T1期、T2期、T3期亚临床甲减的患病率分别为0.70%、0.84%、0.78%,根据这一标准进行诊断,大约1.5%的亚临床甲减孕妇会漏诊。以本研究标准诊断的观察组亚甲减孕妇共19例,患病率为2.47%(19/768),与试剂盒标准组孕妇的亚甲减患病率0.78%(6/768)比较,差异有统计学意义(P<0.05);与2011年ATA标准组孕妇亚甲减患病率9.38%(72/768)比较,差异有统计学意义(P<0.05)。
3 讨论
3.1 建立温州地区妊娠月份特异性参考值范围的必要性及意义 ATA2017年4月颁布新的《妊娠期和产后甲状腺疾病诊断和处理指南》(ATA指南)[6]建议,本单位或者本地区需要建立妊娠早、中、晚期特异的血清甲状腺功能指标参考(A级)。我国各个地区建立的地区特异性甲状腺参考值范围,因为地域分布不同,碘摄入水平不同以及试剂不同,不适用于温州地区。本研究应用NACB指南推荐的方法分别收集妊娠期妇女早、中、晚妊娠期血清,建立了适用于温州地区妊娠月份特异性的血清甲状腺相关指标参考范围。本研究获得的T1期、T2期、T3期血清TSH正常参考范围分别为(0.11~3.99)、(0.13~4.11)、(0.42~4.74)mU/L,与2011年ATA指南推荐的妊娠3个时期的血清TSH上限值2.5、3.0、3.0 mU/L比较,明显升高。妊娠早期TSH标准接近于2017年ATA推荐的新标准[6]。根据本研究获得的资料,也进一步验证了温州地区需要根据本地区妊娠期妇女情况,建立适合于温州地区的妊娠月份特异性血清甲状腺功能参考值的重要性。
3.2 利用不同参考值范围标准诊断妊娠期的亚临床甲减患病率的区别及临床意义 根据本文研究,如按照2011ATA指南[3]诊断标准,768例妊娠期妇女中,共72例(9.38%)可于孕期诊断亚临床甲减,该部分患者将要接受左旋甲状腺素的治疗,增加孕妇经济负担同时,也增加其精神压力及不必要的治疗。如按照试剂盒标准组的诊断标准,768例妊娠期妇女中,仅6例诊断为亚甲减,其患病率为0.78%,由此可见,部分患者将会漏诊,从而得不到及时的治疗。而已有多项研究表明,妊娠期亚临床甲减对胎儿及后代神经发育有影响。而参照本研究制定的妊娠月份特异性参考值范围进行诊断,2.47%可诊断为孕期亚临床甲减。国、内外文献报道的妊娠期亚临床甲减的患病率为2%~3%[2,7],与本研究结果接近。综上所述,本研究支持以下观点:依照2011年ATA指南推荐值诊断我国妊娠期亚临床甲减会存在过度诊断的情况,而应用试剂盒标准则会增加亚临床甲减漏诊的几率。本研究结果支持国内指南的推荐以及2017年美国ATA指南推荐,各个地区和医院应该建立符合本地区的妊娠期特异性甲状腺功能参考值范围。
[1] 薛海波,李元宾,滕卫平,等.妊娠早期母体亚临床甲状腺功能减退症对其后代脑发育影响的前瞻性研究.中华内分泌杂志,2010,26:916-920.
[2] Stricker RT,Echenard M,Ebehart R,et al,Evaluation of maternal thyroid function during pregnancy:the importance of using gestinnal age specific reference intervals.Eur J Endocrinol,2007,157:509-514.
[3] Stagnaro-Green A,Abalovich M,Alexander E,et al.Guidelines of the Amercican Thyroid Association for the diagnosis and management of thyroid diseases during pregnancy and postpartum.Thyroid,2011,21:1081-1125.
[4] 中华医学会内分泌学分会,中华医学会围产医学分会.妊娠和产后甲状腺疾病的诊治指南.中华内分泌代谢杂志,2012,28(5):354-371.
[5] 倪庆翔,张孝和,陈祎,等.温州市碘缺乏病防治现状调查.浙江预防医学杂志,2011,23(1):37-40.
[6] Erik KEK,Elizabeth NEN,Gregory A.Brent,et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease during Pregnancy and the Postpartum.Thyroid,2017,27:315-389.
[7] Li C,Shan Z,Mao J,et al.Assessment of thyroid function during first-trimester pregnancy: what is the rational upper limit of serum TSH during the first trimester in Chinese pregnant women.J Clin Endocrinol Metab,2014,99(1):73-79.

