硝酸铋作为催化剂氧化脱除模拟油中的二苯并噻吩
毛春峰, 赵荣祥, 李秀萍
(1.辽宁石油化工大学 石油化工学院, 辽宁 抚顺 113001; 2.辽宁石油化工大学 化学与材料科学学院, 辽宁 抚顺 113001)
硝酸铋作为催化剂氧化脱除模拟油中的二苯并噻吩
毛春峰1, 赵荣祥1, 李秀萍2
(1.辽宁石油化工大学 石油化工学院, 辽宁 抚顺 113001; 2.辽宁石油化工大学 化学与材料科学学院, 辽宁 抚顺 113001)
以硝酸铋为催化剂,1-甲基咪唑四氟硼酸盐离子液体([HMIM]BF4)为萃取剂和助催化剂,H2O2为氧化剂氧化脱除模拟油中的二苯并噻吩(DBT)。考察了反应温度、H2O2用量、催化剂用量、离子液体用量对脱硫率的影响。结果表明,在模拟油5 mL、硝酸铋加入量0.02 g、[HMIM]BF4加入量1.0 mL、H2O2加入量0.3 mL、反应温度80℃、反应时间180 min的最佳条件下,模拟油的DBT脱除率可以达到99.5%。催化剂循环使用5次活性无明显下降。对硝酸铋的氧化脱硫机理进行了解释。
硝酸铋; 氧化脱硫; 离子液体; 二苯并噻吩(DBT)
油品中的硫化物燃烧产生的SOx是形成雾霾及酸雨[1-2]的主要原因。为限制运输燃料中的硫含量,欧美等国家都制定严格的标准,甚至出台“零硫标准”(硫质量分数低于10 μg/g)[3]。为同国际接轨,我国将逐渐实施汽油、柴油国Ⅴ排放标准,炼油企业面临环保和效益的双重压力。加氢脱硫技术是世界各国清洁燃料生产的主要工艺[4],虽然在技术上已经很成熟,但是也存在诸如高温高压[5-7]、产品选择性较低[8]、运营成本高[9]等弊端。近年来,作为加氢脱硫的补充,吸附脱硫[10-11]、萃取脱硫[12]、生物脱硫、氧化脱硫等非加氢脱硫技术受到广泛研究[13-14]。氧化脱硫被认为是最有前途的脱硫技术之一,其优点是对于噻吩类等加氢活性较低的硫化物有很高的脱除率[15-17],且反应条件温和(常压、反应温度低于100℃)。在氧化脱硫过程中,氧化剂起到至关重要的作用。氧化剂的种类很多(如KMnO4、H2O2及NO2等),然而从环保及经济学角度,H2O2是最好的氧化剂。一方面,H2O2价格低廉,成本低;另一方面,H2O2氧化副产物是水,不会对环境造成污染。
离子液体作为一种新型的溶剂,以其低的挥发性、宽的液程范围、良好的溶解性能有希望成为传统的有毒有机溶剂的替代者。在油品的氧化脱硫中,离子液体经常作为萃取剂使用[18-21]。然而,多数离子液体的萃取效果并不理想,脱硫率在10%~40%。
为了解决这一难题,研究者开发了兼具催化和萃取性能的离子液体。例如,Zhao 等[22]合成了N-甲基-2-吡咯烷酮氟硼酸盐([Hnmp]BF4),用于油品的脱硫,脱硫率达到了90%以上。Gao等[23]合成的1-丁基-3-甲基咪唑硫酸氢盐([BMIM][HSO4])在最佳条件下可使模拟油中二苯并噻吩(DBT)的脱除率达到99.6%。Zhang等[24]制备的吡啶基功能性离子液体在优化条件下可以实现82%以上的脱硫率。Lu等[25]合成的1-甲基咪唑四氟硼酸盐([HMIm]BF4)酸性离子液体在不同的温度下可以实现60%~93%的脱硫率。为了获得较好的脱硫效果,上述的脱硫过程或者采用较高的反应温度,或者采用较多的离子液体,增加了脱硫过程的运营成本,不利于工业化。
商业硝酸铋获得方便,而且价格低廉,其在有机物的转化方面具有较多的应用。例如Hekmatshoar等[26]将硝酸铋负载于SiO2作为安息香的氧化剂,取得了较好的效果。Khodaei等[27]发现,硝酸铋可以在温和条件下有效催化硫醇生成二硫化物。Tymonko等[28]指出,安息香可以在硝酸铋二价铜盐和醋酸的联合作用下生成苯偶酰。Rocha等[29]以硝酸铋为催化剂,以H2O2为氧化剂氧化烯烃,并对硝酸铋的作用机理进行了研究。
笔者首次将硝酸铋作为氧化脱硫的催化剂,以1-甲基咪唑四氟硼酸盐离子液体作为萃取剂,H2O2作为氧化剂进行氧化脱硫,考察了反应温度、H2O2用量、1-甲基咪唑四氟硼酸盐离子液体用量及硝酸铋用量对脱硫效果的影响,以及硝酸铋的回收和重复使用性能,并对氧化脱硫体系进行了动力学分析和机理探讨。
1 实验部分
1.1 试剂
H2O2,质量分数30%的水溶液;正辛烷;氟硼酸钠,质量分数98%;硝酸铋(Bi(NO3)3),质量分数99%;四氯化碳,质量分数99%,均购自国药集团化学试剂有限公司。二苯并噻吩(DBT),质量分数98%;苯并噻吩(BT),质量分数97%;噻吩(HT),质量分数99.8%,均购自上海阿拉丁生化科技股份有限公司。N-甲基咪唑,质量分数98%,浙江凯乐化工厂产品。1-甲基咪唑四氟硼酸盐离子液体([HMIM]BF4),自制[30]。
1.2 催化剂的表征
采用德国布鲁克光谱仪器公司D8 Advance Bruker型X射线衍射(XRD)仪测定样品的物相,10°~70°扫描。采用美国Nicolet公司NEXUS670型红外光谱仪对样品进行傅里叶变换红外光谱(FT-IR)测定, KBr压片,4000~400 cm-1扫描。
1.3 氧化脱硫过程
将1.437 g的DBT加入500 mL正辛烷中,配成含硫量为500 μg/g的模拟油。量取5 mL模拟油、一定量的研磨后Bi(NO3)3和[HMIM]BF4于带有回流装置的三角烧瓶中,加入一定量的H2O2。在一定温度下持续搅拌,每隔20 min吸取上清液,采用江苏江分电分析仪器有限公司WK-2D型微库仑综合分析仪测定其硫含量,按式(1)计算脱硫率(η)。
η=(a-b)/a×100%
(1)
式(1)中,a、b分别为反应前、后油品中硫质量分数。
2 结果与讨论
2.1 不同脱硫体系的脱硫效果以及液体收率
为了证明硝酸铋在该氧化脱硫体系中的催化作用,设计了4组对比实验,结果列于表1。从表1可以看出,单纯的[HMIM]BF4离子液体萃取的脱硫率很低;加入H2O2形成[HMIM]BF4-H2O2脱硫体系所得脱硫率急剧升高,这是因为离子液体[HMIM]BF4具有一定的催化活性,可以促进氧化脱硫进程[30];当既加H2O2又加Bi(NO3)3形成[HMIM]BF4-H2O2-Bi(NO3)3体系后,180 min 内脱硫率急剧上升到91.73%。采用BiCl3替代Bi(NO3)3形成[HMIM]BF4-H2O2-BiCl3氧化脱硫体系,在180 min内脱硫率为 66.15%,说明BiCl3也具有一定催化能力,但催化能力弱于硝酸铋。4种脱硫体系的液体收率均大于98%,脱硫后模拟油的损失很少。以下以[HMIM]BF4-H2O2-Bi(NO3)3为研究对象,确定最佳氧化脱硫反应条件。

表1 不同脱硫体系的脱硫效果和液体收率Table 1 The sulfur removal rate and liquid yield of different desulfurization systems
Reaction conditions:V(Model oil)=5 mL,V(Ionic liquid)=1 mL,m(Catalyst)=0.02 g,V(H2O2)=0.3 mL,T=60℃,t=180 min
2.2 脱硫反应条件对[HMIM]BF4-H2O2-Bi(NO3)3体系脱硫效果的影响
2.2.1 反应温度的影响
分别考察了[HMIM]BF4-H2O2-Bi(NO3)3体系在50、60、70、80和90℃下对DBT模拟油的脱硫效果,结果示于图1。从图1可以看出,当反应温度低于80℃时,在180 min时间内,随着反应温度的升高,脱硫率从57.3%升至97.5%。这是因为DBT被氧化为二苯并噻吩砜(DBTO2)的反应为吸热反应,反应温度升高促进脱硫反应的进行;另一方面,在高温下萃取剂离子液体的黏度会下降,有利于提高传质速率[31]。然而,当反应温度由80℃升至90℃时,脱硫率下降到91.6%。这是因为温度过高,会促进H2O2直接分解为H2O和O2[32],氧化活性下降。由此可知,最适宜的反应温度为80℃。
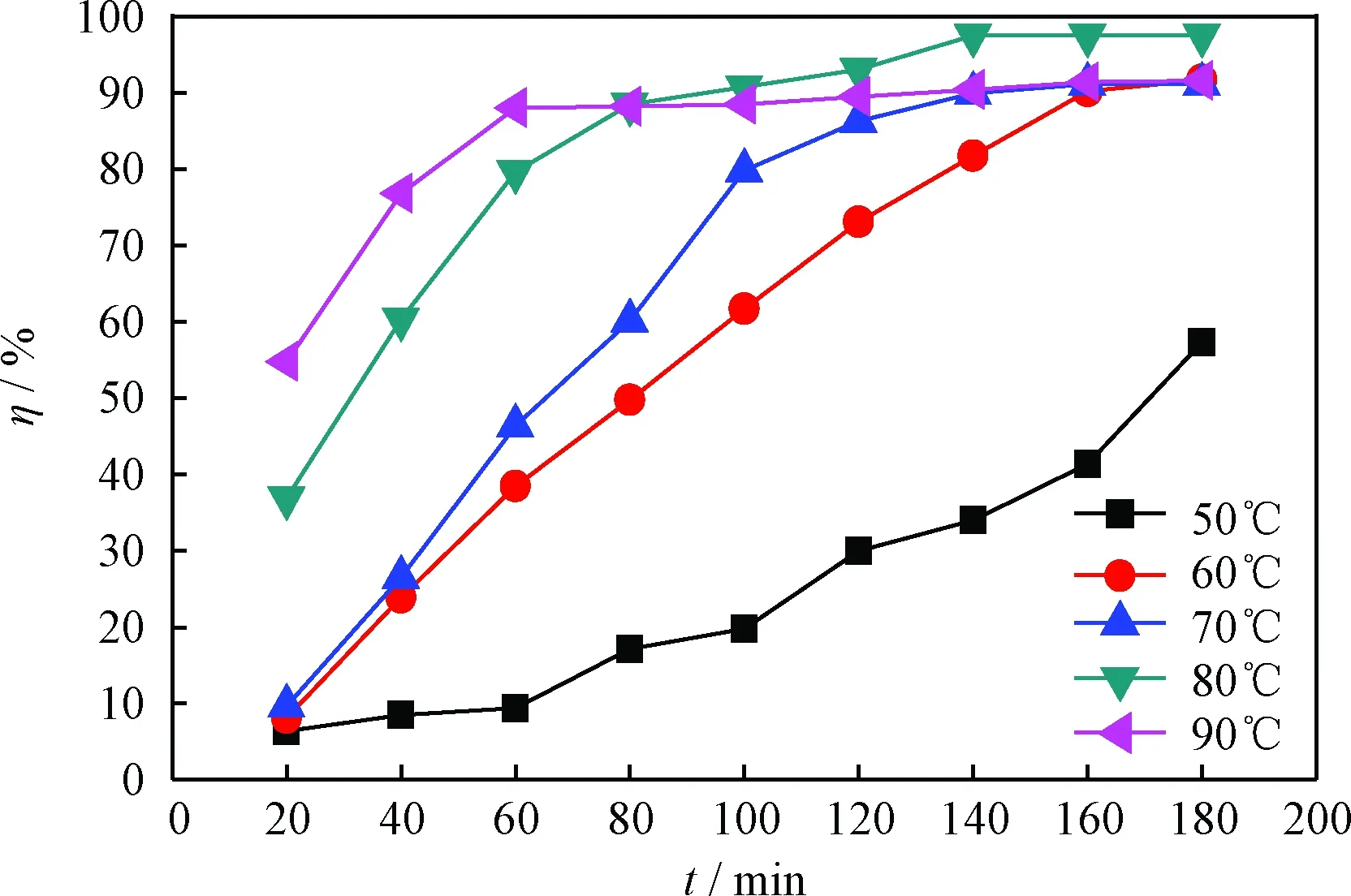
图1 氧化脱硫反应温度对DBT模拟油脱硫率(η)的影响Fig.1 Effect of oxidative desulfurization temperature on sulfur removal rate (η) of DBT model oil Reaction conditions: V(Model oil)=5 mL; V([HMIM]BF4)=1 mL;m(Bi(NO3)3)=0.02 g; V(H2O2)=0.3 mL
2.2.2 H2O2用量的影响
不同H2O2用量的[HMIM]BF4-H2O2-Bi(NO3)3体系对DBT模拟油的脱硫效果示于图2。H2O2在该氧化脱硫体系中作为氧化剂。H2O2用量过少,不足以将DBT完全氧化成DBTO2,H2O2用量过多,会增加到副产物水的量,进而稀释萃取剂,影响脱硫效果[32]。
从图2可以看出,当不添加H2O2时,体系为萃取脱硫,因此脱硫率很低,仅为5.4%。当H2O2用量由0.1 mL增加到0.3 mL时,脱硫率从59.2%上升到97.5%。由于存在H2O2分解等副反应,适当增加H2O2,可以增强氧化能力,DBT更容易的被氧化成DBTO2;当H2O2用量增加到0.4 mL 时,脱硫率反而下降,为95.7%。从经济角度和脱硫率考虑,H2O2最佳用量为0.3 mL。

图2 氧化脱硫反应中H2O2用量对DBT模拟油 脱硫率(η)的影响Fig.2 Effect of H2O2 dosage in oxidative desulfurization on sulfur removal rate (η) of DBT model oil Reaction conditions: V(Model oil)=5 mL; V([HMIM]BF4)=1 mL;m(Bi(NO3)3)=0.02 g; T=80℃
2.2.3 Bi(NO3)3加入量的影响
图3为催化剂Bi(NO3)3加入量对DBT模拟油的脱硫效果的影响。从图3可以看出,当Bi(NO3)3加入量从0.01 g增加到0.02 g后,在180 min内,脱硫率从97.5%上升到99.5%。这是因为增加Bi(NO3)3的量意味着增加反应的活性位[33]。当Bi(NO3)3加入量增大到0.03 g和0.04 g时,脱硫率略有下降。综上分析,最佳Bi(NO3)3用量为0.02 g。
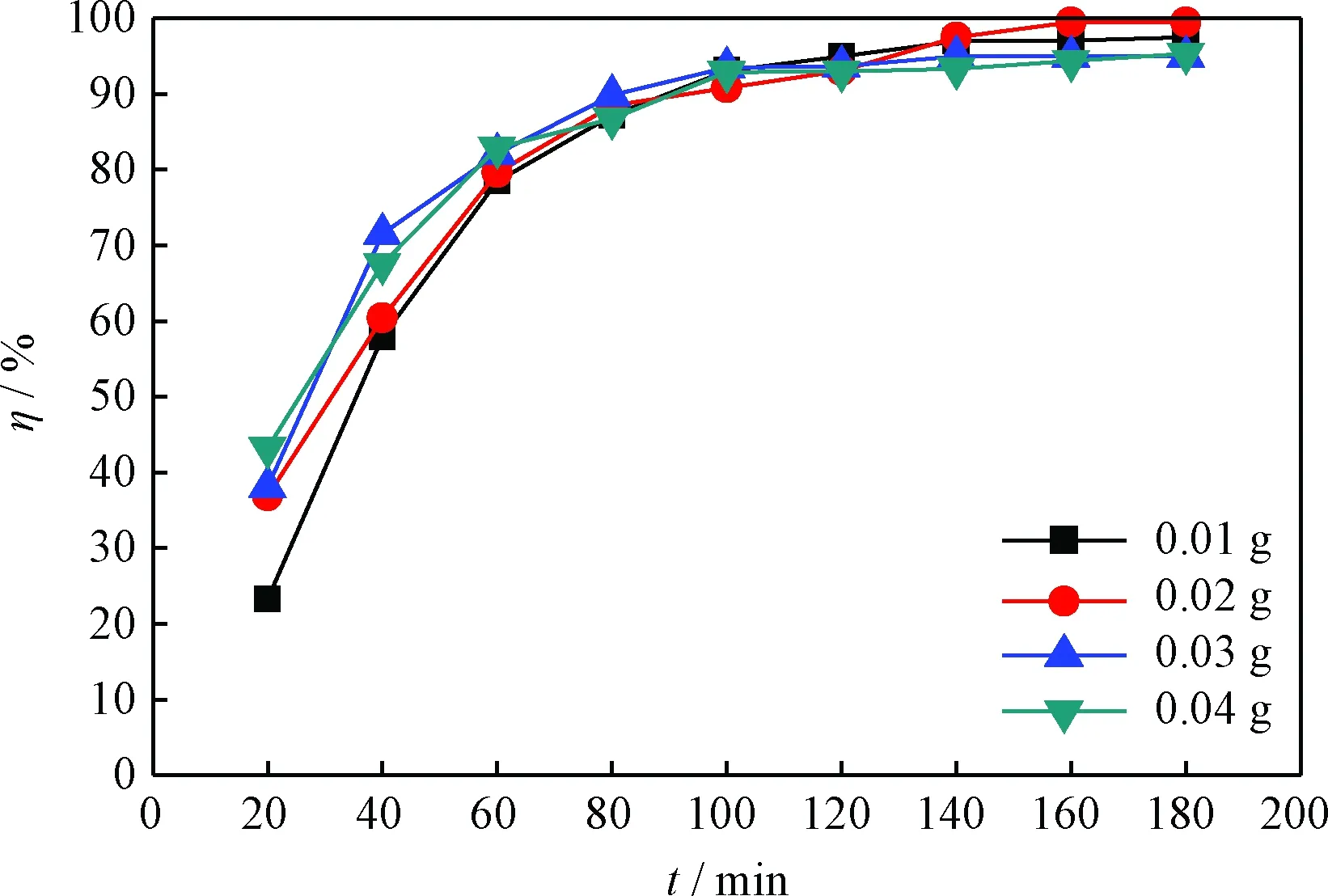
图3 氧化脱硫反应中Bi(NO3)3加入量对DBT模拟油 脱硫率(η)的影响Fig.3 Effect of Bi(NO3)3 dosage in oxidative desulfurization on sulfur removal rate (η) of DBT model oil Reaction conditions: V(Model oil)=5 mL; V([HMIM]BF4)=1 mL;V(H2O2)=0.3mL; T=80℃
2.2.4 [HMIM]BF4用量的影响
[HMIM]BF4在该氧化脱硫体系中既是萃取剂也是助催化剂,其功能是将DBT从模拟油中萃取到离子液体相中,然后在Bi(NO3)3和[HMIM]BF4的共同催化下氧化成DBTO2。图4显示了[HMIM]BF4用量对DBT模拟油脱硫效果的影响。

图4 氧化脱硫反应中[HMIM]BF4用量对DBT模拟油 脱硫率(η)的影响Fig.4 Effect of [HMIM]BF4 amount in oxidative desulfurization on sulfur removal rate (η) of DBT model oil Reaction conditions: V(Model oil)=5 mL; m(Bi(NO3)3)=0.02 g;V(H2O2)=0.3mL; T=80℃
由图4可知,当[HMIM]BF4用量从0.5 mL增加到1 mL时, DBT模拟油脱硫率明显增加,在180 min的时间内从86.9%上升到99.5%;当[HMIM]BF4用量从1 mL增加到1.5 mL时,脱硫率几乎不变,可知萃取能力已经达到饱和。从经济上考虑,[HMIM]BF4最佳用量为1 mL。
2.3 含有不同硫化合物模拟油的脱硫效果
实际油品中的含硫化合物的种类很多。为此,在最优的实验条件下,分别考察了含有DBT、苯并噻吩(BT)及噻吩(TH)的模拟油的氧化脱硫效果,结果示于图5。从图5看出,含DBT、BT、TH模拟油的脱硫率分别为99.5%、85.6%、58.4%。一般认为,噻吩类硫化物的脱硫效果与分子上硫原子的电子云密度有关。DBT的电子云密度最大(5.758),BT次之(5.739),TH电子云密度最小(5.696)[34-36]。由此可知,该反应体系对于BT和DBT具有较高的脱除效果,对于TH的脱除效果较差。
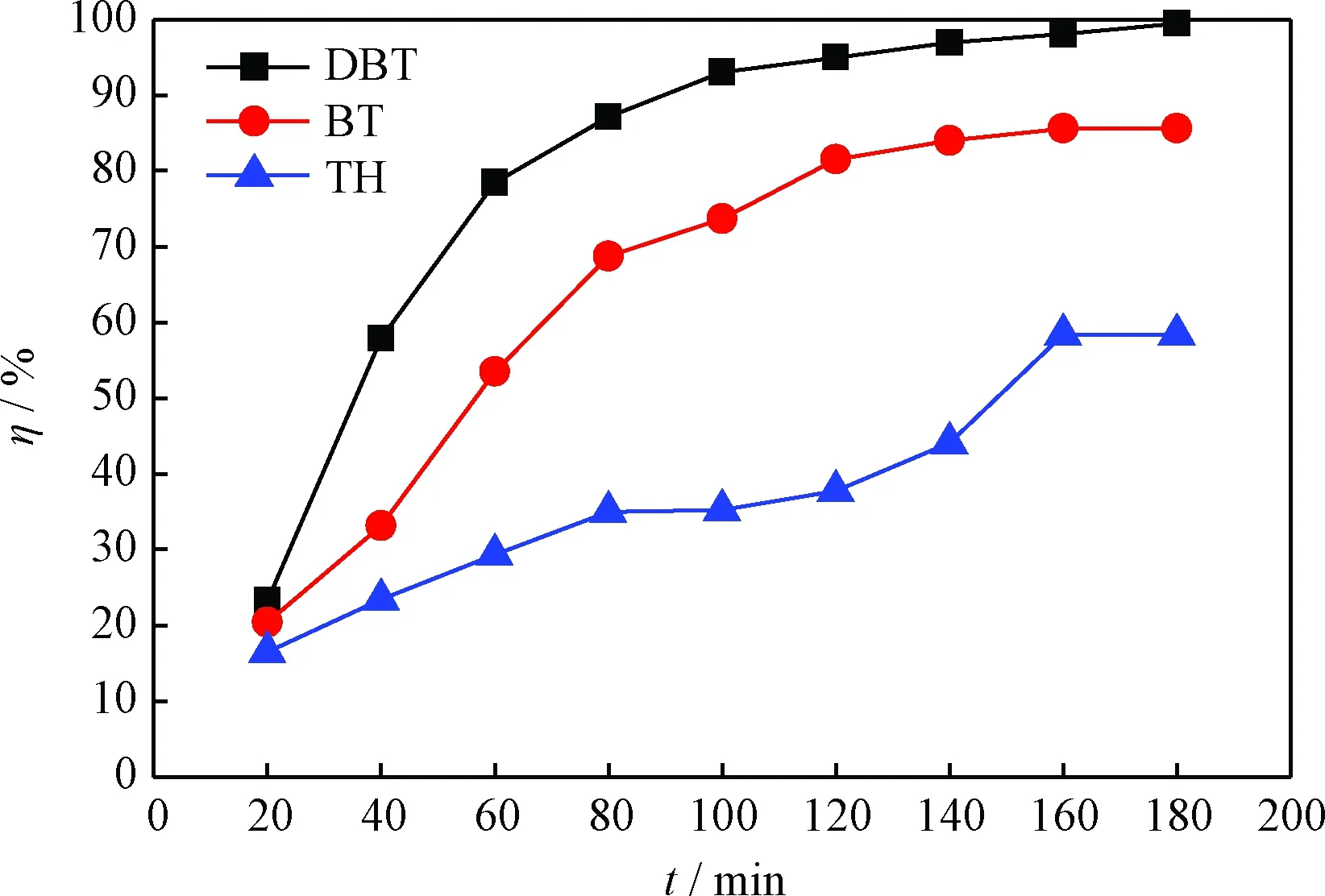
图5 不同硫化物模拟油的氧化脱硫反应脱硫率(η)Fig.5 The sulfur removal rate (η) of the model oils containing different sulfur compounds in oxidative desulfurization Reaction conditions: V(Model oil)=5 mL; V([HMIM]BF4)=1 mL;m(Bi(NO3)3)=0.02 g; V(H2O2)=0.3 mL; T=80℃
2.4 不同硫化物脱除反应动力学
硫化物的氧化脱硫反应速率遵循一级反应动力学方程[37],如式(2)所示。
(2)
式(2)中,k为一级反应动力学常数,min-1;C0、Ct分别为起始和反应时间为t(min)时硫化物的质量分数,μg/g。
以含有不同硫化物的模拟油为脱硫对象,Bi(NO3)3作为催化剂,[HMIM]BF4离子液体作为萃取剂,H2O2作为氧化剂进行氧化脱硫实验,对脱硫过程进行反应动力学分析后可以得到图6。由图6可以得出,DBT的k=0.02614881 min-1,相关系数(R2)=0.99128895;BT的k=0.01409524 min-1,R2=0.96474742;TH的k=0.00030282 min-1,R2=0.92346128;k(DBT)>k(BT)>k(TH),表明DBT相比于BT和TH更易脱除。
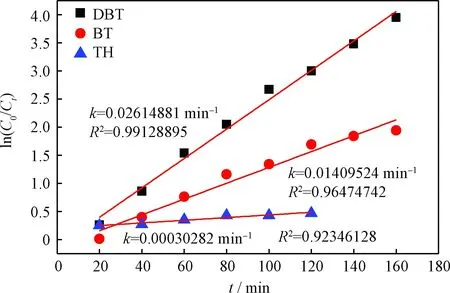
图6 氧化脱硫反应中不同硫化物脱除的动力学分析Fig.6 Kinetic analysis of the sulfur removal for different sulfur compounds in oxidative desulfurization reaction Reaction conditions: V(Model oil)=5 mL; V([HMIM]BF4)=1 mL;m(Bi(NO3)3)=0.02 g; V(H2O2)=0.3 mL; T=80℃, t=180 min
以t为横坐标,ln(1-X)为纵坐标,分别对333、343及353 K下的脱硫率进行线性拟合,结果示于图7。从图7可以得到不同温度下的表观速率常数k,333 K时,k=0.01569167;343 K时,k=0.01848214;353 K时,k=0.02281429。由阿累尼乌斯公式可得lnk=k0-Ea/(RT),以1/(RT)为横坐标,以lnk为纵坐标,用Origin进行线性拟合,其中k0为指前因子,Ea为表观活化能,即可得到Ea=18.3 kJ/mol。

图7 DBT脱除反应动力学活化能Fig.7 Kinetic activation energy of DBT removal reaction(a) Model of the pseudo-first-order reaction;(b) Arrhenius activation energy for DBT removal
2.5 Bi(NO3)3的循环使用性能
为了考察Bi(NO3)3的重复使用性能,在第一次反应结束后,采用倾倒的方法分离出包含Bi(NO3)3的离子液体相,加入水稀释,然后用旋转蒸发仪蒸馏除去水和少量的模拟油,重新加入H2O2,在最佳实验条件下对DBT模拟油进行氧化脱硫,考察Bi(NO3)3的循环使用性能。实验结果示于图8。

图8催化剂Bi(NO3)3在DBT模拟油氧化 脱硫反应中重复使用性能Fig.8 Reusebility of Bi(NO3)3 in oxidative desulfurization of DBT model oil
由图8可以看出,在进行5次回收之后,氧化脱硫率略有下降,这可能是催化剂在再生过程中损失造成的[31]。
2.6 重生催化剂的XRD表征结果
Bi(NO3)3溶解于水或者弱酸性溶液中会生成碱性硝酸铋[38]。将回收脱硫体系中的沉淀物水洗干燥后进行XRD表征,并与新鲜Bi(NO3)3对比,结果示于图9。从图9可见,回收后的Bi(NO3)3催化剂与新鲜Bi(NO3)3相比,峰位发生较大变化。这是因为在氧化脱硫体系中生成了硝酸氧铋(BiONO3)[39]。从催化剂的循环使用性能的考察可以看出,BiONO3的形成未对脱硫效果造成影响。
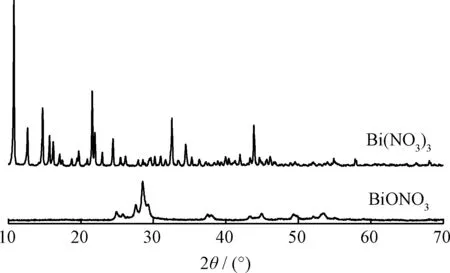
图9 硝酸铋和硝酸氧铋的XRD谱Fig.9 The XRD of Bi(NO3)3 and BiONO3
2.7 氧化脱硫产物红外光谱
氧化脱硫反应结束后,先用分液漏斗将回收液油相除去,剩余的离子液体相在70℃左右减压旋转蒸发,蒸除其中的水分,用等体积CCl4反萃取离子液体相,使用旋转蒸发仪蒸出CCl4,得到白色晶体。分别对DBT和白色晶体进行红外光谱表征,结果示于图10。从图10可见,与DBT相比,回收的白色晶体在1288、757和1166 cm-1有3个红外吸收峰,与标准二苯并噻吩砜红外光谱[40-41]吻合,初步推断此白色晶体即为二苯并噻吩砜。
2.8 [HMIM]BF4-H2O2-Bi(NO3)3脱硫体系的催化氧化脱硫机理
Kuznetsov等[29]认为,在酸性条件下Bi(NO3)3溶解出的Bi3+可以与水形成络合物,其与H2O2经过如图11的所示的过程产生羟基自由基。而羟基自由基具有远大于H2O2的氧化能力。本实验的氧化脱硫体系存在两相,即含有Bi(NO3)3和H2O2的离子液体相和含硫的油相。由于离子液体的萃取作用,DBT进入到离子液体相中,而离子液体中的H2O2与Bi3+作用产生的羟基自由基具有远高于H2O2的氧化能力,可将DBT氧化成相应的二苯并噻吩砜。由于DBT在两相中的浓度差,DBT不断进入离子液体相被氧化,直至达到相平衡,如图12所示。
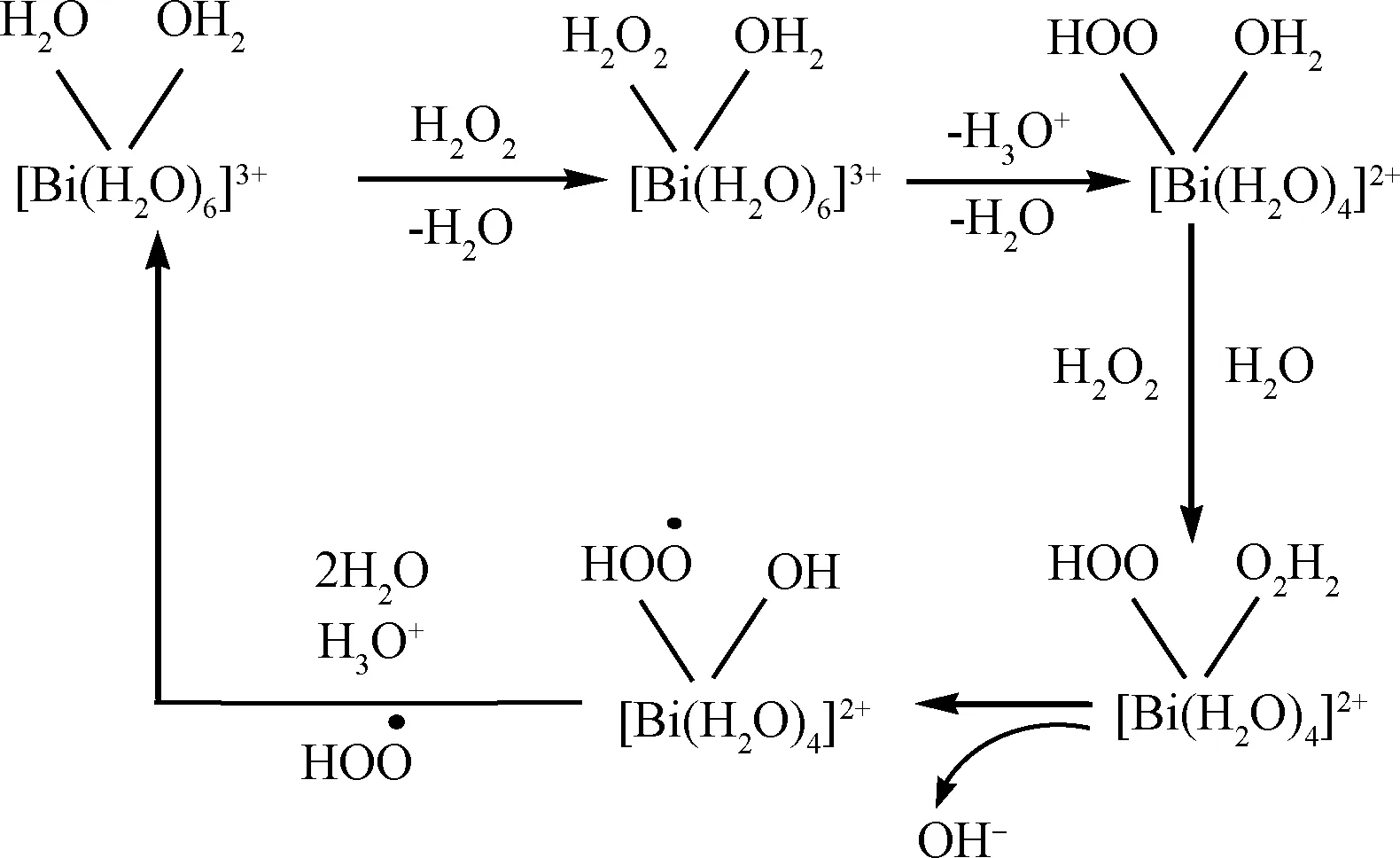
图11 Bi(NO3)3与H2O2作用生成羟基自由基Fig.11 The formation of hydroxyl radical in the system of Bi(NO3)3 and H2O2
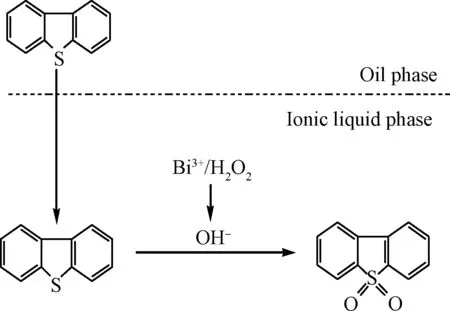
图12 [HMIM]BF4-H2O2-Bi(NO3)3体系对 DBT的氧化脱硫机理示意Fig.12 Schematic of oxidative desulfurization mechanism of DBT by [HMIM]BF4-H2O2-Bi(NO3)3 system
3 结 论
(1)采用商业硝酸铋作为氧化脱硫的催化剂,在1-甲基咪唑四氟硼酸盐离子液体辅助作用下实现了较高的脱硫效率。在模拟油5 mL、硝酸铋0.02 g、1-甲基咪唑四氟硼酸盐离子液体1 mL、H2O20.3 mL、反应温度80℃、反应时间180 min的最优条件下,DBT模拟油的脱硫率达到99.5%。
(2)催化剂可以重复使用5次仍具有较高的脱硫效果。
(3)铋盐在H2O2的作用下生成的羟基自由基是将二苯并噻吩氧化成相应砜的关键。
[1] RIBEIRO S O, JULIAO D, CUNHA-SILVA L, et al. Catalytic oxidative/extractive desulfurization of model and untreated diesel using hybrid based zinc-substituted polyoxometalates[J].Fuel, 2016, 166: 268-275.
[2] STANISLAUS A, MARAFI A, RANA M S. Recent advances in the science and technology of ultra low sulfurdiesel (ULSD) production[J].Catalysis Today, 2010, 153(1): 1-68.
[3] CAMPOS-MARTIN J M, CAPEL-SANCHEZ M C, FIERRO J L G. Highly efficient deep desulfurization of fuels by chemical oxidation[J].Green Chemistry, 2004, 6(11): 557-562.
[4] LÜ H, GAO J, JIANG Z, et al. Oxidative desulfurization of dibenzothiophene with molecular oxygen using emulsion catalysis[J].Chemical Communications, 2007, (2): 150-152.
[5] LEWANDOWSKI M. Hydrotreating activity of bulk NiB alloy in model reaction of hydrodesulfurization 4,6-dimethyl dibenzothiophene[J].Applied Catalysis B: Environmental, 2014, 160: 10-21.
[6] WANG Z, CHEN S L, PEI J, et al. Insight into the intraparticle diffusion of residue oil components in catalysts during hydrodesulfurization reaction[J].AIChE Journal, 2014, 60(9): 3267-3275.
[7] WU P, ZHU W, CHAO Y, et al. A template-free solvent-mediated synthesis of high surface area boron nitride nanosheets for aerobic oxidative desulfurization[J].Chemical Communications, 2016, 52(1): 144-147.
[8] LÜ H, GAO J, JIANG Z, et al. Ultra-deep desulfurization of diesel by selective oxidation with [C18H37N(CH3)3]4[H2NaPW10O36] catalyst assembled in emulsion droplets[J].Journal of Catalysis, 2006, 239(2): 369-375.
[9] HASAN Z, JEON J, JHUNG S H. Oxidative desulfurization of benzothiophene and thiophene with WOx/ZrO2catalysts: Effect of calcination temperature of catalysts[J].Journal of Hazardous Materials, 2012, 205: 216-221.
[10] GAO J, CHEN X, REN N, et al. Acylation desulfurization of oil via reactive adsorption[J].AIChE Journal, 2013, 59(8): 2966-2976.
[11] MIAO G, YE F, WU L, et al. Selective adsorption of thiophenic compounds from fuel over TiO2/SiO2under UV-irradiation[J].Journal of Hazardous Materials, 2015, 300: 426-432.
[12] KO N H, LEE J S, HUH E S, et al. Extractive desulfurization using Fe-containing ionic liquids[J].Energy &Fuels, 2008, 22(3): 1687-1690.
[13] KULKARNI P S, AFONSO C A M. Deep desulfurization of diesel fuel using ionic liquids: Current status and future challenges[J].Green Chemistry, 2010, 12(7): 1139-1149.
[14] SOLEIMANI M, BASSI A, MARGARITIS A. Biodesulfurization of refractory organic sulfur compounds infossil fuels[J].Biotechnology Advances, 2007, 25(6): 570-596.
[15] BAKAR W A W A, ALI R, KADIR A A A, et al. Effect of transition metal oxides catalysts on oxidative desulfurization of model diesel[J].Fuel Processing Technology, 2012, 101: 78-84.
[16] ZHU W, LI H, JIANG X, et al. Oxidative desulfurization of fuels catalyzed by peroxotungsten and peroxomolybdenum complexes in ionic liquids[J].Energy & Fuels, 2007, 21(5): 2514-2516.
[17] LI H, JIANG X, ZHU W, et al. Deep oxidative desulfurization of fuel oils catalyzed by decatungstates in theionic liquid of [Bmim]PF6[J].Industrial & Engineering Chemistry Research, 2009, 48(19): 9034-9039.
[18] BÖSMANN A, DATSEVICH L, JESS A, et al. Deep desulfurization of diesel fuel by extraction with ionic liquids[J].Chemical Communications, 2001, (23): 2494-2495.
[19] HUANG C, CHEN B, ZHANG J, et al. Desulfurization of gasoline byextraction with new ionic liquids[J].Energy & Fuels, 2004, 18(6): 1862-1864.
[20] ZHANG S, ZHANG Z C. Novel properties of ionic liquids in selective sulfur removal from fuels at room temperature[J].Green Chemistry, 2002, 4(4): 376-379.
[21] ZHANG S, ZHANG Q, ZHANG Z C. Extractive desulfurization and denitrogenation of fuels using ionic liquids[J].Industrial & Engineering Chemistry Research, 2004, 43(2): 614-622.
[22] ZHAO D, WANG J, ZHOU E, et al. Oxidative desulfurization of diesel fuel using a Brønsted acid room temperature ionic liquid in the presence of H2O2[J].Green Chemistry, 2007, 9(11): 1219-1222.
[23] GAO H, GUO C, XING J, et al. Extraction and oxidative desulfurization of diesel fuel catalyzed by a Brønsted acidic ionic liquid at room temperature[J].Green Chemistry, 2010, 12(7): 1220-1224.
[24] ZHANG C, PAN X, WANG F, et al. Extraction-oxidation desulfurization by pyridinium-based task-specific ionic liquids[J].Fuel, 2012, 102: 580-584.
[25] LU L, CHENG S, GAO J, et al. Deep oxidative desulfurization of fuels catalyzed by ionic liquid in the presence of H2O2[J].Energy & fuels, 2007, 21(1): 383-384.
[26] HEKMATSHOAR R, SOURI S, RAHIMIFARD M.Silica gel supported Bi(NO3)3·5H2O: An efficient reagent for oxidation of benzoins under microwave irradiation in solventless system[J].Phosphorus, Sulfur, and Silicon and the Related Elements, 2004, 179(3): 469-471.
[27] KHODAEI M M, MOHAMMADPOOR-BALTORK I, NIKOOFAR K. Bismuth (Ⅲ) nitrate pentahydrate Bi(NO3)3·5H2O: An inexpensive and mild reagent for the efficient and clean oxidation of thiols to disulfides[J].Bulletin-Korean Chemical Society, 2003, 24(7): 885-886.
[28] TYMONKO S A, NATTIER B A, MOHAN R S. Oxidation of benzoins to benzils using bismuth (Ⅲ)nitrate-copper (Ⅱ) acetate[J].Tetrahedron Letters, 1999, 40(43): 7657-7659.
[29] ROCHA B G M, KUZNETSOV M L, KOZLOV Y N, et al. Simple soluble Bi (Ⅲ) salts as efficient catalysts for the oxidation of alkanes with H2O2[J].Catalysis Science & Technology, 2015, 5(4): 2174-2187.
[30] ZHU H P, YANG F, TANG J, et al. Brønsted acidic ionic liquid 1-methylimidazolium tetrafluoroborate: A green catalyst and recyclable medium for esterification[J].Green Chemistry, 2003, 5(1): 38-39.
[31] 苏建勋, 艾东, 赵荣祥, 等. CuWO4/C复合物的制备和其在模拟油氧化脱硫中的应用[J].燃料化学学报, 43(12): 1476-1481. (SU Jianxun, AI Dong, ZHAO Rongxiang, et al.Study of the preparation of CuWO4/C composite and it’s application in oxidative desulfurization of model oil[J].Journal of Fuel Chemistry and Technology, 43(12): 1476-1481.)
[32] ZHANG W, XU K, ZHANG Q, et al. Oxidative desulfurization of dibenzothiophene catalyzed by ionic liquid [BMIM]HSO4[J].Ind Eng Chem Res, 2010, 49(22): 11760-11763.
[33] XUN S, ZHU W, CHANG Y, et al. Synthesis of supported SiW12O40-based ionic liquid catalyst induced solvent-free oxidative deep-desulfurization of fuels[J].Chemical Engineering Journal, 2016, 288: 608-617.
[34] JIANG X, LI H, ZHU W, et al. Deep desulfurization of fuels catalyzed by surfactant-type decatungstates using H2O2as oxidant[J].Fuel, 2009, 88(3): 431-436.
[35] XU J, ZHAO S, CHEN W, et al. Highly efficient extraction and oxidative desulfurization system using Na7H2LaW10O36·32H2O in [BMIM]BF4at room temperature[J].Chemistry-A European Journal, 2012, 18(15): 4775-4781.
[36] TRAKARNPRUK W, RUJIRAWORAWUT K. Oxidative desulfurization of gas oil by polyoxometalates catalysts[J].Fuel Processing Technology, 2009, 90(3): 411-414.
[37] LI F, KOU C, SUN Z, et al. Deep extractive and oxidative desulfurization of dibenzothiophene with C5H9NO·SnCl2coordinated ionic liquid[J].Journal of Hazardous Materials, 2012, 205: 164-170.
[38] ZHANG A, ZHANG J, CUI N, et al. Effects of pH on hydrothermal synthesis and characterization of visible-light-driven BiVO4photocatalyst[J].Journal of Molecular Catalysis A: Chemical, 2009, 304(1): 28-32.
[39] EBERL J, KISCH H. Visible light photo-oxidations in the presence ofα-Bi2O3[J].Photochemical & Photobiological Sciences, 2008, 7(11): 1400-1406.
[40] YAN X M, MEI P, XIONG L, et al. Mesoporous titania-silica-polyoxometalate nanocomposite materials for catalytic oxidation desulfurization of fuel oil[J].Catalysis Science & Technology, 2013, 3(8): 1985-1992.
[41] ZHANG M, ZHU W, XUN S, et al. Deep oxidative desulfurization of dibenzothiophene with POM-based hybrid materials in ionic liquids[J].Chemical Engineering Journal, 2013, 220: 328-336.
Bismuth Nitrate as a Catalyst for Oxidative Desulfurization ofDibenzothiophene in Model Oil
MAO Chunfeng1, ZHAO Rongxiang1, LI Xiuping2
(1.CollegeofPetrochemicalEngineering,LiaoningUniversityofPetroleum&ChemicalTechnology,Fushun113001,China;2.CollegeofChemistry&MaterialScienceEngineering,LiaoningUniversityofPetroleum&ChemicalTechnology,Fushun113001,China)
The removal of dibenzothiophene(DBT) in model oil was carried out with bismuth nitrate (Bi(NO3)3) as catalyst, 1-methylimidazolium tetrafluoroborate ionic liquid ([HMIM]BF4) as extractant and co-catalyst, H2O2as oxidation agent. The effects of reaction temperature, the amount of H2O2, catalyst dosage, ionic liquid dosage on the desulfurization rate were investigated. The oxidative desulfurization mechanism of Bi(NO3)3was discussed. The results indicated that the optimal reaction conditions were the model oil of 5 mL, Bi(NO3)3of 0.02 g, [HMIM]BF4of 1.0 mL, H2O2of 0.3 mL, reaction temperature of 80℃and reaction time of 180 min, under which the removal rate of DBT reached 99.5%. The Bi(NO3)3can be reused for 5 times without significant decrease in activity.
bismuth nitrate; oxidative desulfurization;ionic liquid; dibenzothiophene(DBT)
2016-04-13
毛春峰,男,硕士研究生,从事清洁燃料生产研究;E-mail:maochunfeng555@163.com
赵荣祥,男,副教授,博士,从事油品脱硫及清洁燃料生产研究;Tel:024-56863018;E-mail:zylhzrx@163.com
1001-8719(2017)01-0056-08
TE624
A
10.3969/j.issn.1001-8719.2017.01.008

