超声波法提取脐橙皮中多糖的最佳工艺及其抗氧化性研究
郭秀春,杜建南,徐志远,岳 宁,武鹏伟,康文艺
1.河南大学 中药研究所,河南 开封 475004; 2.开封市保健食品功效成分研究重点实验室,河南 开封 475004
脐橙是世界各国竞相栽培的柑桔良种。脐橙皮富含丰富的色素、果胶、纤维、维生素、橙皮苷、橙皮油、矿物质、糖分等[1]营养物质。尤其是多糖,它是生命代谢不可或缺的物质。但是,目前国内外对脐橙皮的研究多针对黄酮类化合物[2]、色素[3]、果胶[4]、橙皮苷[5]等,而对其中多糖的研究甚少。国内外大量的研究证明,多糖具有很多生理活性,如抗肿瘤、抗病毒、降血糖、抗炎、抗补体、抗氧化性、减缓血液凝固等[6-7]。
目前,多糖的提取方法可分为三大类[8-9]:溶剂浸提法,仪器辅助提取法,酶提取法。溶剂浸提法有水提取、碱提取、酸提取;仪器辅助提取法有微波辅助提取、超声波辅助提取、超高压辅助提取。溶剂提取法作为常用的提取法,具有成本较低、易于操作等优点,但是运用此法提取效率不能得到很好的保证,提取效率低且耗时[10]。酶提取法条件温和,杂质易除,不过酶的种类较多[11],故实验中不宜确定最适合的酶,且部分酶价格比较昂贵。仪器辅助提取法中的超声波辅助提取法虽然可能会影响多糖的活性,但是这种方法可以大大缩短提取时间,成本较低,工艺简便,投资少,对环境无污染,安全无毒,可用于对热敏物质的提取,且提取效率高[12]。本实验利用超声波法提取脐橙皮中的多糖,以苯酚-硫酸法测定多糖的含量并计算出提取率,研究其抗氧化性,并用气相色谱法分析多糖组成。
1 材料与仪器
1.1 材料与试剂
脐橙皮,无水葡萄糖(分析纯),浓硫酸(分析纯),三氯甲烷(分析纯),正丁醇(分析纯),乙醇(分析纯),甲醇(色谱纯,天津基准化学试剂有限公司)、DPPH(日本东京化成工业株式会社),纯水,ABTS(美国Fluka公司),BHA(比利时Acros organics公司),BHT(比利时Acros organics公司),过硫酸钾,盐酸羟胺、三氟乙酸(优级纯,Merck公司),吡啶(分析纯,天津大茂化学试剂厂),醋酸酐。标准单糖:L-鼠李糖,L-阿拉伯糖,D-木糖,D-甘露糖,D-葡萄糖,D-半乳糖,D-果糖(Dr.Ehrenstorfer GmbH公司)。苯酚溶液:称取苯酚5 g,将其放入50~60 ℃的水浴中融化,然后加入95 mL蒸馏水溶解,置于棕色瓶内放入冰箱备用。
1.2 仪器与设备
400Y粉碎机,索式抽提器,真空泵,超声清洗仪(宁波新芝生物科技股份公司),ZDHW电热套,电子天平(美国Mettler-Toledo),旋转蒸发仪(德国Heidolph公司),混旋仪,TRACE1310气相色谱仪(美国Thermo公司),Multiskan MK3酶标仪(美国Thermo Electron公司),LL-1500型冷冻干燥仪(Thermo),电热恒温鼓风干燥箱(上海一恒仪器有限公司),数显恒温水浴锅(常州翔天实验仪器厂),DY-3型安瓿瓶熔封机,AB135-S型十万级电子天平(梅特勒-托利多仪器有限公司,瑞士)。
2 方法
2.1 材料处理
将脐橙皮烘干后,用粉碎机粉碎,得脐橙皮粉末。将脐橙皮粉末颗粒用纱布包好,置于索式抽提器中,加入适量乙醇回流2 h脱脂,重复脱脂2次,40 ℃烘箱中烘至恒重,得到去除油脂和色素的脐橙皮干粉,备用。
2.2 多糖含量的测定
采用苯酚-硫酸法测定总的粗多糖含量[13],以葡萄糖做标准品。
2.2.1 标准曲线的制备 参考文献[14]的方法,稍作改动。准确称取105 ℃下干燥至恒重的葡萄糖标准品0.100 0 g,加适量蒸馏水溶解转移至100 mL容量瓶中,加蒸馏水至刻度线摇匀,制得质量浓度为1 mg·mL-1的葡萄糖标准储备液。精密量取质量浓度为1 mg·mL-1的标准储备液0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mL,分别置于50 mL容量瓶中定容,摇匀,备用。
取不同稀释液各200 μL于比色管中,先加入200 μL苯酚溶液摇匀,迅速加入1 000 μL浓硫酸,摇匀,将其在室温下静置30 min,冷却。另取200 μL蒸馏水,同法配成空白溶液,作对照。用酶标仪于波长490 nm处测定吸光度,以吸光度为纵坐标,葡萄糖标准溶液质量浓度为横坐标绘制曲线,并计算出线性回归方程。
2.2.2 脐橙皮多糖的提取工艺 准确称取1.000 g预处理后的原料,用水做溶剂,以一定液料比,在一定超声功率、超声时间以及超声温度的作用下提取多糖,减压抽滤,抽滤后合并滤液,弃去滤渣。取合并后的滤液,加入其3倍体积的乙醇进行沉淀,多糖呈絮状沉淀析出,将其置于4 ℃冰箱中静置过夜后,以4 000 r·min-1离心5 min得多糖沉淀。取沉淀的全部多糖用蒸馏水复溶至100 mL,将全部的水复溶溶液转移至分液漏斗中,按提取液的1/5量加入sevage试剂[15],振摇,静置至分层,去除交界处的变性蛋白和下层有机相,保留上层水相,重复操作三次,收集上清液以4 000 r·min-1离心5 min,合并上清液,即得到脱蛋白的粗多糖溶液。
脐橙皮多糖提取率的测定:
粗多糖提取率=C×V×N×10-3/M×100%。
式中,C为粗多糖溶液的浓度(mg·mL-1),V为多糖定容的体积(50mL),N为稀释倍数,M为脐橙皮粉末的质量(g)
2.3 脐橙皮多糖抗氧化性的评价
2.3.1 脐橙皮多糖对DPPH自由基清除率的分析参照文献[16],略作改动。采用梯度稀释法将样品配成一系列不同的浓度,取10μL样品加入175μLDPPH(200μmol·L-1)的甲醇溶液,混合,37 ℃避光反应30min后,酶标仪515nm处测其OD值。每份样品重复操作3次。
按公式计算:清除率=[1-(OD1-OD2)/(OD3-OD4)]×100%。(1)
式中,OD1为10μL样品与175μLDPPH甲醇溶液混合后的吸光度值,OD2为10μL样品与175μL甲醇溶液混合后的吸光度值,OD3为10μL纯水与175μLDPPH甲醇溶液混合后的吸光度值,OD4为10μL纯水与175μL甲醇溶液混合后的吸光度值。
2.3.2 脐橙皮多糖对ABTS自由基清除率的分析参考文献[17],将样品配成一系列浓度,精密称取13.40mgABTS、3.30mg过硫酸钾,分别加入3.5mL水、5.0mL水,两者混合后常温下暗处放置12h以上。取混合溶液1mL,用约50mL甲醇溶液稀释,使其在734nm处的吸光度值在0.7~0.8之间,即配成ABTS工作液。设样品组、样品对照组、对照组、空白对照组。样品组:10μL样品加200μLABTS工作液;样品对照组:10μL样品加200μL甲醇溶液;对照组:10μL纯水加200μLABTS工作液;空白对照组:10μL纯水加200μL甲醇溶液。各组重复3次,振荡混合,37 ℃暗处反应30min,波长405nm处测定OD值。清除率按公式(1)计算。
2.4 气相色谱法分析脐橙皮多糖的主要单糖组成
2.4.1 标准单糖的衍生化 精密称取标准单糖10.00mg,置于尖底烧瓶中,依次加入盐酸羟胺10.00mg、吡啶0.5mL,振荡摇匀,放入90 ℃水浴中加热反应30min,取出自然冷却至室温,加入0.5mL醋酸酐,90 ℃水浴继续反应30min进行乙酰化,反应产物经0.22μm滤膜过滤,得到标准储备液;用相同的方法制备混合标准单糖储备液。
2.4.2 样品多糖的水解 精密称取样品10.00mg置于EP管中,加入1mL4mol·L-1的三氟乙酸,混旋溶解,转至5mL安瓿瓶,充氮气封管。置于110 ℃的恒温箱中水解12h后取出,旋转蒸发除去三氟乙酸溶液,加入少量甲醇溶解,再旋转蒸发至干燥,如此重复多次,直至三氟乙酸除净,得到水解物备用。
2.4.3 单糖的衍生化 取样品多糖的水解物,进行衍生化,方法同标准单糖衍生化一样,最终得到供试品溶液。
2.4.4 气相色谱条件 色谱柱:ThermeTG-Waxms(30m×0.32mm,0.5μm);进样口温度:250 ℃;FID检测器温度:280 ℃;色谱柱程序升温:初始温度100 ℃保持1min,然后以4 ℃·min-1的速率由100 ℃升到230 ℃,保持10min;载气:高纯N2,流速为2mL·min-1;进样量:2μL。
3 结果与分析
3.1 标准曲线的绘制
以葡萄糖为标准品绘制的标准曲线的线性回归方程为Y=6.4881x-0.0084,相关系数r=0.997 4。结果表明葡萄糖质量浓度在0.01~0.12mg·mL-1范围内与吸光度线性关系良好,结果如图1所示。
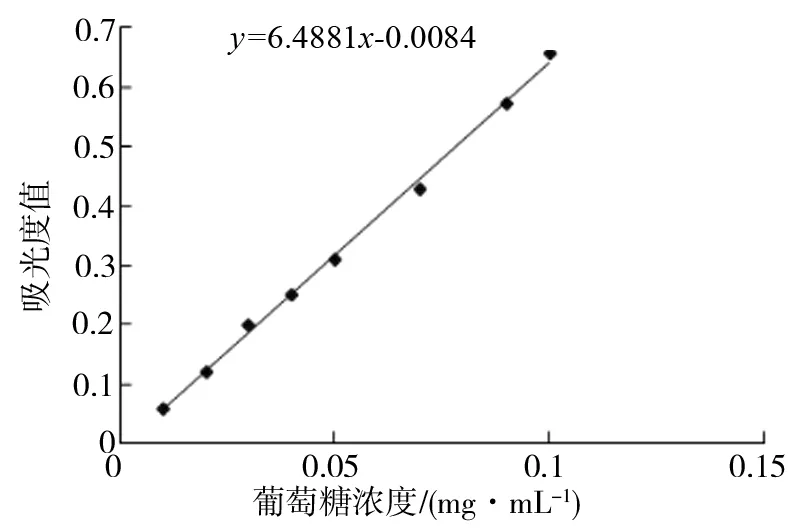
图1 葡萄糖标准曲线
3.2 单因素实验及其分析
3.2.1 料液比对脐橙皮多糖提取率的影响 料液比分别为1∶20、1∶30、1∶40、1∶50和1∶60g·mL-1,超声功率200W,时间30min,温度30 ℃,探究料液比对多糖提取率的影响,结果如图2所示。
根据图2可知,在一定范围内多糖的提取率随加水量的增加而增大,当液料比达到1∶30g·mL-1后,提取率随加水量的增加而呈缓慢降低的趋势。出现此情况的可能原因是,对于一定量的脐橙皮粉末,在一定范围内,当水增加时,其与水的接触面积增加,有利于多糖溶出。当水量过多时,水会吸收超声波的辐射,从而使细胞破壁作用降低,多糖提取率趋于缓慢[18]。料液比选择1∶30g·mL-1为宜。3.2.2 超声时间对脐橙皮多糖提取率的影响 超声时间分别为20、30 、40 、50和60min,料液比1∶30g·mL-1,超声功率200W,超声温度30 ℃,探究超声时间对多糖提取率的影响,结果如图3所示。
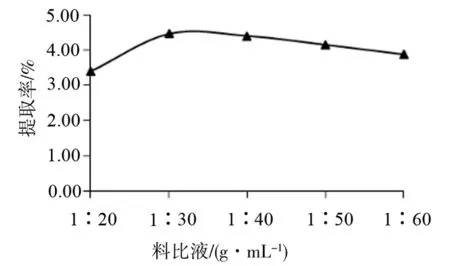
图2 料液比对多糖提取率的影响
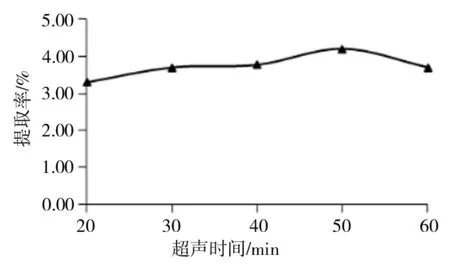
图3 超声时间对多糖提取率的影响
从图3可以看出,在一定范围内,多糖的提取率随着超声时间的增加呈缓慢上升的趋势,超声时间为50min时,提取率达到最大,之后提取率随时间的增加明显降低。出现此情况的原因可能是,超声波具有较强的机械剪切作用,当超声时间过长时,大分子多糖的糖苷键被破坏,从而导致多糖提取量下降[19]。因此,超声时间选择50min为宜。
3.2.3 超声温度对脐橙皮多糖提取率的影响
超声温度分别为20、30 、40、50和60 ℃,料液比1∶30g·mL-1,超声功率200W,超声时间50min,探究超声温度对多糖提取率的影响,结果如图4所示。

图4 超声温度对多糖提取率的影响
由图4可以看出,在一定范围内,多糖的提取率随着提取温度的增加而持续升高,20~40 ℃之间升高程度不明显,而40~60 ℃之间有明显的上升。出现此情况的可能原因是当温度过低时,多糖不能充分溶解,提取率较低;当温度过高时,多糖会分解,提取率趋于平缓。根据表中曲线的趋势推测随着温度的增加多糖的提取率也会有一定程度的升高,但考虑到仪器的承受能力以及客观的现实耗能情况等,超声温度选择60 ℃为宜。
3.3 最佳条件的平均提取率
精确称取1g脐橙皮粉末3份,在料液比1∶30g·mL-1、超声时间50min、超声温度60 ℃的条件下提取多糖,计算平均提取率,结果如表1所示。从表1可知,多糖的平均提取率为5.013 %,相对标准偏差为1.71 %,则该条件下提取率较稳定。
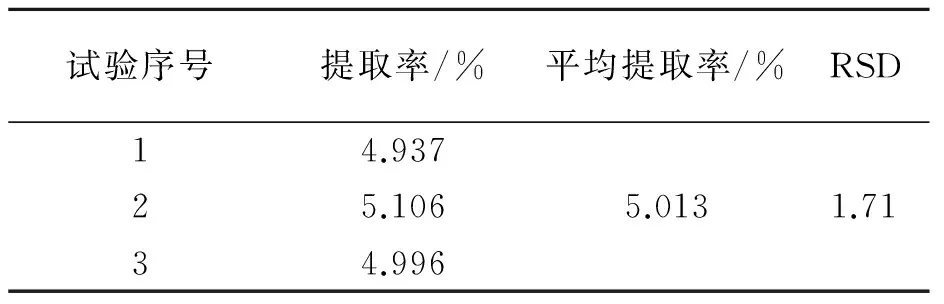
表1 平均提取率
3.4 脐橙皮多糖抗氧化性的评价
按照2.3的方法进行试验,结果如表2所示。由表2可知,随着多糖质量浓度的增大,其对DPPH自由基的清除率就越大,当多糖浓度为25mg·mL-1时,清除率超过50 %,IC50为20mg·mL-1;由表2可知,随着多糖质量浓度的增大,其对ABTS自由基的清除率就越大,当多糖浓度为2.5mg·mL-1时,清除率超过50 %,IC50为2.0mg·mL-1。由此表明清除率与多糖的质量浓度存在一定的量效关系,脐橙皮多糖具有良好的抗氧化性。
3.5 气相色谱法分析脐橙皮多糖的主要单糖组成
3.5.1标准单糖检测 按照2.4.1的方法制备混合标准单糖储备液后,再按照2.4.4的方法用气相色谱法分析混合标准单糖储备液,结果如图5所示。

1.果糖;2.鼠李糖;3.阿拉伯糖;4.木糖;5.甘露糖;6.葡萄糖;7.半乳糖图5 混合标准单糖的气相色谱图
3.5.2 脐橙皮多糖的单糖分析 按照2.4的方法对脐橙皮多糖处理后,用气相色谱法分析多糖的主要单糖组成,结果如图6所示。根据样品各色谱峰与
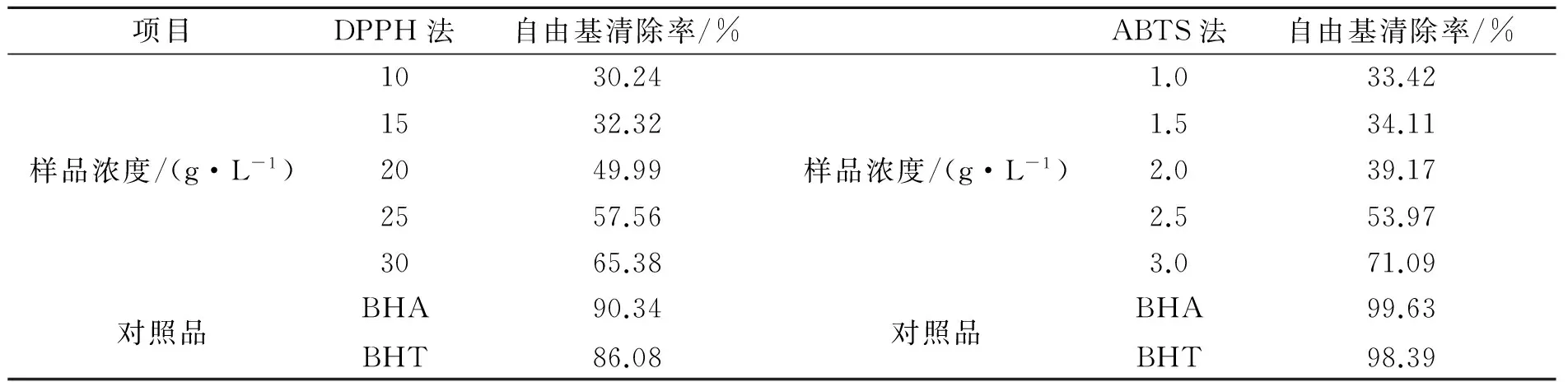
表2 脐橙皮多糖抗氧化性结果
标准品色谱峰的对照,可以确定脐橙皮多糖的主要单糖组成为果糖、鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖,保留时间分别为17.006、17.388、17.775、22.645、23.078、23.715min。
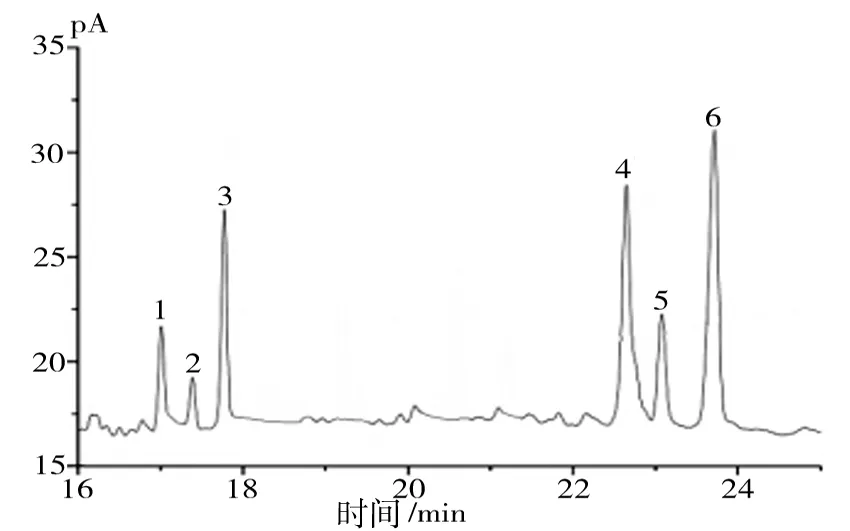
图6 脐橙皮多糖分析的气相色谱图
4 讨论
超声波法提取多糖是利用了超声波的高频振荡的空化作用,机械剪切作用和热力学作用,相比于其他提取方法,超声波法具有省时快速,提取率高,操作简便等优点;单因素试验结果表明,脐橙皮多糖提取的最佳工艺参数为料液比1∶30 (g·mL-1)、超声时间50min、超声温度60 ℃。在此工艺条件下进行试验验证,测得脐橙皮多糖的平均提取率为5.013%,重现性良好,可用于脐橙皮多糖的提取和含量的测定。
脐橙皮多糖的抗氧化性研究结果表明,在一定范围内,随脐橙皮多糖质量浓度的增大,其对DPPH自由基和ABTS自由基的清除率越大,说明脐橙皮多糖具有抗氧化性。
[1] 汪葵,叶晓燕.脐橙皮再利用研究[J].天津化工,2007,21(4):40-42.
[2] 蔡定建,谢志鹏,罗六保,等.脐橙皮中黄酮类化合物与果胶的分离和提取研究[J].分析测试技术与仪器,2006,12(4):239-242.
[3] 李志洲.脐橙皮色素的提取及稳定性研究[J].宝鸡文理学院学报,2003,23(4):276-278.
[4] 魏秋红,贾娟,李轲.超声波辅助提取脐橙皮果胶的研究[J].食品与发酵科技,2003,49(2):63-65.
[5] 黄利华.脐橙皮渣中橙皮苷的超声波辅助提取工艺研究[J].广州城市职业学院学报,2011(2):63-65.
[6]YangXiao-ming,YuWei,OuZhong-ping,etal.AntioxidantandImmunityActivityofWaterExtractandCrudePolysaccharidefromFicuscaricaL.Fruit[J].PlantFoodsforHumanNutrition, 2009,64 (2):167-173.
[7] 方积年,丁侃.天然药物—多糖的主要生物活性及分离纯化方法[J].中国天然药物,2007,5(5):338-347.
[8] 常双艳,兰炎阳,王少峰.多糖提取纯化方法及其生物活性研究进展[J].福建热作科技,2013,38(4):34-38.
[9] 鲁瑞娟.植物多糖的提取和分析方法[J].天津药学,2015,27(2):67-69.
[10] 张燕,张树淼,王飞,等.近年来植物多糖提取方法研究进展[J].农产品加工,2015,(6):65-72.
[11] 魏俊青,刘晓娟,肖春玲.酶解法提取紫玉米多糖技术的研究[J].食品工业科技,2012,33(23):188-191.
[12] 岳贤田.超声波辅助提取桔子皮中多糖的研究[J]. 中国农机化,2011(6):131-133.
[13] 赵宁,问亚琴,潘秋红.苯酚-硫酸法测定干红葡萄酒中的多糖含量[J].中外葡萄与葡萄酒,2011(5):9-17.
[14] 张勇,周丽明,黄章平.比清除率衡量Sevage法脱茶籽多糖蛋白的效果[J].南方农业学报,2016(1):107-111.
[15] 孙希云,刘宁,孟宪军,等.蓝莓多糖超声波提取及脱蛋白方法[J].食品科学,2010(22):134-138.
[16] 孔祥密,张伟,李昌勤,等.垂丝海棠抗氧化活性的研究[J].天然产物研究与开发,2013,(12):1748-1751.
[17] 李华,李勇,吴莹,等.ABTS(·+)法测定葡萄酒抗氧化活性的研究[J].西北农林科技大学学报(自然科学版),2009(11):90-96.
[18] 吕浩铭,黎艳玲,杨华武,等.超声辅助提取雪梨多糖及其在卷烟中的应用[J].精细化工,2016(2):142-146.
[19] 骆文灿.超声波辅助提取长梗黄精多糖工艺的研究[J].福建农业学报,2016(4):431-436.

