奶牛隐性乳房炎的诊治及主要病原菌的药敏试验
王楠楠 , 梁 晓 , 濮思源 , 张启迪
(青岛农业大学动物医学院 , 山东 青岛 266109)
奶牛乳房炎是乳腺受到物理、化学、微生物等病原因子的刺激所致的一种炎症反应。我国奶牛乳房炎的发病率一般在20%~75%,其中临床型乳房炎发病率在9.7%~55.6%,隐性乳房炎发病率却高达20%~40%[1]。乳房炎导致产奶量和奶质量下降,直接给我国的奶牛业、乳制品企业和社会带来了巨大的经济损失。流行病学研究表明,乳房炎在生殖性能上也有负面影响,临床型乳房炎间接损害奶牛的生殖性能,使奶牛空怀天数增加、受胎率下降、早期流产比例增加、不规律的间隔发情[2],由此造成的间接经济损失更是难以估量。当乳汁受到隐性乳房炎致病因子侵害后,乳腺分泌细胞受到破坏,并且乳汁中含有大量的病原微生物及其产生的毒素,人类食用后可引起发烧、呕吐、腹泻、脱水和过敏等症状。
近几年,在政府优惠政策的支持下,奶牛养殖业逐渐迈入产业化发展渠道,生产规模不断扩大。临床型乳房炎得到了很好的控制,而隐性乳房炎对人类经济和健康却带来了挑战。本研究对潍坊某牛场隐性乳房炎进行系统调查,并对病原菌进行分离鉴定和药物敏感性试验,探明乳房炎对药物的耐药状况,采用敏感药物治疗,并提出相应防治措施,对控制奶牛隐性乳房炎提供了相应的技术支持和理论指导。
1 材料与方法
1.1 试剂与培养基 美蓝染液,购自上海纪宁试剂有限公司;AccuMast乳房炎病原菌快速诊断皿,购自美国FERA Animal Health动保公司;药敏纸片,购自杭州天和微生物试剂有限公司;MH培养基和MH肉汤,购自青岛海博生物技术有限公司;胎牛血清,购自北京索莱宝科技有限公司。
1.2 试验动物 潍坊市某奶牛场,规模4 200头奶牛,其中正在泌乳期的奶牛2 000头,后备牛(青年牛、育成牛、犊牛)为2 200头。
1.3 仪器设备 生物洁净工作台:上海博讯实业有限公司医疗设备厂。隔水式电热恒温培养箱、光学显微镜:上海跃进医疗机械厂。
1.4 采样及细菌培养 采样前应对双手进行消毒,佩戴手套,用酒精棉彻底清洁乳头末端和乳头孔处,直至棉球表面没有脏物为止,收集时需先弃掉头几把奶(3~5把);采样时保持采样瓶45°倾斜,乳头不要接触瓶口。若一头奶牛需要多个乳区采样,消毒按照由里往外的顺序消毒,而采样则按照由前往后的顺序;奶样量应为采样瓶的二分之一到三分之二之间。采用显微镜直接体细胞计数法(DMSCC),如每毫升乳汁体细胞数超过 50 万即可认为是隐性乳房炎[3],但是有关的规定和标准却不尽相同,一般在20万~50万以内为安全。将体细胞数超过50万的奶样进行涂AccuMast乳房炎病原菌快速诊断皿,分别用3个无菌棉签对一份奶样在诊断皿的3个区域涂抹。将诊断皿置于恒温培养箱中37 ℃培养18 h,观察记录结果。
1.5 AccuMast乳房炎病原菌快速诊断皿诊断标准 一区革兰阴性菌:蓝色为克雷伯菌,粉色为大肠杆菌,白色菌群但介质变黄为假单胞菌属。二区革兰阳性链球菌属:深蓝色为乳房链球菌,浅蓝色为链球菌属,紫色为肠球菌属,薰衣草色为乳酸乳球菌属。三区革兰阳性葡萄球菌数:白色为葡萄球菌数,粉色为金黄色葡萄球菌,蓝色为溶血葡萄球菌。
1.6 药敏试验 按照美国临床实验室标准委员会(CLSI)2012年推荐的抗微生物药物敏感性试验执行标准进行药敏试验[5]。将链球菌属和克雷伯菌挑取单菌落接种到MH肉汤培养基(链球菌要加入5%血清),取200 μL菌液用涂布器在MH培养基(链球菌要加入5%血清)上涂匀,用镊子放置药敏纸片并轻压,放置10 min。于37 ℃培养箱中倒置培养16 h,记录结果。
1.7 治疗 选择对菌株敏感的药物进行乳头注射治疗。对链球菌属引起的隐性乳房炎乳头注射头孢氨苄和卡那霉素,对克雷伯菌引起的隐性乳房炎乳头注射头孢噻呋,凝固酶阴性葡萄球菌感染的乳房炎先对其进行排空乳区法,进而乳头注射孢氨苄和卡那霉素。其他细菌引起的隐性乳房炎均采用乳头注射头孢氨苄和卡那霉素。在对大肠杆菌感染的乳房炎进行排空乳区法,使其自愈。一个疗程为 4 d,每个疗程统计治愈率,其中在前一个疗程中治愈的,下一个疗程不继续给药,4个疗程无法治愈的定为瞎乳区(乳区完全没奶或豆腐渣样奶或清水奶)。
1.8 奶牛隐性乳房炎治疗后检测方法 治疗结束后,进行CMT试验,检测药物的治愈率。挤奶前用温水清洗治疗后的乳区,弃掉2把乳汁,然后每个乳区取2 mL奶样置于CMT诊断盘中待检测,每2 mL乳汁中加入2 mL的CMT诊断液,充分混合,根据凝集反应判断治愈情况。
1.9 奶牛隐性乳房炎治愈标准[5]。
表1CMT试验的判定标准

判定指标乳汁凝集反应体细胞总数(万/mL)阴性无变化0~20弱阳性部分形成凝胶状40~150阳性全部呈凝胶状,回旋摇动时凝块集中在中央,停止摇动时呈凸凹状附于底部。80~500强阳性全部呈凝胶状并保持原状,并固着于底部。>500
2 结果
奶牛场中泌乳奶牛为2 000头,通过显微镜体细胞直接计数法对2 000头奶牛的每个乳区进行体细胞计数,其中121头奶牛中的253个乳区的体细胞超过50万。奶牛隐性乳房炎发病数为121头, 发病率6.33%,发病乳区数为253。奶牛隐性乳房炎的发生率结果如表2所示。
表2奶牛隐性乳房炎的发生率

检测奶牛/头发病数/头阳性率/%发病乳区20001216.33253
在253例奶样中链球菌属检出率最高为 46.24%,大肠杆菌为32.41%,克雷伯菌为16.60%,金黄色葡萄球菌仅有1例,AccuMast乳房炎病原菌快速诊断皿结果具体见表3。
主要病原菌药敏试验结果见表4。对潍坊某奶牛场中造成奶牛隐性乳房炎的主要细菌链球菌属、克雷伯菌进行药敏试验,结果中显示链球菌属对头孢氨苄、头孢噻呋、卡那霉素敏感,敏感率分别为82.05%、70.08%、67.52%,对氨苄青霉素耐药,耐药率为84.62%;克雷伯菌对头孢噻呋敏感,敏感率为73.81%,对氨苄青霉素、红霉素耐药,耐药率分别为71.43%、61.90%。
表3AccuMast乳房炎病原菌快速诊断皿结果

病菌菌株数菌株比例/%链球菌属11746.24大肠杆菌8232.41克雷伯菌4216.60凝固酶阴性葡萄球菌41.58假单胞菌属20.79肠球菌属20.79乳酸乳球菌属20.79金黄色葡萄球菌10.40其他菌属10.40
对奶牛隐性乳房炎治疗结果如表5所示:对链球菌属治疗1个疗程时治愈率为77.78%,2个疗程时治愈率为88.89%,3个疗程时治愈率为90.60%,4个疗程时治愈率为91.45%;对克雷伯菌治疗1个疗程时治愈率为30.95%,2个疗程时治愈率为38.10%,3个疗程时治愈率为40.48%,4个疗程时治愈率为40.48%;对凝固酶阴性葡萄球菌治疗1个疗程时治愈率为25%,2个疗程时治愈率为50%,3个疗程时治愈率为50%,4个疗程时治愈率为75%;对其他菌属治疗1个疗程时治愈率为57.14%,2个疗程时治愈率为85.71%,3个疗程时治愈率为85.71%,4个疗程时治愈率为85.71%。
表4主要病原菌药敏试验结果
表5药物治疗结果
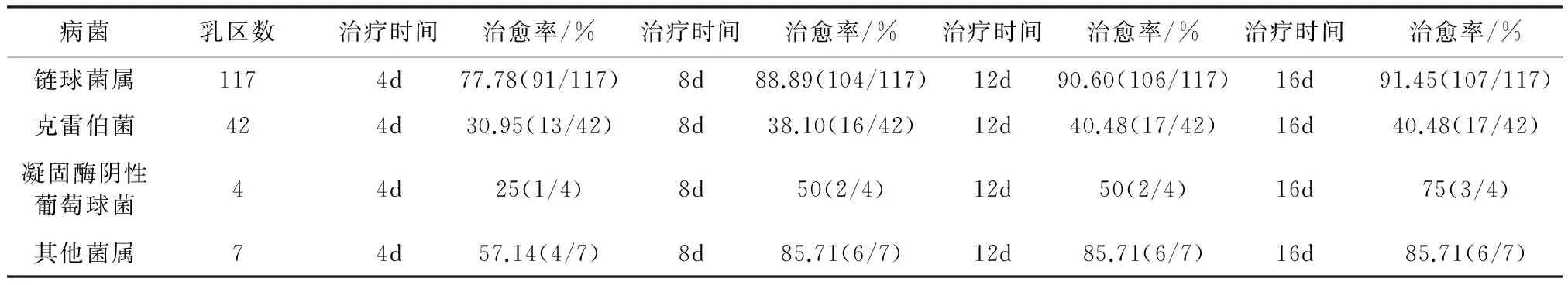
病菌乳区数治疗时间治愈率/%治疗时间治愈率/%治疗时间治愈率/%治疗时间治愈率/%链球菌属1174d77.78(91/117)8d88.89(104/117)12d90.60(106/117)16d91.45(107/117)克雷伯菌424d30.95(13/42)8d38.10(16/42)12d40.48(17/42)16d40.48(17/42)凝固酶阴性葡萄球菌44d25(1/4)8d50(2/4)12d50(2/4)16d75(3/4)其他菌属74d57.14(4/7)8d85.71(6/7)12d85.71(6/7)16d85.71(6/7)
3 讨论
造成潍坊某奶牛场奶牛乳房炎的主要病原菌为链球菌属、 克雷伯菌和大肠杆菌。潍坊某奶牛场中金黄色葡萄球菌感染的奶牛隐性乳房炎仅有一例,在潍坊地区其他奶牛养殖场中由金黄色葡萄球菌感染的奶牛隐性乳房炎却高达10%。大肠杆菌性奶牛乳房炎多见于高产奶牛及产后泌乳高峰时期的奶牛,大肠杆菌主要来源于牛粪及其污染的环境,从损伤的生殖道进入血液或淋巴而引起感染。对于大肠杆菌没有采用抗生素治疗的原因是,大肠杆菌死亡,细胞壁破裂会释放内毒素,细胞内毒素在体内,会诱发其他一系列病理反应。有研究者认为抗生素诱导释放的内毒素不仅是因为抗生素杀灭大肠杆菌后,大肠杆菌壁破裂而释放出来的,可能是细菌在抗生素作用下通过某些机制逐渐释放出来[6]。药敏试验结果显示,链球菌属对头孢噻呋、头孢氨苄、卡那霉素敏感,克雷伯菌对头孢噻呋敏感。由于奶牛场中抗生素的滥用,使得一些病原菌产生耐药性,因而单一药物的治疗很难取得理想效果,在治疗过程中采用联合用药会产生更好的疗效。
临床型乳房炎造成的损失是显而易见的;而隐性乳房炎由于缺乏明显症状,常被人们所忽略。据统计我国奶牛业每年因乳房炎引起的损失达135亿人民币,其中70%的损失是来自隐性乳房炎引起的产奶量降低[7]。根据潍坊某奶牛场的实际情况,按照操作规程使用大小合适的杯组和运行正常的设备进行挤奶操作;挤奶时应佩戴乳胶手套,消毒要及时;潮湿或被粪便污染的垫料应及时清除,保持奶牛饲养环境的干净、干燥;确保日粮中有足量的维生素E和硒;定期进行奶牛隐性乳房炎的检测,并进行合理的药物治疗,可以有效的预防和治疗奶牛乳房炎,降低病情的危害,提高企业经济效益。
[1] 叶倩, 王礼伟, 屈勇刚, 等. 奶牛乳房炎防治的研究进展[J]. 现代畜牧兽医, 2014(11): 56-60.
[2] Hector Nava-Trujillo, Eleazar Soto-Belloso, Armando E. Hoet. Effects of clinical mastitis from calving to first service on reproductive performance in dual-purpose cows[J]. Animal Reproduction Science,2010,121:12-16.
[3] Little R B. Mastitis[M]. New York and London: W. NBorine, 1946.
[4] 高海慧, 任敏, 郭抗抗, 等. 陕西某奶牛场隐性乳房炎病原菌分离鉴定及药敏试验[J]. 动物医学进展, 2014, 35(6):152-156.
[5] 李宏滨. 三个与奶牛乳房炎抗性相关基因的克隆及比较基因组学分析[D]:北京: 中国农业科学院; 2008.
[6] 王丽平, 郭永刚, 史晓丽, 等. 不同抗生素对大肠杆菌形态的影响及其诱导游离内毒素的释放[J]. 中国兽医学报, 2004, 24(6):596-597.
[7] 方必春. 奶牛败血性乳房炎的调查与分析[J]. 畜牧与兽医, 1991, 23(3):123-126.

