2,2-二甲基丁烷+乙醇、+正丙醇二元体系常压汽液平衡的测定
祁灵会,王日杰,杨晓霞
(天津大学化工学院,天津 300072)
异己烷包括 2-甲基戊烷、3-甲基戊烷、2,2-二甲基丁烷和2,3-二甲基丁烷。异己烷是一种非极性溶剂,不溶于水,溶于乙醇、乙醚,还能溶解其他烃类及卤代烃,广泛应用于气雾、涂料、电子行业,主要用做无毒喷雾剂、溶剂、清洗剂等产品。甲基亚膦酸酯是合成非选择性广谱触杀性除草剂草铵膦的中间体。它是由甲基二氯磷与乙醇等低碳醇在缚酸剂存在下合成的。异己烷作为生产过程中溶剂[1],这就带来了异己烷和低碳醇的分离问题,需要知道异己烷和低碳醇的汽液平衡数据。
已经测定的异己烷与低碳醇的汽液平衡数据包括:2-甲基戊烷 +乙醇[2],2-甲基戊烷 +2-丙醇[3];3-甲 基 戊 烷 +乙 醇[4],3-甲 基 戊 烷 +2-丙醇[5]。2,2-二甲基丁烷和低碳醇的二元体系的汽液平衡数据还没有文献报道。为此,本研究测定了常压下 2,2-二甲基丁烷-乙醇和 2,2-二甲基丁烷-正丙醇二元体系的汽液平衡数据;并采用NRTL方程对实验数据进行了关联和估算。
1 实验部分
1.1 实验装置
实验所用的汽液平衡釜是自行设计的汽液双循环装置,如图1所示。
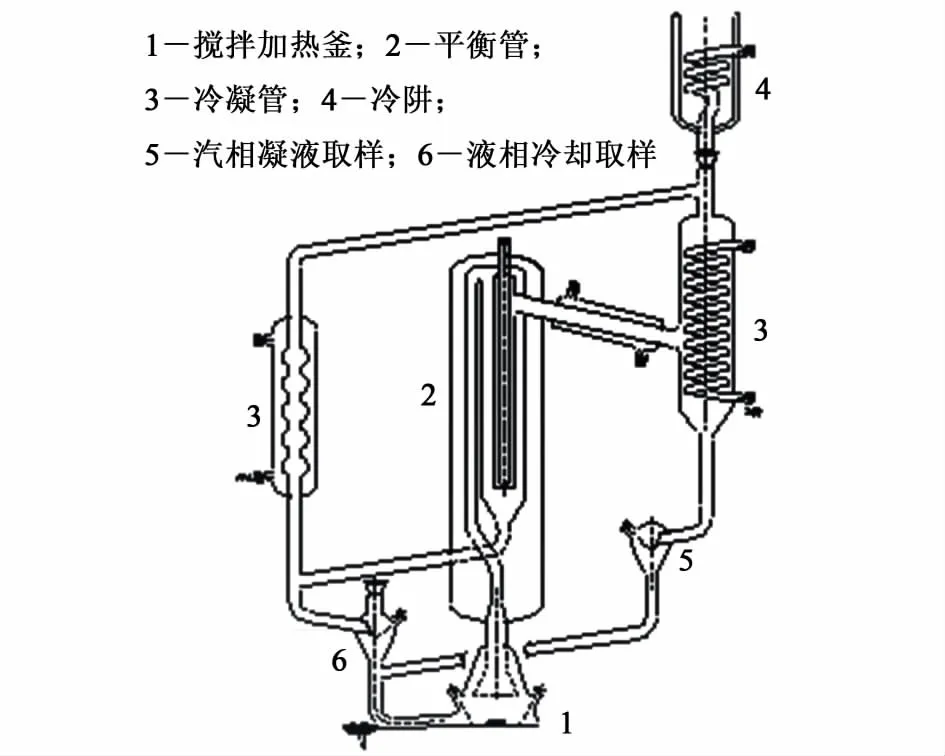
图1 汽液平衡装置示意图Fig.1 The apparatus for m easuring the VLE data
该汽液平衡釜的主要优点包括:釜的主体部分有真空夹套保温层;汽相和液相形成独立的循环系统,不会形成返混,实验结果精确;透明的玻璃材质使得釜内的汽化现象清晰可见;样品用量少,达到平衡速度快,实验时间短。平衡釜的加热搅拌装置为恒温磁力搅拌器(巩义市英峪高科仪器厂,型号为SZCL-4)。平衡温度由已校正的精度为1/10的Pt-100电阻温度计(沈阳市中色测温仪表材料研究所有限公司)测量。
1.2 试剂
无水乙醇和正丙醇,优级纯,天津市光复科技发展有限公司;蒸馏水,天津市南开区永源蒸馏水制造中心;2,2-二甲基丁烷,色谱标准物,天津市津科精细化工研究所;2,2-二甲基丁烷,质量分数99%,Alfa Aesar。
1.3 分析方法
乙醇+水二元体系汽液平衡的汽相和液相的组成采用海能A650全自动折光仪(济南海能仪器有限公司)分析。
2,2-二甲基丁烷 +乙醇(正丙醇)二元体系汽液平衡的汽相和液相的组成采用Agilent 6820气相色谱仪分析,色谱柱为毛细管柱 VF-5 ms(30 m,0.25 mm,0.25 μm),氢焰(FID)检测器,其他色谱条件见表1,采用校正后的面积归一法进行定量。

表1 气相色谱的分析方法Table 1 Analysis conditions of gas chrom atography
1.4 实验方法
首先,在相应的气相色谱条件下分析不同摩尔分数的2,2-二甲基丁烷 +乙醇和 2,2-二甲基丁烷+正丙醇溶液,确定气相色谱的峰面积百分比与摩尔分数之间的关系,得到2种溶液的校正因子。
向汽液平衡釜内加入待测的二元组分混合物料约20 m L,打开冷冻循环液,接通加热搅拌电源,控制加热温度使回流量保持在1~2滴/s,稳定1 h,记录平衡温度;同时分别从汽相和液相取样口用微量注射器取样,采用气相色谱仪分析其组成;用注射器从沸腾室中取出2~3 m L釜液,然后加入同体积的纯的重组分物料,重新建立汽液相平衡。
1.5 实验装置的校验
为了验证该汽液平衡装置的准确性和稳定性,使用该装置测定了乙醇+水二元体系的常压汽液平衡数据,并将实验结果与文献数据[6]比较,将乙醇+水二元体系汽液平衡数据的实验值和文献值做T-x-y图,结果如图2所示。
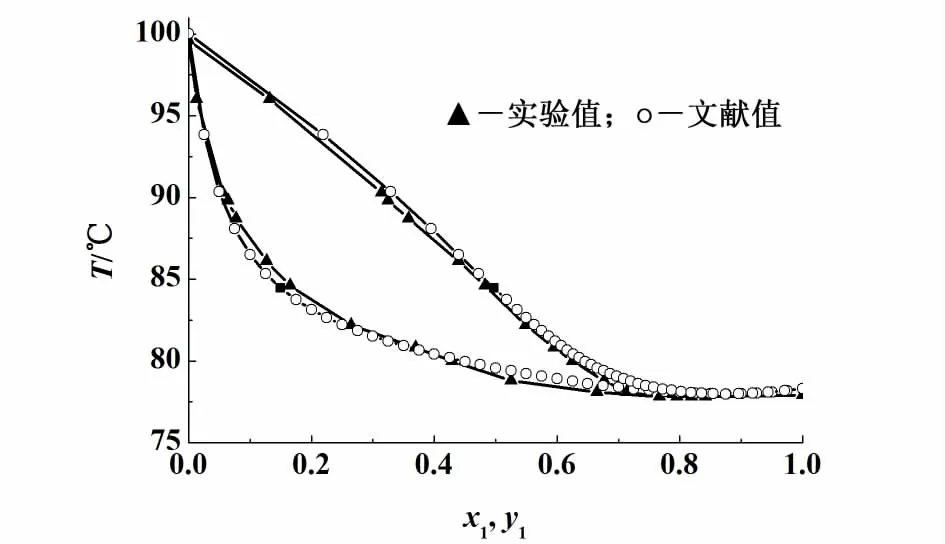
图2 乙醇(1)+水(2)二元体系常压 T-χ-y相图Fig.2 T-χ-y p lot of ethanol(1) +water(2) at at 101.3 kPa
由图2可看出,测得的乙醇+水二元体系在常压下的汽液平衡数据与文献值吻合较好,表明该装置测定汽液平衡数据具有较好的稳定性和可靠性。
2 实验结果与数据处理
2.1 气相色谱的校正因子
气相色谱的校正因子通过公式(1)表示,其中A为气相色谱的峰面积、f为汽相色谱的校正因子、x为摩尔分数,下标1和2表示不同的组元。分析不同摩尔分数的二元体系混合物,以(A1/A2)为横坐标、以(x1/x2)为纵坐标作图,将数据做线性回归得到1条直线,直线的斜率即为(f1/f2)。由公式(2)计算得到组分1的摩尔分数[7]。
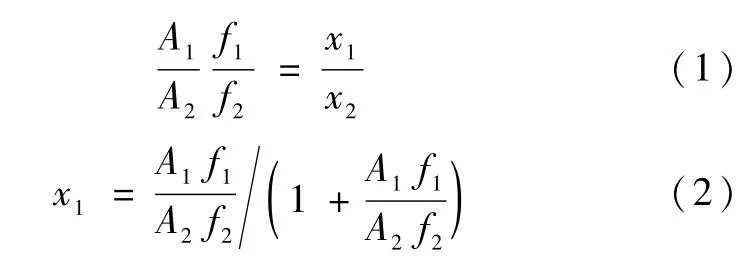
图3 为 2,2-二甲基丁烷(1) +乙醇(2)二元体系校正因子图。图4为2,2-二甲基丁烷(1)+正丙醇(2)二元体系校正因子图。
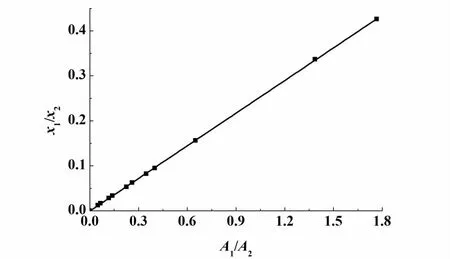
图3 2,2-二甲基丁烷(1)+乙醇(2)二元体系的校正因子Fig.3 The response factors of the binary system s 2,2-dim ethylbutane(1) +ethanol(2)
由图3和图4可以看出,数据的线性关系很好。图3直线的斜率为0.242,即2,2-二甲基丁烷(1)+乙醇(2)二元体系校正因子 (f1/f2) =0.242。图4直线的斜率为0.4862,即2,2-二甲基丁烷(1)+正丙醇(2)二元体系校正因子(f1/f2)=0.4862。
2.2 汽液平衡的测定结果
2,2-二甲基丁烷(1) +乙醇(2)二元体系在常压下的汽液平衡数据的测定结果见表2和图5。当x1=0.8052时,2,2-二甲基丁烷和乙醇形成二元共沸物,共沸点T=45.2℃。
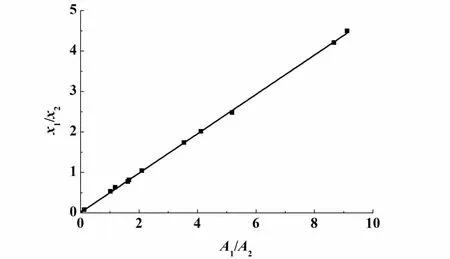
图4 2,2-二甲基丁烷(1)+正丙醇(2)二元体系的校正因子Fig.4 The response factors of the binary system s 2,2-d im ethylbu tane(1) +1-p ropanol(2) at 101.3 kPa

图5 2,2-二甲基丁烷(1)-乙醇(2)二元体系常压 T-χ-y相图Fig.5 T-χ-y p lot of 2,2-d im ethylbutane(1) +ethanol(2)at at 101.3 kPa
2,2-二甲基丁烷(1) +正丙醇(2)二元体系在常压下的汽液平衡数据的测定结果见表3和图6。当x1=0.9218时,2,2-二甲基丁烷和正丙醇形成二元共沸物,共沸点T=49.2℃。
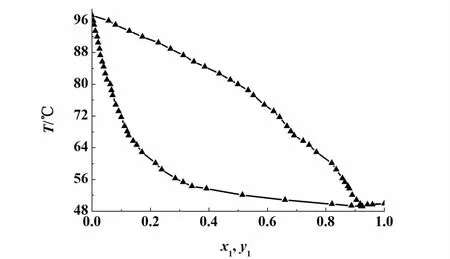
图6 2,2-二甲基丁烷(1)-正丙醇(2)二元体系常压 T-χ-y相图Fig.6 T-χ-y p lot of 2,2-dim ethylbutane(1)+1-p ropanol(2) at at 101.3 kPa
2.3 汽液平衡基本方程
常压下,汽相可以视为理想气体,汽液平衡关系式可以简化为公式(3)。

表2 常压下2,2-二甲基丁烷(1)-乙醇(2)二元体系的汽液平衡数据Table 2 The vapor liquid equilib rium data of 2,2-dim ethylbutane(1) +ethanol(2) binary system at 101.3 kPa

表3 常压下 2,2-二甲基丁烷(1)-正丙醇(2)二元体系的汽液平衡数据Table 3 The vapor liquid equilibrium data of 2,2-dimethylbutane(1) +1-propanol(2) binary system at 1 atm

式(3)中:p为系统压力;yi为组分i的汽相摩尔分数;为纯组分i在平衡温度下的饱和蒸汽压;xi为组分i的液相摩尔分数;γi为组分i液相的活度系数。2,2-二甲基丁烷的由公式(4)所示的 Antoine方程计算[8],乙醇和正丙醇的 psi由公式(5)所示的Antoine方程计算[9]。
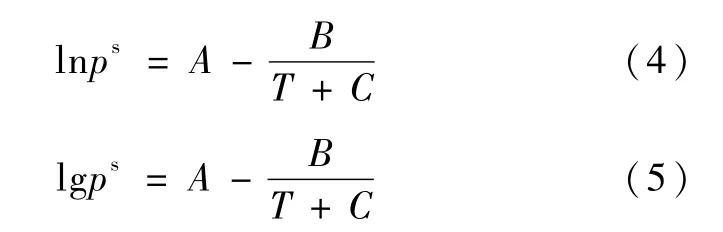
2,2-二甲基丁烷、乙醇和正丙醇的Antoine系数见表4。
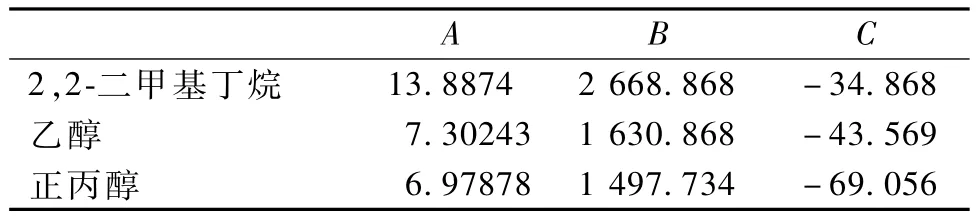
表4 各组元的Antoine系数Table 4 Constants of Antoine equation of the com ponen ts
2.4 热力学一致性检验
采用Herrington等推荐的面积检验法对实验得到的两组二元体系等压汽液平衡T-x-y数据进行热力学一致性检验。计算过程如下:
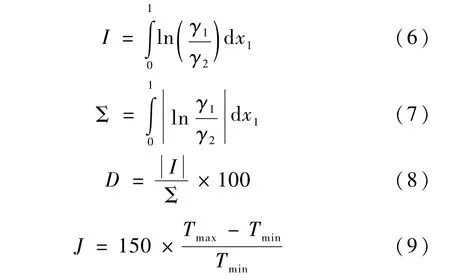
式(6) ~(9)中:γ1、γ2分别为组元 1、组元 2 的液相活度系数;Tmax、Tmin分别为体系的最高、最低沸点。2组二元体系等压汽液平衡数据的热力学一致性检验结果见表5。
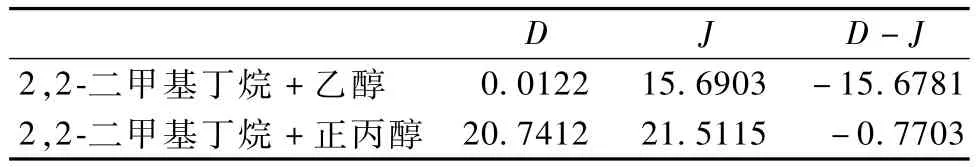
表5 热力学一致性检验结果Table 5 The resu lts of therm odynam ic consistency test
由表5可见,2组二元体系等压汽液平衡数据均满足D-J<10,符合热力学一致性。
2.5 实验数据的关联
NRTL方程[10]的适用范围很广,对于烃、醇、酮、醛、酸及水等的混合物均适用。二元体系的 NRTL活度系数方程为:
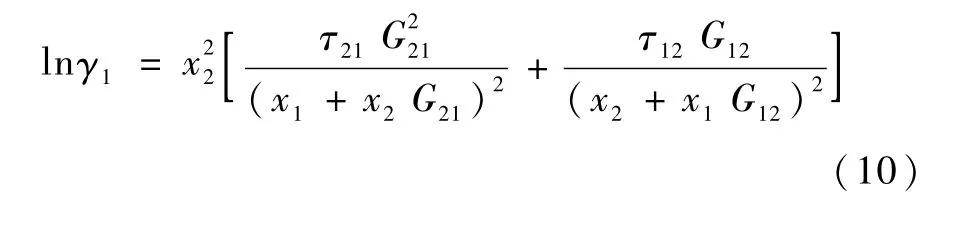

式(10) ~(12)中 G21=exp(-α12τ21),G12=exp(-α12τ12)。α12是组元1 和组元2 之间的参数,称为非随机参数。(g21-g11)/R、(g12-g22)/R和 α12是 NRTL方程参数。
利用Aspen Plus的 Data Regression功能,得到NRTL模型参数如表6所示,并由模型方程计算出每个二元体系的汽相组成 y1,cal,并计算y1的计算值和实验值的偏差,如表2和表3所示。
y1的平均偏差
汽相组成的平均偏差小于0.02,可以看出实验数据和计算数据吻合很好,说明NRTL方程适用于该二元体系。
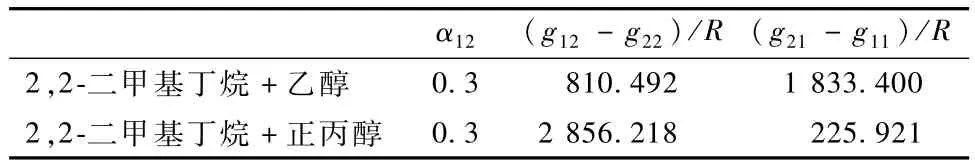
表6 模型参数Table 6 NRTL Model param eters
3 结论
1)实验测定了常压下2,2-二甲基丁烷 +乙醇和2,2-二甲基丁烷 +正丙醇二元体系的汽液平衡数据。并对实验数据进行了Herington面积法检验,结果表明两组数据均符合热力学一致性。
2)对2组常压汽液平衡数据用NRTL方程进行关联,得到了相应的模型参数。利用得到的模型参数计算汽相物质的量组成,实验值与计算值吻合良好,说明NRTL模型适用于所研究的二元体系。
[1] 王宏亮,邵生富,徐芸,等.甲基亚膦酸二乙酯的合成工艺研究[J].精细化工中间体,2005,35(2):54-56 Wang Hongliang,Shao Shengfu,Xu Yun,et al.Studies on the synthetic process of diethyl methyl-phosphonite-intermediate of glufosinate[J].Fine Chemical Intermediates,2005,35(2): 54-56(in Chinese)
[2] Aucejo A,Loras S,Muñoz R,et al.Isobaric vapor-liquid equilibrium for binarymixtures of2-methylpentane+ethanol and+2-methyl-2-propanol[J].Fluid Phase Equilibria,1999,156(1): 173-183
[3] Pokki J P,Uusi-Kyyny P,Aittamaa J,et al.Vapor-Liquid equilibrium for the 2-methylpentane+2-methyl-2-propanol and+2-butanol systems at 329 K[J].Journal of Chemical&Engineering Data,2002,47(2):371-375
[4] Gabaldón C,Martínez-Soria V,Marzal P,et al.Isobaric vapor-liquid equilibria for the binary system 3-methylpentane+ethanol and for the ternary system 2-methyl-2-propanol+ethanol+3-methylpentane at 101.3 kPa[J].Journal of Chem ical&Engineering Data,2000,45(5):882-886
[5] Uusi-Kyyny P,Pokki J P,Aittamaa J,et al.Vapor-Liquid equilibrium for the binary systems of 3-methylpentane+2-methyl-2-propanol at331 K and+2-butanol at 331 K[J].Journal of Chemical&Engineering Data,2001,46(3): 754-758
[6] Gmehling J,Onken U.Vapor-Liquid equilibrium data collection.DECHEMA chemistry data series[J].Frankfurt,1977,1(1): 127-157
[7] Pokki J,Rehak K,Kim Y,et al.Vapor-Liquid equilibrium data at 343 K and excess molar enthalpy data at 298 K for the binary systems of ethanol+2,4,4-trimethyl-1-pentene and 2-propanol+2,4,4-trimethyl-1-pentene[J].Journal of Chemical&Engineering Data,2003,48(1): 75-80
[8] Garriga R,Pérez P,Valero J,et al.Vapour pressures at several temperatures and excess functions of n-butanol with 2,2-dimethylbutane and with 2,3-dimethylbutane at 298.15 K[J].Fluid Phase Equilibria,1994,102(1):85-95
[9] 马沛生,李永红.化工热力学[M].北京:化学工业出版社,2009
[10] Renon H,Prausnitz JM.Local compositions in thermodynamic excess functions for liquid mixtures[J].AIChE Journal,1968,14(1): 135-144

