双眼亲水性丙烯酸酯人工晶状体混浊房水检测和超微结构分析
侯芳,王军
随着社会人口老龄化发展,白内障超声乳化联合人工晶状体植入手术广泛开展。部分患者白内障术后1~2年会出视力逐渐下降,最常见的原因是后囊膜混浊,也可能为人工晶状体前细胞增生,极少见的情况是人工晶状体混浊。2016年11月我院门诊收治了一位双眼人工晶状体混浊患者,进行了双眼人工晶状体置换术,分别做了裂隙灯显微镜、透射电子显微镜和能量色散X射线光谱仪检查,以及血液和房水的检测,现将结果报告如下。
1 资料与方法
1.1 临床资料
眼部检查:双眼裸眼视力0.3,矫正不提高(国际标准视力表),眼压:右眼 23 mm Hg(1 mm Hg=0.133 kPa),左眼25 mm Hg,双眼结膜无充血,角膜透明,前房深,瞳孔圆,直径3 mm,对光反射灵敏,人工晶状体位置正,人工晶状体呈均匀灰白色雾状混浊(图1),右眼底隐见视盘(图2A),视网膜平,左眼底窥不清(图2B)。B超显示双眼玻璃体轻度混浊。双眼视觉对比敏感度下降。患者既往高血压病史10年,糖尿病史3年,冠状动脉粥样硬化性心脏病史2年,脑梗死病史15年,风湿免疫性疾病40年,目前口服激素每日5 mg,及控制血压、血糖、血脂药物,全身情况稳定。为行双眼人工晶状体置换术,以“双眼人工晶状体混浊,双眼底待查”收入院。入院后查血常规、尿常规及肝肾功能基本正常。血钙:2.45 mmol/L,血无机磷 1.21mmol/L,血钾4.04 mmol/L,均在正常范围。动态红细胞沉降率为17 mm/h,高于正常范围(0~15 mm/h)。 类风湿因子 20 IU/mL, 为正常范围(0~20 IU/mL)高限。血清中免疫球蛋白、补体均在正常范围,各种抗体检查均为阴性。药物控制空腹血糖5.49 mmol/L。
治疗经过:表麻下分两次进行右眼和左眼的人工晶状体置换术,植入人工晶状体为德国蔡司公司生产的603P型,一片式后房型亲水性人工晶状体。术后2周眼部检查:右眼0.7,左眼0.6,双眼矫正视力 0.9,眼压:右眼 20 mm Hg,左眼 24 mm Hg,结膜轻度充血,角膜透明,前房深,瞳孔药物性散大,人工晶状体位置正(图3)。眼底:双视盘界清色正,视网膜平,未见明显出血及渗出(图4)。
1.2 检查方法
(1)术前取房水进行离子及炎性因子检测。(2)用FEI Quanta 650 FEG场发射扫描电子显微镜 (美国)对取出的人工晶状体进行观察,能量色散X射线光谱仪(Oxford X-Max 80,英国)分析混浊部分的物质构成。

图1 双眼人工晶体混浊眼术前裂隙灯像。1A.右眼,1B.左眼
图2 图1患眼术前眼底像。2A.右眼,2B.左眼
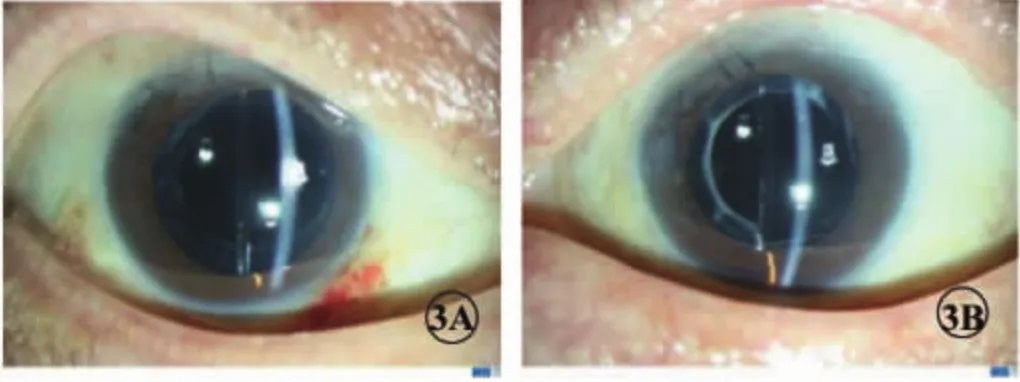
图3 双眼人工晶状体置换术后裂隙灯像。3A.右眼,3B.左眼

图4 图3同时期眼底像。4A.右眼,4B.左眼
2 结果
取出的人工晶状体外观见图4。
房水检测结果:白细胞介素 -6(IL-6)33.9 pg/mL,IL-8 9.3 pg/mL,IL-10 <1.0 pg/mL, 转化 生长因子 -B1(TGF-B1)<1.0 pg/mL,碱性成纤维细胞生长因子(bFGF)<1.0pg/mL,均处于正常范围内;血管内皮生长因子 (VEGF)32.7pg/mL, 接近正常范围 (0~40 pg/mL)高限。钙 1.23mmol/L,磷 0.65mmol/L,与伴糖尿病的白内障患者房水中的钙磷含量基本一致。

图5 取出的混浊人工晶状体。5A.右眼,5B.左眼
扫描电子显微镜检查显示,混浊物附着于人工晶状体光学部表面,形状分别为球形(图6A)、针状(图6C)等不规则的排列紊乱的结晶样小体;能谱吸收峰提示混浊的人工晶状体表面结晶状体内含有钙、硫、氧、钠、碳元素(图6)。切开人工晶状体内部,未见混浊的结晶小体。混浊人工晶状体前表面结晶小体附着密集,而后表面几乎没有混浊物。
理化性质:用1mmol/L的氯化氢溶液浸泡混浊的人工晶状体10min,混浊物溶解消失,人工晶状体恢复透明。
3 讨论
人工晶状体的材质很多,如聚甲基丙烯酸甲酯(PMMA)、水凝胶、硅凝胶、丙烯酸酯等,随着白内障手术的广泛开展,人工晶状体在眼内的生物相容性及稳定性已成为临床日益关注的重要问题。人工晶状体混浊在临床上相对少见,通常会被误认为后囊混浊或人工晶状体前细胞增生。亲水性丙烯酸酯和硅凝胶人工晶状体混浊多为沉积性混浊,而疏水性丙烯酸酯和PMMA人工晶状体混浊则多为非沉积性。Jensen等[1]在1994年首次报道了11例白内障患者术后出现人工晶状体表面沉淀物,包括硅凝胶和丙烯酸酯两种材料的人工晶状体,能谱分析显示沉淀物中含有大量的磷和钙,考虑可能和术中使用的黏弹剂透明质酸钠有关。2000年Werner等[2]报道5例白内障术后水凝胶人工晶状体混浊,结论显示人工晶状体混浊与钙、磷沉积有关。Izak等[3]研究表明混浊物主要分布在人工晶状体表面,并平行于人工晶状体表面呈线形分布。Schmidbauer等[4]认为可能有两种机制共同作用:UV吸收剂的变性和人工晶状体表面的钙化沉积。文献显示亲水性丙烯酸酯人工晶状体混浊沉积物可表现为片状板层样和点状棱晶状体纳米颗粒性沉积[5],云雾状或雪花状颗粒性沉积等。除了羟基磷灰石外也见到有其他化学成分的报道,如磷酸八钙[5]、硅核复合物[6]、碳酸钙[7]、白蛋白和免疫球蛋白[8]、磷酸钙、脂肪酸和细小微粒[9]等。
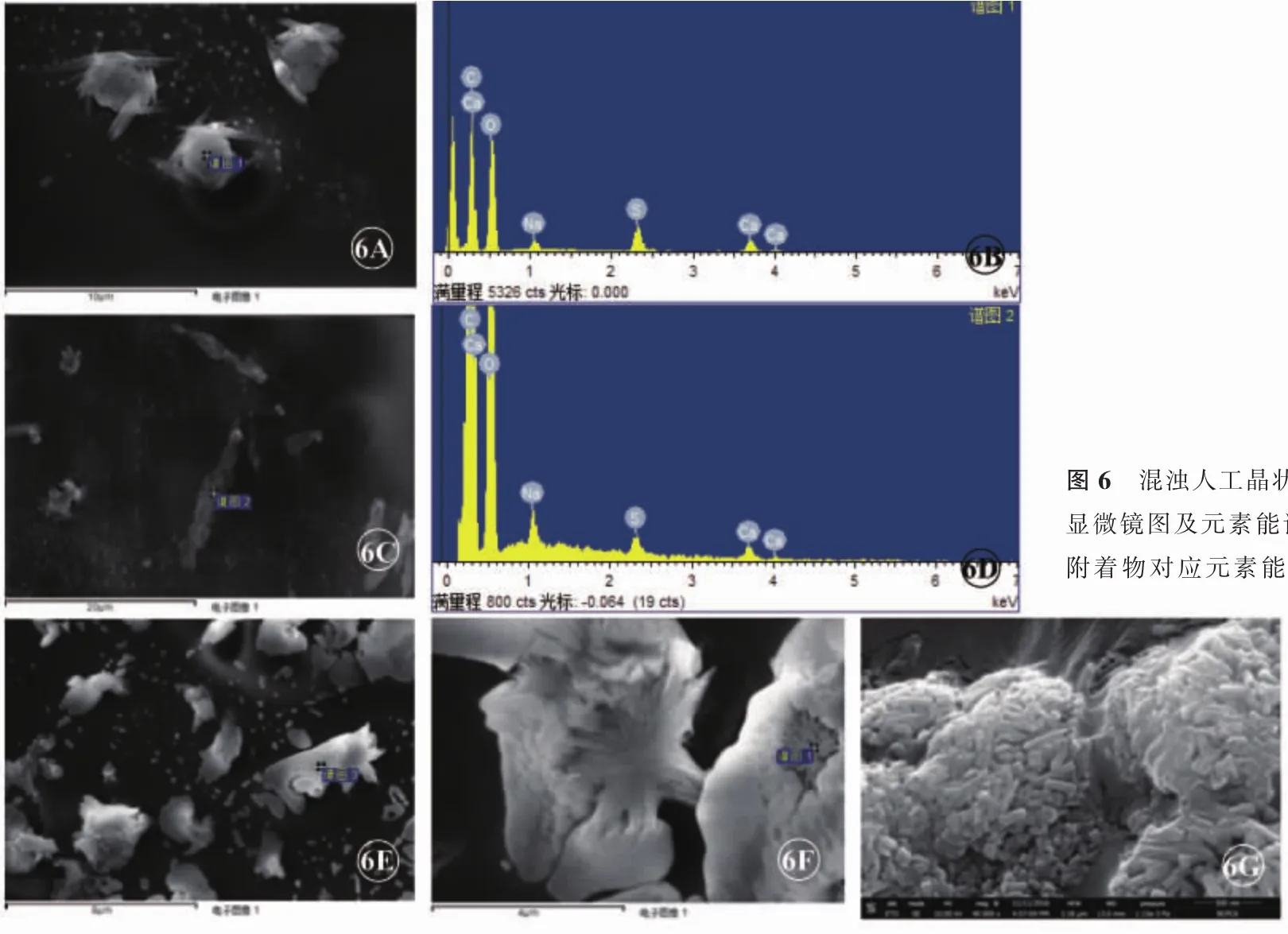
图6 混浊人工晶状体表面附着物的扫描电子显微镜图及元素能谱图。6A.球形附着物,6B.附着物对应元素能谱图;6C.针形附着物,6D.附着物对应元素能谱图;6E.混浊人工晶状体表面大量聚集附着物,6F.团聚附着物的高倍放大;6G.人工晶状体表面富含磷钙的团簇物的40 000倍显微图片,可以看见短棒状的小晶状体
亲水性丙烯酸酯材料是将2分子甲基丙烯酸羟乙酯和1分子甲基丙烯酸甲酯通过主价交联共聚方式结合成的大分子有机化合物[10]。其特点为柔软、可折叠、弹性好、细菌和炎性细胞的黏附性差,所以其发生感染性眼内炎的概率低,但后囊膜混浊和人工晶状体混浊发生率相对较高。本文中患者双眼人工晶状体混浊,更为罕见,双眼人工晶状体均为荷兰ocutens Lentis公司生产的L312后房型可折叠一片式人工晶状体,材料为亲水性丙烯酸酯,其光学面混浊开始于人工晶状体植入术后1年,并逐渐加重,引起视力下降。裂隙灯下见人工晶状体光学部呈均匀灰白色雾状混浊,覆盖整个人工晶状体表面,左眼较右眼沉淀物密集,人工晶状体内部结构不清。对取出的人工晶状体混浊物进行电镜检测,发现人工晶状体表面的结晶状体,能谱吸收峰提示结晶状体内含有钙、硫、氧、钠、碳元素,即混浊物为含钙化合物,呈点状、线状或不规则形,结构致密,而内部没有结晶体,且可溶于氯化氢溶液,与既往文献符合。
人工晶状体混浊的原因是多因素的,具有复杂的发病机制,可能与患者全身性疾病(如糖尿病、风湿免疫性疾病等)、眼部炎症、人工晶状体材料和包装等有关。房水高钙磷被认为是导致人工晶状体混浊的发病机制之一。目前钙磷元素沉积的具体机制尚不十分明确。多数学者认为眼内微环境改变,尤其是局部房水的钙磷成分增加是加速钙化的重要原因[5,9],并认为房水钙含量的升高是全身血钙含量升高的一种表现[8,11]。但国外一些文献对于患者房水和血钙磷含量分析均未发现含量有明显升高[7,12],本文中血清和房水中的钙磷离子含量也均在正常范围,与国外文献报告一致。
此外,人工晶状体诱导学说也是可能的机制之一。亲水性丙烯酸酯材料的生物相容性好,其亲水表面为细胞迁移提供了一个理想的基质结构,导致晶状体囊膜上皮细胞迁移和增殖,引起后囊膜混浊发生率增高。Nakanome的研究证实亲水性人工晶状体发生钙沉积的几率和程度均明显高于非亲水性人工晶状体[11]。由于其本身具有水亲和性,自身老化、药物影响、紫外线等可以引起其富含的羟基活化,与水溶性的钙磷作用发生沉淀反应,从而引发人工晶状体的混浊。还有文献显示糖尿病和青光眼被认为是与人工晶状体混浊关系最大的两种疾病。
本研究显示房水中炎性因子、生长因子、肿瘤坏死因子、房水中钙和磷、血清中免疫球蛋白、补体以及血清中的钙和磷水平均在正常范围,各种抗体检查均为阴性,是因为该患者人工晶状体混浊已有1年时间,炎症反应早已消退,目前全身及眼部情况都处于稳定阶段,糖尿病和风湿性疾病均控制良好,没有活动性炎症表现。但并不能确定患者1年前白内障手术后刚发生人工晶状体混浊时,是否有前房水中炎症因子和钙磷离子的增高,这有待于收集更多病例进一步观察和研究。患者眼压较正常范围轻度升高,考虑为常年服用激素所致的激素性青光眼。房水中新生血管生长因子处于高限,提示与可能有缺血缺氧性疾病,与患者糖尿病因素相关;血沉常用于评价风湿性疾病的活动,本文中血沉高于正常值,考虑与风湿免疫性疾病有关;这两种疾病都可能是发生人工晶状体混浊的诱因。虽然人工晶状体表面附着含钙结晶状体,但人工晶状体内部却没有发现混浊物,说明该混浊物仅仅是沉积在表面,并不是人工晶状体内部自身化学结构发生改变。混浊人工晶状体前表面结晶小体附着密集,而后表面几乎没有混浊物,可能是由于人工晶状体前表面与房水接触紧密,而后表面与后囊膜相贴,房水流动性弱。
当人工晶状体混浊影响视功能时,可行人工晶状体置换术,能明显提高视力,这是公认治疗人工晶状体混浊的最主要手段。人工晶状体出现混浊大多发生在术后1年以上。
声明:本文所有作者共同认可文章无相关利益冲突。

