磁共振动态对比增强及扩散加权成像技术在诊断和预估乳腺癌复发中的价值
张晖,单春辉,王勇
乳腺癌是世界范围内女性癌症死亡的最常见原因之一[1]。20%~30%的乳腺癌患者会复发,使其总体生存率大大降低[2]。因此,如何能够对乳腺癌复发的前期影像特征及时发现,从而尽早诊断和预估乳腺癌复发对改善患者预后至关重要。
本研究目的是评估复发乳腺癌的磁共振动态对比增强成像(dynamic contrast enhancement,DCE-MRI)成像特征及扩散加权成像(diffusionweighted imaging,DWI)的信号特征并比较病灶区域的表观扩散系数(apparent diffusion coefficient,ADC),用以诊断和预估乳腺癌患者的早期和晚期复发,帮助临床医生对复发性乳腺癌患者进行密切随访和评估预后,并有望成为术前确定手术方式的客观依据。
1 材料与方法
1.1 研究对象
搜集2011年1月至2014年6月,在河北省人民医院接受乳腺MRI检查并进行乳腺癌术后随访的78名女性。手术后,根据患者的病情、肿瘤的临床和分子特征,进行放射治疗、化疗或激素治疗等辅助治疗。入选标准:(1)须经病理证实;(2)患者无其他部位癌症病史;(3)须有术前的乳腺影像学资料;(4)患者在确诊时没有远处转移。凡在术前接受了活组织穿刺检查、接受了新辅助化疗、临床或病理分期为T4期的或失访的均被排除在此研究之外。
乳腺癌复发的定义为:区域内复发(指局限于同侧的乳房内或胸壁,同侧的腋窝、腋下软组织内或腋下的淋巴结)和远处复发(指转移到身体的其他部位)。在患者手术后的前2年里,每6个月进行一次随访,连续观察3年以上。所有患者均是通过磁共振、双侧乳腺钼靶摄影、双侧乳腺超声或骨扫描等检查发现了可疑复发的病灶,并通过穿刺活检或切除活检以证实复发。如尚未取得病理结果的,则会进行后续的影像学检查,以评估其生长时间间隔。
1.2 磁共振成像
所有的乳腺磁共振检查均使用美国GE公司的磁共振设备,包括GE Signa Excite 1.5 T和GE 3.0 T Slient Discovery 750 W两种超导全身磁共振扫描仪,利用8通道乳腺专用线圈,行磁共振平扫加增强扫描。扫描序列如下:(1)快速自旋回波(Fast Spin Echo,FSE) T2WI压脂序列:TR 6079 ms,TE 85 ms,反转角111°,扫描野(FOV) 36 mm×36 mm,矩阵320×256,激励次数NEX为1,层厚5.0 mm,扫描时间为2 min 44 s。(2) FSE T1WI序列:TR 697 ms,TE Min Full,反转角111°,FOV 36 mm×36 mm,矩阵320×256,NEX为1,ST 5.0 mm,扫描时间为1 min 5 s。(3) 扩散加权成像DWI序列:TR 2881.4 ms,TE Minimum,FOV 36 mm×36 mm,矩阵128×128,ST 5.0 mm,b值800,扫描时间为2 min 1 s。(4) T1加权动态灌注GEN-IQ序列:TR 5.5 ms,TE Min Full,反转角12°,FOV 34 mm×34 mm,矩阵160×150,ST 5.0 mm,40期扫描,共用时间为7 min 12 s。对比剂使用钆喷酸葡胺(Gd-DTPA)注射液,使用剂量为0.2 mmol/kg,速率为3.0 ml/s,扫描启动后30 s开始注射。随后用20 ml生理盐水以3 ml/s的注射速度冲洗自动注射器。减影图像是通过在像素点的基础上减去第二次动态序列的对比度图像而得到的。同时对减影图像进行最大强度投影重建。
1.3 磁共振图像分析
采集所得数据传至GE ADW 4.6工作站,用专用软件分别对图像数据进行分析处理。再由2名有5年以上乳腺诊断经验的影像科医师在不知道临床诊断、手术及病理结果的情况下,逐一对影像表现进行诊断分析,并对存有异议的图像或后处理得到的数据,通过讨论达成一致意见。对于多病灶或多中心的乳腺癌患者,将最大的病灶或病灶的中心部位作为感兴趣区。根据第五版的乳腺成像报告和数据系统(breast imaging reporting and data system,BI-RADS) MRI指南[3],对乳腺癌的相关数据指标进行分析,包括:背景实质增强(background parenchymal enhancement,BPE) (分为轻度、中度或明显强化)和内部增强(分为非边缘强化或边缘强化)。在数字减影图像上,当发现有血管进入增强的病变内或血管与病变边缘有接触即认为这是一个与肿瘤相关的血管征象[4],因此把它定义为关系密切血管。在每一个最大强度投射图像上,将患侧乳腺内较大的血管(血管的长度≥3 cm,或最大横径≥2 mm)与对侧乳腺的血管分布情况进行了对比[5]。把多个血管的分布程度差异划分为:显著增多(即患侧乳腺内的血管数量比对侧多3条或更多);轻度增多(即比对侧多2条或1条);不增多(即与对侧的乳内血管的数量相同或少于对侧)。每个研究者都使用DCE-MRI软件对乳腺癌的时间-信号强度曲线进行回顾性的分析研究[6]。把感兴趣区域(regions of interest,ROI)放置在明显增强的区域,或是可疑的病灶区(扩散加权成像显示为高信号)。DWI序列中高信号的区域为病灶。通过后处理得到ADC图后,在病变区域手工放置椭圆形的ROI测量ADC值,范围至少包括4个最小像素,并测量3次取平均值。在动力学曲线评估中,把初始的增强模式和动态曲线模式分别分为慢速、中速和快速及流入型、平台型和流出型[3]。并以此标准对BPE的磁共振成像进行评估,包括:乳腺内部增强特征、邻近的血管情况、全乳血管的分布情况和动态增强曲线模式。最终诊断通过讨论达成一致意见。
1.4 病理特征
搜集全部入选患者的临床病理学资料,包括:年龄、肿瘤分期、腋窝淋巴结状况、是否存在淋巴管浸润以及导管内癌的成分、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、Ki-67、HER-2、P53等。ER和PR阳性为正染色核≥10%。Ki-67被定义为阴性(<14%)和阳性(≥14%)。HER-2染色的强度为0,1+,2+,或3+。分数为3+的肿瘤被归为HER-2阳性,分数为0或1+的肿瘤被归为阴性。分数为2+的肿瘤,利用荧光原位杂交的基因扩增来确定HER-2的状态。如果HER-2在17号染色体的比值>
2.2 ,即认为HER-2表达阳性。
1.5 乳腺癌复发
回顾性分析所有患者的病例,并将复发时间定为从手术日期到第一次确诊复发的时间。并按复发时间将乳腺癌患者的复发时间分为早期(手术后≤2年)和晚期(术后>2年)复发。选定2年为分界点是因为人们普遍认为到乳腺癌复发的高峰期是2到3年后[7]。对所有无乳癌复发的患者的观察时间都是直到最后一次随访或因乳癌以外其他情况而死亡的日期。
1.6 统计分析
采用单因素分析的方法比较了无复发组和早期或晚期复发组之间的磁共振成像特征和临床病理学特征。采用单因素和多因素Cox比例风险回归分析方法对疾病进展的独立风险因素进行评估。除了年龄,所有连续的因素都是对数变换,以减少个别偏差的影响。在单因素分析中,把带有P值小于0.2的变量作为多元模型的输入变量录入。利用多因素分析所选择的磁共振成像特征和临床病理指标,计算出曲线下面积(area under curve,AUC),并对复发的可预估性进行了比较。所有的统计分析都是使用SAS 18.0统计软件,双侧(P<0.05)被认为具有统计学意义。
2 结果
2.1 患者的生存结果
本研究中的78名女性平均复发时间为58.3个月,其中早期复发为45例(中位值为15.6个月,区间为5.0~24.0个月),晚期复发为33例(中位值为60.3个月,范围为30.2~72.0个月)。发病的平均年龄为51.6岁(范围为23.0~81.0岁)。年复发率的动态变化曲线如图1所示。

图1 78名乳腺癌患者的年复发率Fig.1 Annual recurrence rate of 78 breast cancer patients.
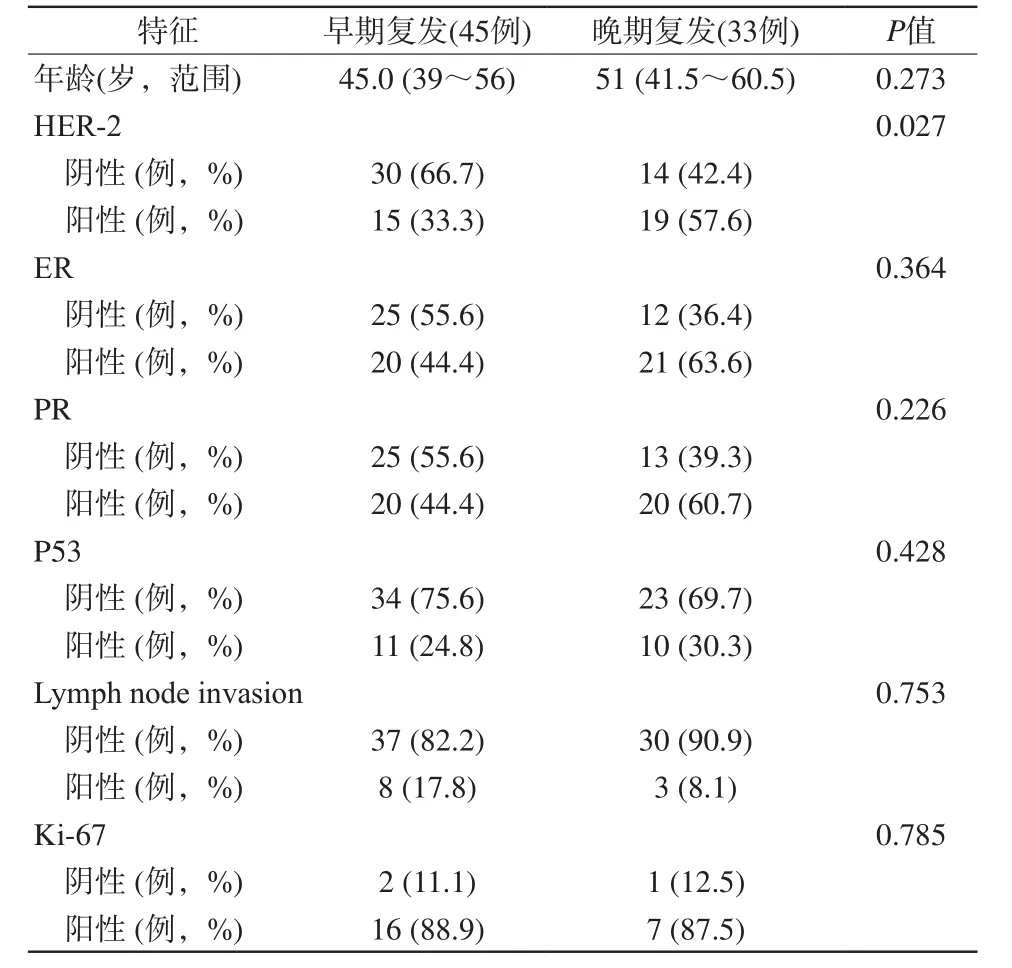
表1 乳腺癌早期复发和晚期复发病例的临床病理特征Tab. 1 Clinical pathological features of early recurrence and late recurrence of breast cancer patients
各种相关临床病理指标见表1,HER-2的检测结果在早期和晚期复发之间有显著差异。HER-2阴性肿瘤在肿瘤早期复发率为66.7%,而HER-2阳性在肿瘤晚期复发率为57.6%,HER-2阴性型肿瘤的比例明显更高(P=0.027)。在磁共振动态增强检查中病灶的早期影像学特征中相邻的血管标志和全乳腺的血管分布情况在早期和晚期复发之间有显著的差异。邻近血管特征性表现出现在早期复发(75.6%)病例中的比例明显高于晚期复发(39.4%) (P=0.036)。早期复发(33.3%)病例中全乳血管的显著增加的比例要高于晚期复发(6.1%)病例(P=0.034)。在DWI中,平均ADC值<1.20×10-3mm2/s的病变在早期复发病例中的比例(77.8%)明显高于晚期复发(42.4%) (P=0.028) (表2)。
2.2 对临床病理特征与复发相关性的单因素分析
在临床病理特征中,T分期≥T2、N分期≥N2、ER阴性、PR阴性和Ki-67阳性与乳腺癌的整体复发有显著的相关性。其中,T分期≥T2、N分期≥N2、ER阴性、PR阴性和Ki-67阳性与早期复发显著相关。T2期、HER-2阳性和Ki-67阳性与晚期的复发有显著的相关性。中度或显著的BPE、边缘增强与早期和晚期复发均有显著的相关性。患侧的全乳血管的显著增加亦与早期复发有显著的相关性。
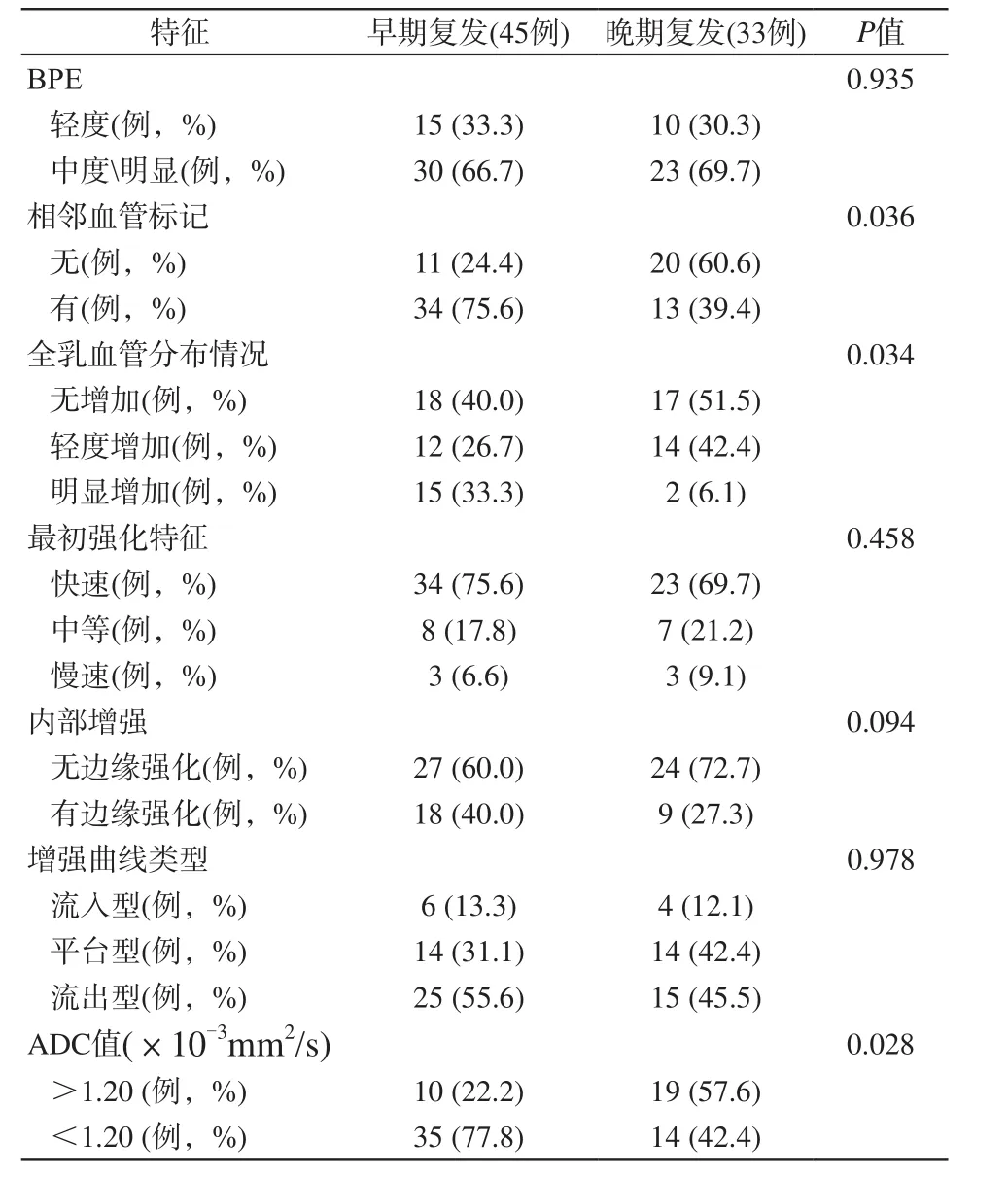
表2 比较乳腺癌早期复发和晚期复发病例的动态磁共振增强特征和DWI的平均ADC值Tab. 2 Comparison of DCE-MRI characteristics and average ADC value of DWI between early recurrence and late recurrence of breast cancer patients
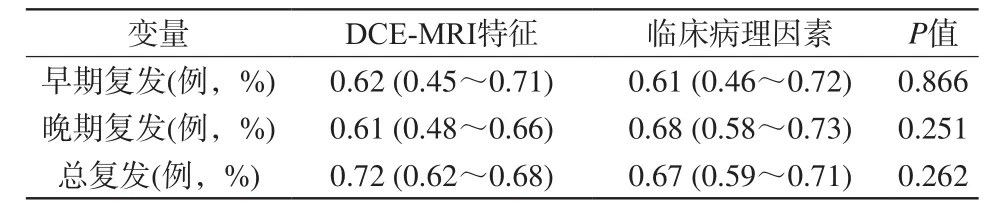
表3 DCE-MRI和临床病理特征相关指标在各复发组术后病理对照的曲线下面积Tab. 3 DCE-MRI and clinicopathological features related indicators in each recurrence group postoperative pathological control area under the curve
在预估乳腺癌复发方面,DCE-MRI和临床病理特征相关指标在早期复发、晚期复发和整体复发率在统计学上没有显著差异(表3;图2)。
3 讨论
3.1 乳腺癌复发相关的临床和病理特征
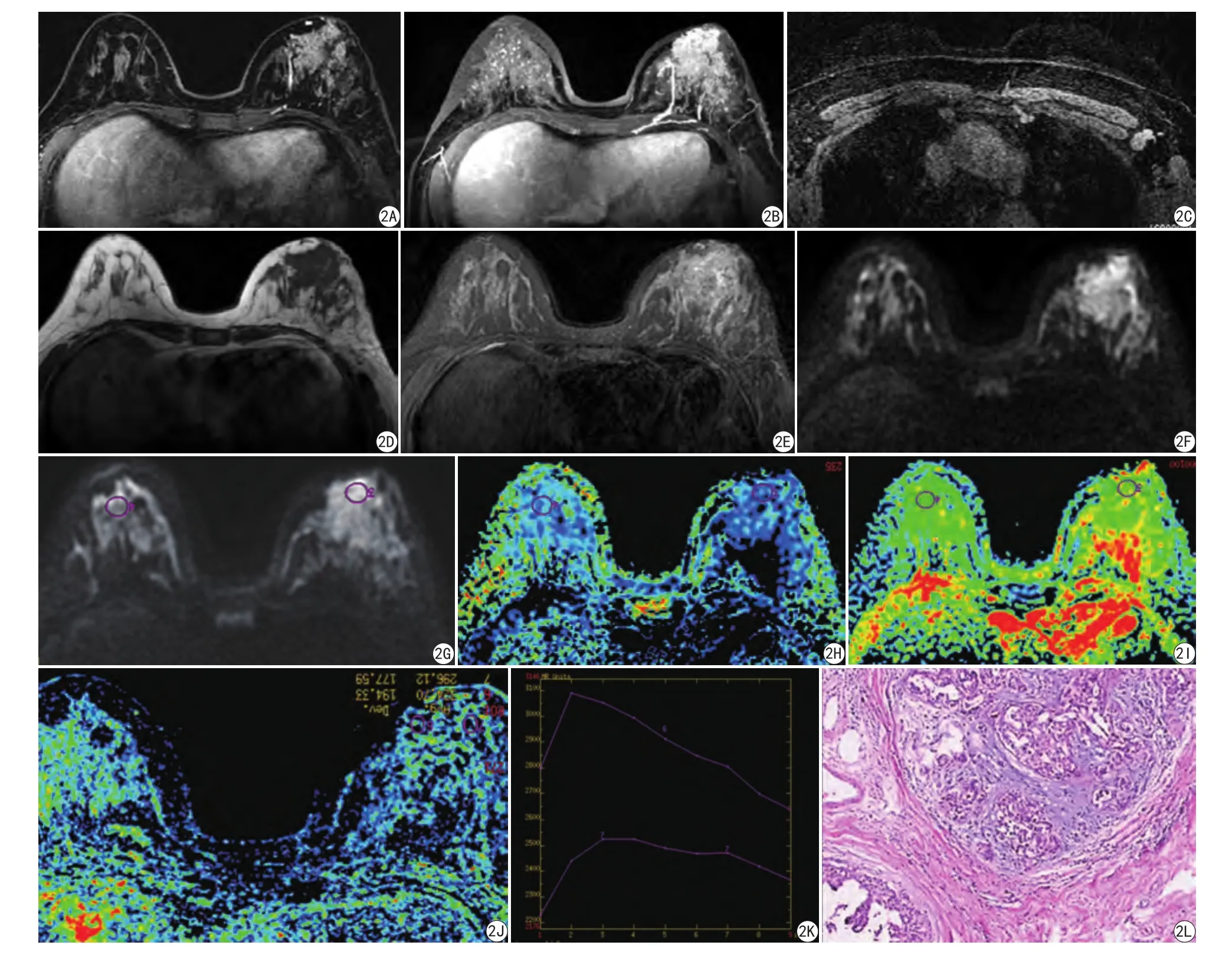
图2 女,54岁,A:左乳癌,为T1增强可见左乳内肿块明显强化,并可见一较大供血血管,长径约4 cm,横径约3 mm;B:为MIP图,可见肿块区的供血动脉;C:为左腋下肿大化淋巴结,大小约1.1 cm×1.9 cm;D:为T1WI,左乳病灶呈团块状低信号影;E:T2WI,病灶呈片状不均匀高信号影;F:DWI,病灶呈团块状高信号影;G~I:双侧对照测量,DWI及EADC图、ADC图;J,K:为动脉增强曲线图(maximum slope of increase);L:病理图片,示乳腺中等核级导管原位癌,伴小灶状浸润性导管癌Ⅱ级(HE ×40)Fig.2 Female, 54 years old. A: The left breast carcinoma, shows the obvious strengthening of the inner mass of the left breast with T1 enhancement, and a large blood supply vessel can be seen, with a long diameter of about 4 cm and a transverse diameter of about 3 mm. B: For the MIP figure visible mass of blood supply arteries. C: Reinforce the left armpit swollen lymph nodes, the size is about 1.1 cm×1.9 cm. D: For T1WI images, left breast lesions had the massive low signal. E: T2WI images lesions plate shaped heterogeneous high signal shadow. F: DWI lesions can crumb high signal in a shadow. G—I: Bilateral control measure DWI images and EADC diagram, the ADC can figure. J and K are the pathological image of the arterial enhancement curve (maximum slope of increase). L: Pathological images for breast medium nuclear grade ductal carcinoma in situ, with stove shape Ⅱ infiltrating ductal carcinoma (HE ×40).
乳腺癌发病率较高,且大约70%乳腺癌的早期复发均发生在乳腺癌确诊后的2年内,早期复发的患者比那些晚期复发的患者存活时间更短并且需要更积极的治疗方法[8],因此,确定乳腺癌复发的早期影像特征尤为重要。另外,临床医师对可能会复发的乳腺癌患者,可以提前选择相关的辅助治疗方案[8-10],例如,ER为阳性的乳腺癌与晚期复发密切相关,可以选择服用药物——芳香化酶抑制剂作为辅助内分泌治疗,这可以起到预防复发的作用,从而改善患者的预后[11]。对有早期复发特征的乳腺癌患者则需要积极化疗[12]。有研究发现,病理相关指标如T分期、N分期、P53、Ki-67、人表皮生长因子受体2 (HER-2)和ER等也与乳腺癌的复发时间有一定关联[13-14]。
本研究所观测的临床病理特征相关指标中,ER阴性与早期乳腺癌复发有关,这与此前的研究结果较相似,即在2年的随访期中,ER阳性的复发率远低于阴性者[15-16]。另外,肿瘤的T2期与晚期复发密切相关。肿瘤的大小是预估肿瘤复发的一个重要因素,肿瘤越大,越容易复发[10]。但与T2期肿瘤不同的是,T3期肿瘤并没有与此研究中的晚期复发独立相关。究其原因这可能与T3期乳癌患者在本研究中乳腺的数量较少有关。
3.2 DCE-MRI成像下新生血管和BPE特征
DCE-MRI是一种能很好地显示新生血管的成像方式,它能够反映肿瘤的血管生成情况,其对比增强的模式与肿瘤中新生成的微血管的密集程度密切相关[17]。新生血管是肿瘤的生长、进展和转移的必备条件。有研究发现乳腺癌肿块的边缘增强与乳腺癌患者的复发及整体存活率相关[18-19]。
在本研究中,发现患侧全乳血管的显著增多与乳腺癌的早期复发相关,而中度或显著的BPE和边缘增强与晚期复发相关。在预测早期、晚期或整体复发时,术前的磁共振成像特征与临床病理特征相关指标具有一致性。
BPE是指在注入钆对比剂后增加了乳腺组织的T1弛豫,而BPE的程度与供血动脉和渗透率直接相关。本研究中,笔者发现DCE-MRI检查可明确显示患侧乳腺中度或显著性的BPE,该技术能预估乳癌的晚期复发和整体复发。此外,在术前的DCE-MRI 检查中,肿瘤的实质增强可能反映了与乳腺癌复发密切相关的微环境的状况。乳腺癌复发组中患侧乳腺具有相对较高的BPE,也显示了其血管内皮渗透性的增加后可促使对比剂在肿瘤及邻近的血管中加速流动[20]。血管内皮渗透性增加同时使乳腺癌细胞和血管间的直接相互作用的几率增加,从而促进了肿瘤的生长和转移。乳腺癌病灶本身刺激滋养血管和邻近血管生成,受累血管包括微血管和小血管,其中相对管径较大的血管由于流动阻力较少,其对肿瘤供养作用更为突出,因此对促进肿瘤的生长和乳腺癌的早期复发可能起到了较大的作用。
笔者还发现,DCE-MRI的边缘增强可以预估晚期复发和整体复发。这一影像学特征多是由肿瘤内的微血管分布情况和肿瘤边缘的微血管分布情况共同作用而形成。此外,边缘增强特征与肿瘤的纤维化和坏死有关[18]。与边缘增强相关的乳腺癌,其病灶中心发生纤维聚集是一种组织内部缺氧的表现,其范围与肿瘤内的微血管密度和较高的组织学等级有关[21-24]。但是目前对肿瘤的微血管密度、组织内部缺氧状况和乳腺癌的晚期复发之间的关系仍然不很清楚。多项研究显示,边缘增强与肿瘤的迅速生长、较高的组织学等级、ER阴性、Ki-67的高表达和淋巴结的高反应状态等均具有相关性[14,18-19]。其中,淋巴结在DCE-MRI中表现为边缘强化的影像特征与乳腺癌晚期复发相关[8]。
3.3 DWI成像下ADC值的特征
DWI技术目前已经逐步应用到了乳腺肿瘤的术前诊断中。有研究结果表明,典型的恶性肿瘤的ADC值比良性增生和正常组织的ADC值要低,其原因部分是由于恶性肿瘤的细胞密度大而导致的细胞外空间狭小,继而引起水分子扩散受限所致[25]。通过测量ADC值可以部分的将这种复杂的微观现象转化为可定量测量的参数,继而区分不同的组织来源。而且磁共振的DWI技术具有采集时间短,不需要使用顺磁性对比剂和具有较高的敏感性等优势,随着设备扫描参数的不断优化,其诊断特异性也随之提高[26]。
3.4 乳腺癌复发的相关临床病理特征、DCE-MRI和DWI技术的联合应用
在预估乳腺癌复发和临床病理特征相关指标的关系方面,笔者发现在早期、晚期和整体复发病例中,DCE-MRI特征和临床病理特征相关指标之间没有显著的差异(表3)。在实际工作中,与复发相关的临床病理指标只能在手术后获得,这对于乳腺癌复发的术前预估毫无意义。尽管目前在术前可行穿刺活检得到细胞学病理结果,但也会出现部分穿刺活检结果与手术后病理结果不一致的情况,并且穿刺活检的创伤性和穿刺针道转移也都是制约术前穿刺活检的因素,而DCE-MRI及DWI是非侵袭性的成像方式,目前已广泛用于术前评价肿瘤的特征及肿瘤的血管分布情况,MRI常规扫描和DCE-MRI扫描技术可以提供乳腺活体组织的内部结构信息,二者更接近于组织病理学特性,同时结合DWI序列可提高乳腺病灶鉴别诊断的准确性[23]。而本研究结果进一步表明DCEMRI技术联合DWI技术还能够用于预估乳腺癌的早期、晚期和整体复发的情况,以辅助临床医师适时调整治疗方案和评估预后。本研究也存在一些不足之处。首先,本研究包括的乳腺癌复发的患者数量较少,可能不能完全代表一般人群。其次,本研究属于回顾性研究,随访时间不够长(中值随访,60.8个月);因为部分乳腺癌的一些亚型可能会到10年后复发。再次,本研究未能评估辅助激素治疗或辅助化疗的乳腺癌患者,因此可能会影响此类患者的复发期。
3.5 结论
应用DCE-MRI检查技术,患侧的全乳血管分布增多,可以预测乳腺癌的早期复发;乳腺中度或显著的实质背景增强和边缘增强可以预估乳腺癌的晚期复发。DCE-MRI结合动态增强曲线类型和DWI序列的ADC值可以有效地诊断和预估乳腺癌患者的复发时间,为临床医师提供更多科学、定量和可靠的影像学信息,辅助其适时调整后续治疗方案和评估预后。
[References]
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin, 2015, 65(2): 87-108.
[2] Lowery AJ, Kell MR, Glynn RW, et al. Locoregional recurrence after breast cancer surgery: a systematic review by receptor phenotype.Breast Cancer Res Treat, 2012, 133(3): 831-841.
[3] Morris EA, Comstock CE, Lee CH, et al. ACR BI-RADS® magnetic resonance imaging//ACR BI-RADS® atlas, breast imaging reporting and data system. Reston: American College of Radiology, 2013.
[4] Dietzel M, Baltzer PA, Vag T, et al. The adjacent vessel sign on breast MRI: new data and a subgroup analysis for 1084 histologically verified cases. Korean J Radiol, 2010, 11(2): 178-186.
[5] Sardanelli F, Iozzelli A, Fausto A, et al. Gadobenate dimeglumineenhanced MR imaging breast vascular maps: association between invasive cancer and ipsilateral increased vascularity. Radiology,2005, 235(3): 791-797.
[6] Kang DK, Kim EJ, Kim HS, et al. Correlation of whole-breast vascularity with ipsilateral breast cancers using contrast-enhanced MDCT. AJR Am J Roentgenol, 2008, 190(2): 496-504.
[7] Mansell J, Monypenny IJ, Skene AI, et al. Patterns and predictors of early recurrence in postmenopausal women with estrogen receptor-positive early breast cancer. Breast Cancer Res Treat, 2009, 117(1): 91-98.
[8] Song WJ, Kim KI, Park SH, et al. The risk factors influencing between the early and late recurrence in systemic recurrent breast cancer. J Breast Cancer, 2012, 15(2): 218-223.
[9] Nishimura R, Osako T, Nishiyama Y, et al. Evaluation of factors related to late recurrence. Later than 10 years after the initial treatment: in primary breast cancer. Oncology, 2013, 85(2):100-110.
[10] Kennecke H, McArthur H, Olivotto IA, et al. Risk of early recurrence among postmenopausal women with estrogen receptor-positive early breast cancer treated with adjuvant tamoxifen. Cancer, 2008, 112(7):1437-1444.
[11] Jonat W, Gnant M, Boccardo F, et al. Effectiveness of switching from adjuvant tamoxifen to anastrozole in postmenopausal women with hormone-sensitive early-stage breast cancer: a meta-analysis. Lancet Oncol, 2006, 7(12): 991-996.
[12] Senkus E, Kyriakides S, Ohno S, et al. Primary breast cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up.Ann Oncol, 2015, 26(5): 218-230.
[13] Joensuu K, Leidenius M, Kero M, et al. ER, PR, HER2, Ki-67 and CK5 in early and late relapsing breast cancer-reduced CK5 expression in metastases. Breast Cancer (Auckland), 2013, 7(1):23-34.
[14] Ahn SG, Lee HM, Cho SH, et al. The difference in prognostic factors between early recurrence and late recurrence in estrogen receptorpositive breast cancer: nodal stage differently impacts early and late recurrence. PloS One, 2013, 8(5): 635-640.
[15] Gray RJ. Flexible methods for analyzing survival data using splines,with applications to breast cancer prognosis. J Am Stat Assoc, 1992,87(1): 942-951.
[16] Westenend PJ, Meurs CJ, Damhuis RA. Tumour size and vascular invasion predict distant metastasis in stage I breast cancer. Grade distinguishes early and late metastasis. J Pathol, 2005, 58(2):196-201.
[17] Jia ZZ, Shi W, Shi JL, et al. Comparison between perfusion computed tomography and dynamic contrast-enhanced magnetic resonance imaging in assessing glioblastoma microvasculature. Eur J Radiol, 2017, 87(12): 120-124.
[18] Teifke A, Behr O, Schmidt M, et al. Dynamic MR imaging of breast lesions: correlation with microvessel distribution pattern and histologic characteristics of prognosis. Radiology, 2006, 239(2):351-360.
[19] Lee SH, Cho N, Kim SJ, et al. Correlation between high resolution dynamic MR features and prognostic factors in breast cancer. Korean J Radiol, 2008, 9(1): 10-18.
[20] Wu S, Zuley ML, Berg WA, et al. DCE-MRI background parenchymal enhancement quantified from an early versus delayed post-contrast sequence: association with breast cancer presence. Sci Rep, 2017, 7(1): 2115-2128.
[21] Dhakal HP, Bassarova A, Naume B, et al. Breast carcinoma vascularity: a comparison of manual microvessel count and chalkley count. Histol Histopathol, 2009, 24(8): 1049-1059.
[22] Han M, Kim TH, Kang DK, et al. Prognostic role of MRI enhancement features in patients with breast cancer: value of adjacent vessel sign and increased ipsilateral whole-breast vascularity. AJR Am J Roentgenol, 2012, 199(4): 921-928.
[23] Narisada H, Aoki T, Sasaguri T, et al. Correlation between numeric gadolinium-enhanced dynamic MRI ratios and prognostic factors and histologic type of breast carcinoma. AJR Am J Roentgenol, 2006,187(2): 297-306.
[24] Colpaert C, Vermeulen P, Jeuris W, et al. Early distant relapse in"node-negative" breast cancer patients is not predicted by occult axillary lymph node metastases, but by the features of the primary tumour. J Pathol, 2001, 193(4): 442-449.
[25] Pereira FP, Martins G, Carvalhaes RV. Diffusion magnetic resonance imaging of the breast. Magn Reson Imaging Clin N Am, 2011, 19(1):95-110.
[26] Thomassin-Naggara I, De Bazelaire C, Chopier J, et al. Diffusionweighted MR imaging of the breast: advantages and pitfalls. Eur J Radiol, 2013, 82(3): 435-443.

