DWI对脑实质间变性室管膜瘤与多形性胶质母细胞瘤的鉴别价值
张国晋,马莉,王丹,张文娟,周俊林
多形性胶质母细胞瘤(glioblastoma multiforme,GBM)是星形细胞瘤中恶性度与致死率最高的一类,属WHO Ⅳ级,约占胶质瘤的54%,占颅内肿瘤的10.2%左右[1]。本病可发生于任何年龄,以50岁以上常见,男性多于女性。发生部位以额叶多见,其次为颞、顶叶。肿瘤呈浸润性生长,常累及几个脑叶,并侵犯深部结构,也可跨过胼胝体侵袭对侧大脑半球[2]。肿瘤可原发于脑实质内,也可呈继发性,后者多由间变性胶质瘤恶变而来,少部分可由少突胶质瘤、间变性室管膜瘤或混合性胶质瘤恶变而来[3]。其影像学表现与脑实质间变性室管膜瘤存在一定的交叉,不易鉴别。本研究通过对比分析多形性胶质母细胞瘤与脑实质间变性室管膜瘤的MRI征象及扩散加权成像(diffusion weighted imaging,DWI),探讨其MRI征象及表观扩散系数(apparent diffusion coefficient,ADC)值在两者中的鉴别价值。
1 材料与方法
1.1 一般资料
搜集我院2014年1月1日至2017年2月1日间经手术及病理证实的多形性胶质母细胞瘤与脑实质间变性室管膜瘤患者的资料。25例多形性胶质母细胞瘤中,男16例,女9例,年龄20~70岁,平均52.2岁;18例间变性室管膜瘤中,男11例,女7例,年龄6~65岁,平均33.2岁。临床表现大部分患者有头痛、癫痫、视盘水肿等颅高压表现,部分患者还伴有意识障碍与言语障碍。以上病例均行MRI平扫及增强检查。
1.2 设备与方法
采用西门子Skyra 3.0 T超导磁共振机进行头颅平扫及增强扫描,层厚5~6 mm,层间距1 mm,视野(FOV) 230 mm×230 mm,矩阵256×256。自旋回波(spin echo,SE) T1WI TR 250 ms,TE 2.48 ms,快速自旋回波(fast spin echo,FSE) T2WI TR 4000 ms,TE 96 ms,回波时间10 ms,回波链长度为8,激励次数为2。DWI TR 4500 ms,TE 102 ms,b值分别为0、1000 s/mm2。增强扫描经肘静脉团注Gd-DTPA对比剂,剂量为0.1 mmol/kg,行多平面扫描。
1.3 DWI图像后处理及统计分析
应用Siemens后处理工作站,将感兴趣区(region of interest,ROI)手动放置于强化最明显且在ADC图上信号相对较低的肿瘤实质区域,b值为1000 s/mm2。ROI选择16~20 mm2,以同样大小ROI在相同区域测量3次并取平均值。脑实质间变性室管膜瘤与多形性胶质母细胞瘤的ADC值行Mann-Whitney U秩和检验,P<0.01认为有统计学意义,并绘制受试者工作特征曲线(receiver operating characteristic,ROC)曲线。
2 结果
2.1 两组肿瘤的MRI征象(表1)
25例多形性胶质母细胞瘤,额部7例,颞部10例,额颞部同时累及4例,顶枕部2例,额顶部2例;分叶状或不规则形21例,4例呈类圆形或椭圆形。T1WI上呈等低信号、混杂低信号,T2WI上呈等高信号、混杂高信号。5例出现流空血管影,14例有瘤内出血灶,病灶内有囊变坏死者23例,瘤脑界限不清者23例,瘤周水肿轻度者6例,中重度水肿19例。19例增强扫描表现为不规则花环状强化,均匀强化者6例(图1)。
18例脑实质间变性室管膜瘤,额颞部7例,额部5例,颞部4例,顶部2例;类圆形或圆形12例,6例呈不规则形或分叶状。15例呈部分囊性型,3例呈完全实质性。实性病灶T1WI均呈等低信号,T2WI呈等高信号。4例出现流空血管影,瘤内出血3例,病灶内有囊变坏死者14例,瘤脑界面模糊5例,5例无瘤周水肿,轻度者7例,中重度4例。增强扫描15例轻中度强化,3例明显强化(图2)。
2.2 两组肿瘤的DWI信号强度及ADC值比较分析
25例多形性胶质母细胞瘤的实性部分在DWI高b值(b=1000 s/mm2)上,19例呈斑片状高信号,ADC图呈稍低信号(图1D、E),6例呈等低信号,相应ADC图呈等低信号,ADC值范围为(0.63~1.24)×10-3mm2/s,均值为(0.87±0.06)×10-3mm2/s。
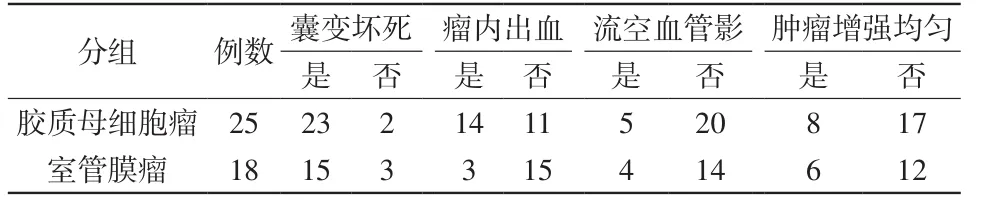
表1 多形性胶质母细胞瘤与间变性室管膜瘤的MRI影像征象(例)Tab. 1 The imaging signs of MRI findings in GBM and anaplastic ependymoma (n)
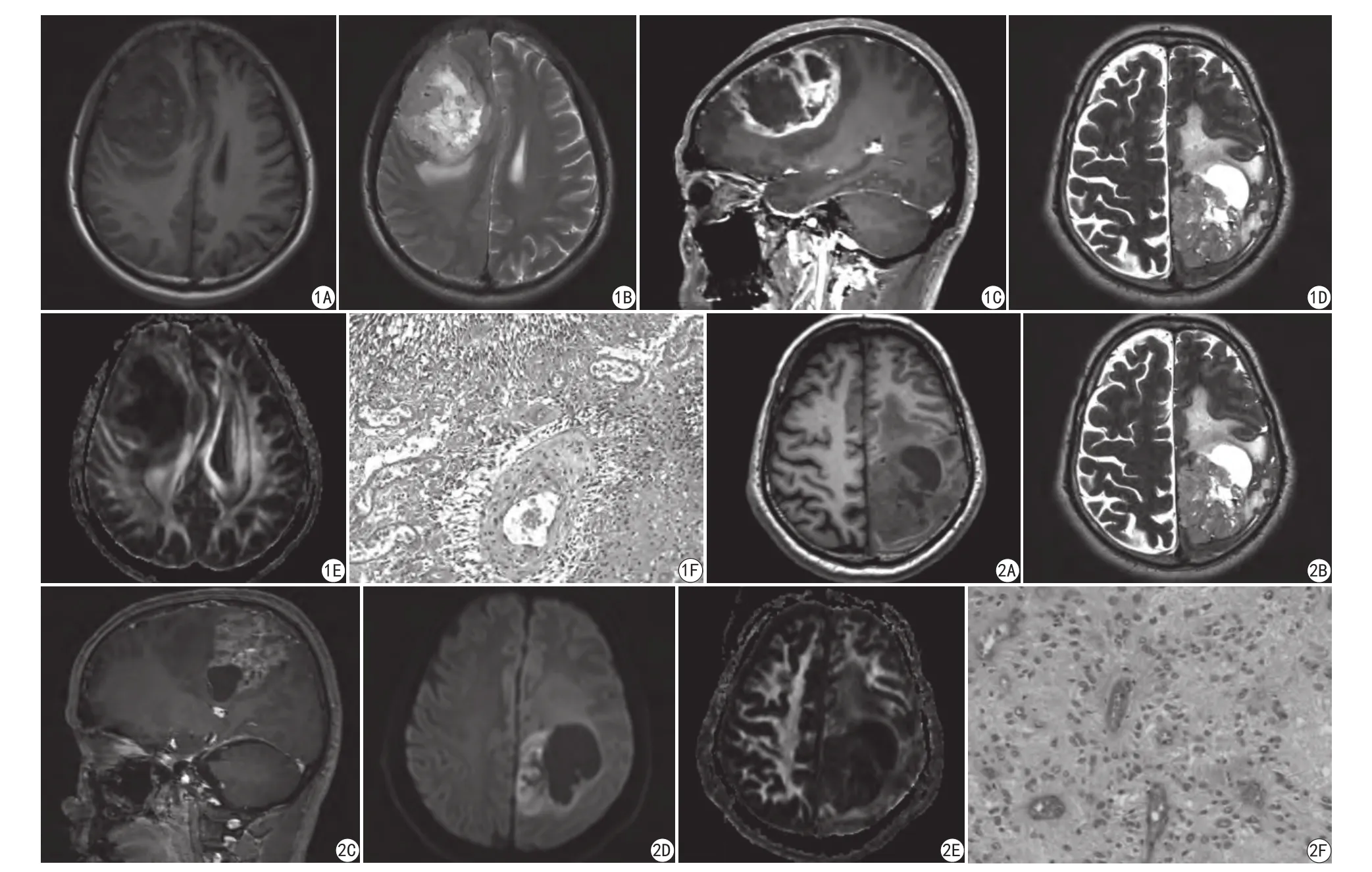
图1 男,45岁,右额叶多形性胶质母细胞瘤,右额叶囊实性占位,大小约5.4 cm×5.3 cm×7.1 cm,边界不清。A:T1WI轴位病灶呈稍低信号为的混杂信号;B:T2WI轴位病灶呈稍高信号为主的混杂信号,周围见指套样水肿;C:增强示病灶不规则环形明显强化;D:DWI序列病灶呈轻-中度不均匀扩散受限;E:ADC图病灶呈等低信号;F:病理图见瘤细胞弥漫分布,具有异型性,核大、深染,核分裂多见,伴栅状坏死(HE ×200) 图2 男,56岁,左顶叶间变性室管膜瘤,左顶叶囊实性占位,大小约5.1 cm×6.3 cm×6.7 cm,边界尚清。A:T1WI轴位病灶呈等低混杂信号;B:T2WI轴位病灶呈等高混杂信号;C:增强示病灶不均匀中度强化;D:DWI序列病灶呈轻度不均匀扩散受限,囊性部分呈低信号;E:ADC图病灶呈等低信号;F:病理图见瘤细胞呈梭形,分布疏密不均,排列于血管周围,形成假菊形团状结构(HE ×200)Fig.1 Male, 45 years old, right frontal GBM solid cystic lesion of right frontal lobe, size is about 5.4 cm×5.3 cm×7.1 cm, not well-defined. A: T1WI cross-sectional shows slightly lower signal for mixed signal. B: T2WI cross-sectional shows mixed signal mainly high, found around the finger like edema.C: T1WI planum sagittal shows irregular circular reinforcement. D: DWI shows inhomogeneous restricted diffusion. E: ADC figure lesions in low signal.F: Pathology shows tumor cell diffuse distribution, atypia, nuclear, deep staining, fission, with grating necrosis (HE ×200). Fig. 2 Male, 56 years old, left parietal anaplastic ependymoma left parietal cystic solid lesions, size is about 5.1 cm ×6.3 cm×6.7 cm, well-defined. A: T1WI cross-sectional shows lowmixed signals. B: T2WI cross-sectional shows high-mixed signals. C: T1WI planum sagittal shows inhomogeneous medium reinforcement. D: DWI shows in mild inhomogeneous restricted diffusion, cystic part is low. E: ADC figure lesions in low signal. F: Pathology shows tumor cells in fusiform, uneven distribution of density, are arranged around the blood vessels, forming a fake chrysanthemum group structure (HE ×200).
18例脑实质间变性室管膜瘤的实性部分在DWI高b值(b=1000 s/mm2)上,14例呈斑片状稍高信号,ADC图呈低信号(图2D、E),4例呈等低信号,相应ADC图呈等低信号,ADC值范围为(0.94~1.53)×10-3mm2/s,均值为(1.15±0.12)×10-3mm2/s,高于前者,其差异具有统计学意义(t=9.43,P<0.001)。以ADC值0.96×10-3mm2/s作为脑实质间变性室管膜瘤与多形性胶质母细胞瘤的诊断阈值时,ROC曲线下的面积为0.92±0.04,95%可信区间为0.84~1.00,灵敏度90%,特异度95%,准确率90% (图3)。
2.3 病理特点
多形性胶质母细胞瘤:大体上,切面呈灰红色,无包膜,边界不清。肿瘤中心常伴有囊变、坏死、出血,部分肿瘤坏死液化后形成大囊腔。瘤周水肿明显。光学显微镜下核异型性显著,细胞呈多形性,有丝分裂活跃;血栓形成,内皮细胞增生,可见大量不成熟血管及坏死血管。
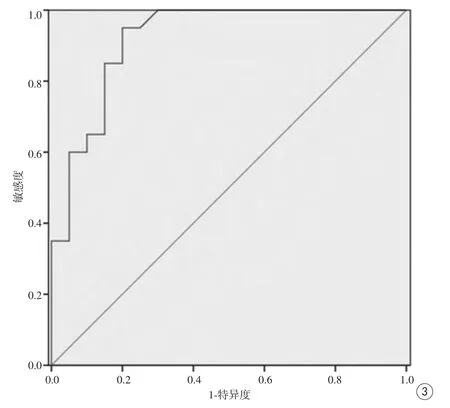
图3 ADC值鉴别诊断脑实质间变性室管膜瘤与多形性胶质母细胞瘤的ROC曲线。曲线下面积为0.92±0.04Fig. 3 ROC value in differential diagnosis of ADC curves of brain anaplastic ependymoma and GBM. The area under the curve was 0.92±0.04.
间变性室管膜瘤:大体上,切面呈灰红色,边界清晰。肿瘤内成分混杂,囊变多见,可有钙化、出血。光学显微镜下瘤细胞核大并深染,核分裂象少见,可见肿瘤细胞紧密围绕小血管壁形成特征性的“假玫瑰结”。电镜下瘤细胞呈典型的纤毛状或微绒毛样,结构复杂。
3 讨论
GBM和间变性室管膜瘤同属于神经上皮组织来源的肿瘤。根据2016版中枢神经系统肿瘤分类标准[4],将GBM分为:(1)胶质母细胞瘤,IDH-野生型(约占90%),包括三个亚型:巨细胞型胶质母细胞瘤、上皮样胶质母细胞瘤和胶质肉瘤;(2)胶质母细胞瘤,IDH-突变型(约占10%);(3)胶质母细胞瘤,NOS型,是指缺乏相关基因改变检测的肿瘤。在2007版中枢神经系统肿瘤分类中[5],室管膜瘤包括四个亚型:(1)细胞型;(2)乳头状型;(3)透明细胞型;(4)伸长细胞型;还包括间变性室管膜瘤;新版(2016版)分类中根据基因特征对室管膜肿瘤新增一个亚型,即“室管膜瘤,RELA融合-阳性”(Ⅱ或Ⅲ级)。另外,细胞型室管膜瘤与典型室管膜瘤很大程度上存在重叠,新版分类标准已将其删除[4,6]。
多形性胶质母细胞瘤和间变性室管膜瘤的经典治疗方案均为手术切除,前者术后做放疗、化疗[7]。因此术前正确诊断对于手术方案的选择具有重要意义。
3.1 两组肿瘤的MRI征象分析
本组25例多形性胶质母细胞瘤均位于幕上,形态不规则,边界不清。MRI平扫,T1WI呈不均匀低信号,中心信号更低;T2WI呈不均匀高信号,中心可见更高信号,提示坏死、囊变(图1A、B)。肿瘤周围见明显的指套样水肿。一般认为水肿的产生是由于血-脑屏障破坏后血管源性与细胞毒性共同作用的结果[7-8]。增强扫描,实性部分可见明显强化,膨胀性生长者表现为囊壁及壁结节不规则环形明显强化,壁厚薄不均,靠髓质侧较厚,且环内外侧壁不规则,多有切迹及结节(图1C)。其内常伴有出血,有时可形成液平面。瘤内出血是由于瘤细胞高度间变和不成熟性,造成新生血管结构不良,脆性较大,毛细血管内皮细胞结合疏松,易导致血栓形成,引起肿瘤中心血供中断而发生囊变坏死或血管破裂出血。
脑实质间变性室管膜瘤是室管膜细胞或室管膜残余组织起源的肿瘤,多见于幕上,发生于幕上者以囊性多见。MRI信号不均匀是其特点之一。本组18例以囊性为主,轮廓规则,边界清晰。MRI平扫,多表现为T1等-低混杂信号,T2等-高混杂信号(图2A、B)。增强扫描,肿瘤实质部分可轻-中度不均匀强化(图2C)。两组肿瘤均可见血管流空信号,这可能是由于肿瘤供血丰富,新生血管壁较薄,血管阻力较小,致血流速度相对较快导致。
3.2 两组肿瘤DWI信号强度及ADC值对比分析
间变性室管膜瘤大多位于脑室内,发生于脑实质者以囊性多见,在常规MRI上多形性胶质母细胞瘤和间变性室管膜瘤很多病例非常相似,鉴别诊断有一定的困难,而DWI在鉴别两者方面较常规MR具有更高的敏感度、特异度和准确率。DWI可从分子影像学的角度提供水分子微观运动的信息,成为常规MR鉴别二者的必要补充。DWI序列的ADC值能提供病理生理的信息,可区分脑肿瘤的不同成分。DWI在多形性胶质母细胞瘤的应用已成为常规,通过测量胶质母细胞瘤的ADC值有助于确定瘤-脑界面、瘤周水肿程度,以及预测肿瘤的恶性程度,对决定手术区域、放疗范围以及定位活检有一定的临床指导意义。文献报道[9],多形性胶质母细胞瘤的ADC平均值为(0.82±0.13)×10-3mm2/s,而Ⅱ、Ⅲ级星形细胞瘤则为(1.14±0.18)×10-3mm2/s。本组25例多形性胶质母细胞瘤的平均ADC值为(0.87±0.06)×10-3mm2/s,18例间变性室管膜瘤的平均ADC值为(1.15±0.12)×10-3mm2/s,高于多形性胶质母细胞瘤,与文献报道相一致。
本组病例多形性胶质母细胞瘤的瘤体实质ADC值低于间变性室管膜瘤的因素主要有[10-14]:(1)肿瘤的细胞数目和细胞大小:多形性胶质母细胞瘤瘤细胞异型性高,细胞内细胞器数目较多,体积较大,导致细胞内水分子的扩散运动受到限制;(2)多形性胶质母细胞瘤的细胞构成增加,细胞外间隙减小,致水分子运动受限,扩散系数降低,ADC值也随之降低;(3)多形性胶质母细胞瘤内部合并囊变、坏死及出血较常见,这些因素均会引起水分子的扩散运动发生改变。
总之,多形性胶质母细胞瘤与脑实质间变性室管膜瘤的影像表现相比,具有一定的特征性,但也存在一定的交叉。本研究结果显示,两组肿瘤的ADC值有统计学意义。因此,当两者影像学相似时,可通过测定ADC值对多形性胶质母细胞瘤与脑实质间变性室管膜瘤进行鉴别诊断,使其更好地指导临床并为患者预后评估提供依据。
[References]
[1] Ohgaki H, Burger P, Kleihues P. Definition of primary and secondary glioblastoma-response. Clin Cancer Res, 2012, 19(4): 764.
[2] Kanu OO, Hughes B, Di C, et al. Glioblastoma multiforme oncogenomics and signaling pathways. Clin Med Oncol, 2009, 3(3): 39.
[3] Wu YQ, Lin Q, Lan YH, et al. Glioblastoma multimodal MRI manifestations and pathologic histology foundation. Chin J Magn Reson Imag, 2013, 4(3): 196-200.吴裕强, 林祺, 兰玉华, 等. 胶质母细胞瘤多模式MRI表现及其病理组织学基础. 磁共振成像, 2013, 4(3): 196-200.
[4] Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol, 2016, 131(6): 803.
[5] Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumoursof the central nervous system. Acta Neuropathol, 2007, 114(2): 97-109.
[6] Švajdler M, Rychlý B, Zámečn-ík J, et al. Update on the 2016 WHO classification of tumors of the central nervous system-Part 1:Diffusely infiltrating gliomas. Cesk Patol, 2017, 53(1): 12.
[7] Jiang H, Cui Y, Liu X, et al. Patient-Specific Resection Strategy of Glioblastoma Multiforme: Choice Based on a Preoperative Scoring Scale. Ann Surg Oncol, 2017, 24(7): 2006-2014.
[8] Kim HS, Goh MJ, Kim N, et al. Which combination of MR imaging modalities is best for predicting recurrent glioblastoma? Study of diagnostic accuracy and reproducibility. Radiology, 2014, 273(3):831-843.
[9] Huang WY, Yu YQ, Qian YF, et al. MR diffusion weighted imaging tumor edema region ADC values in brain tumors in the differential diagnosis value. J Clin Radiol, 2010, 29(1): 27-30.黄薇园, 余永强, 钱银峰, 等. MR扩散加权成像瘤周水肿区ADC值在脑肿瘤鉴别诊断中的价值. 临床放射学杂志, 2010, 29(1): 27-30.
[10] Lang ZJ, Miao YW, Wu RH, et al. Magnetic resonance imaging (MRI)of the application of new technologies and in the central nervous system tumors. Shanghai: Shanghai Science and Technology Press,2015: 19 -20.郎志谨, 苗延巍, 吴仁华, 等. MRI新技术及在中枢神经系统肿瘤的应用. 上海: 上海科学技术出版社, 2015: 19-20.
[11] Toh CH, Castillo M, Wong AM, et al. Primary cerebral lymphoma and glioblastoma multiforme: differences in diffusion characteristics evaluated with diffusion tensor imaging. AJNR Am J Neuroradiol,2008, 29(3): 471.
[12] Kwee TC, Galbán CJ, Tsien C, et al. Intravoxel water diffusion heterogeneity imaging of human high-grade gliomas. NMR Biomed,2010, 23(2): 179-187.
[13] Elson A, Bovi J, Siker M, et al. Evaluation of absolute and normalized apparent diffusion coefficient (ADC) values within the post-operative T2/FLAIR volume as adverse prognostic indicators in glioblastoma. J Neuro Oncol, 2015, 122(3): 1-10.
[14] Wang H, MA JX, Jia WX, et al. Application of magnetic resonance diffusion tensor imaging in intracranial tumor. Chin Comput Med Imaging, 2011, 17(4): 299-303.王红, 马景旭, 贾文霄, 等. MR扩散张量成像在颅内肿瘤病变中的应用. 中国医学计算机成像杂志, 2011, 17(4): 299-303.

