苦参总生物碱脂质体凝胶的制备及释药机制研究
朱泠音++郑观涛++周昌妮++申延利++韩志芳++贾永艳

摘要:目的 优化苦参总生物碱脂质体的处方与工艺,制备苦参总生物碱脂质体凝胶并研究其释放机制。方法 运用薄膜分散法制备苦参总生物碱脂质体,以包封率和载药量为考察指标,采用酸性染料比色法测定脂质体中苦参碱含量。采用正交试验设计对处方工艺进行优化,选出最优处方制备脂质体。以泊洛沙姆-407为基质,制备苦参总生物碱脂质体凝胶。考察药物凝胶与药物脂质体凝胶的透皮速率。结果 通过优化处方与工艺所得的脂质体形态均匀,粒径范围为100~400 nm,包封率达74%,载药量达26%。所制备的脂质体凝胶呈透明状半固体。体外释放结果显示,苦参碱凝胶48 h内累积释药量为6.34 mg/cm2,苦参总生物碱脂质体凝胶48 h内累积释药量为6.97 mg/cm2,后者的累积透皮量、稳态透皮速率及48 h后在皮肤中的蓄积量均较前者显著提高。结论 优化的制备工艺稳定可行,制得的苦参总生物碱脂质体凝胶质量较好,可有效延缓药物的释放速率,提高药物在体内的蓄积量。
关键词:苦参总生物碱;脂质体;凝胶
DOI:10.3969/j.issn.1005-5304.2017.01.019
中图分类号:R283.5 文献标识码:A 文章编号:1005-5304(2017)01-0077-05
Release Mechanism and Preparation of Liposome Gel of Total Alkaloids of Sophoras Flavescentis Radix ZHU Ling-yin, ZHENG Guan-tao, ZHOU Chang-ni, SHEN Yan-li, HAN Zhi-fang, JIA Yong-yan (College of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China)
Abstract: Objective To optimize the formulation and process of liposome gel of total alkaloids of Sophoras Flavescentis Radix; To prepare the liposome gel of total alkaloids of Sophoras Flavescentis Radix and study its release mechanism. Methods Matrine liposomes was prepared by using film dispersion method; With entrapment efficiency and medicine loading as indexes, acid dye colorimetric method was used for the determination of matrine content in liposomes. Orthogonal design was used to optimize the formulation and the optimal formulation of liposomes was selected. Poloxamer-407 was set as the substrate preparation of matrine liposome gel. The transdermal rate of medicine gel and medicine liposome gel was investigated. Results Obtained through formulation and technology optimization of liposomes formation uniform, particle size was in the range of 100 nm to 400 nm, entrapment 74%, loading 26%. Preparation of liposome gel was transparent semisolid. In vitro results showed, cumulative release dose of matrine hydrogel was 6.34 mg/cm2 within 48 h; cumulative release doses of liposome gel of total alkaloids of Sophoras Flavescentis Radix was 6.97 mg/cm2 within 48 h; cumulative volume, steady-state penetration rate through skin and 48 h volume in the skin of the latter were significantly improved compared with that of the former. Conclusion Optimum preparation is reliable and practical. Liposome gel of total alkaloids of Sophoras Flavescentis Radix made by the preparation is with high quality, which can effectively delay the medicine release rate, increase the volume of medicine in human body.
Key words: total alkaloids of Sophoras Flavescentis Radix; liposomes; gelendprint
苦参总生物碱是苦参、山豆根的主要活性成分,因其具有抗菌消炎、抗病毒杀虫等药理活性,制成凝
基金项目:河南中医学院药学院大学生创新学习项目[YXCX(2014)23]
通讯作者:贾永艳,E-mail:hnzyjyy@126.com
胶涂于黏膜能够用于各种炎症性妇科疾病的治疗[1]。脂质体凝胶是由磷脂、胆固醇及泊洛沙姆-407组成的载药量大、包封率高的药物载体,可增加药物在皮肤滞留时间,有效地将药物通过角质层运送至皮肤更深层或血液循环,适合作为外用给药和经皮给药的载体。为进一步提高药物的治疗效果,充分发挥药效,本研究运用薄膜分散法制备苦参总生物碱脂质体,采用正交试验设计对处方工艺进行优化。通过综合考察指标,选出制备苦参总生物碱脂质体的最优处方。以泊洛沙姆-407为凝胶基质[2],制备苦参总生物碱脂质体凝胶。通过酸性染料比色法测定脂质体及凝胶中苦参总生物碱含量,运用Franz扩散池对其不同释药基质的透皮速率进行研究。
1 仪器、试药与动物
RE-52A型旋转蒸发仪(上海亚荣生化仪器厂),KQ-500DV超声仪(昆山市超声仪器有限公司),J2-MC高速低温离心机(美国Beckman),T6新世纪紫外分光光度计(北京普析通用仪器有限责任公司),BSA124S型电子天平(赛多利斯科学仪器北京有限公司),PHS-3C型精密pH计(上海雷磁仪器厂),涡旋混合仪(美国Scientific Industries),NanoZS90型粒径仪(马尔文仪器),YB-P6智能透皮试验仪(天津市弗兰斯电子科贸有限公司)。
苦参碱对照品(四川省维克奇生物科技有限公司,批号120519,纯度≥98%),卵磷脂(天津市光复精细化工研究所),胆固醇(北京双旋微生物培养基制品厂),泊洛沙姆-407(P407,美国BASF公司,批号50011254),无水乙醇(天津市恒兴化学试剂制造有限公司),溴麝香草酚蓝(天津市致远化学试剂有限公司,称取0.025 g,溶于pH 7.6缓冲液200 mL中,制成溴麝香草酚蓝缓冲液[3]);苦参(河南中原正信药材有限公司,产地河南,批号20110115);氯仿(天津市四友精细化学品有限公司),甲醇(天津市四友精细化学品有限公司),其他试剂均为国产分析纯。
SPF级昆明种小鼠,雄性,体质量(20±2)g,3周龄,河南省实验动物中心,合格证号41003100001652。
2 方法与结果
2.1 苦参总生物碱的制备
取苦参饮片,用8倍量70%乙醇回流提取3次,每次1.5 h,合并提取液,减压浓缩,过滤,过SP825大孔吸附树脂柱,用水洗涤,水洗液弃去,50%乙醇洗脱,收集洗脱液,减压浓缩至浸膏,减压干燥,即得苦参总生物碱提取物,备用。
2.2 苦参总生物碱脂质体的制备
运用薄膜分散法制备苦参总生物碱脂质体。称取卵磷脂和胆固醇适量,加入15 mL无水乙醇,超声溶解后,在旋转蒸发仪上45 ℃、转速5级,除去乙醇溶剂,使卵磷脂和胆固醇的混合物在瓶壁上形成透明均匀的薄膜层。另取适量苦参总生物碱,加pH 6.8磷酸盐缓冲液30 mL,超声溶解后倒入旋转蒸发瓶中,40 ℃搅拌水化一定时间,功率100 W水浴超声10 min,即得乳白色偏黄的苦参总生物碱脂质体混悬液。
2.3 包封率、载药量的测定
2.3.1 对照品溶液的制备 精密量取苦参碱对照品10 mg,置于10 mL容量瓶中,加50%乙醇定容,制成浓度为1 mg/mL的对照品溶液,备用。
2.3.2 检测波长的确定 取对照品溶液20 μL,置20 mL具塞试管中,用酸性染料比色法(加氯仿6 mL、溴麝香草酚蓝缓冲液6 mL,剧烈振摇2 min后转移至分液漏斗,静置1 h,分取下层氯仿层)萃取,将氯仿溶液进行全波长扫描。取苦参总生物碱样品及氯仿适量,同法操作。结果表明,溴代麝香草酚蓝和苦参碱形成的离子对复合物在413 nm波长处有最大的吸收峰,空白处则无吸收,故选择413 nm为苦参总生物碱的测定波长。
2.3.3 标准曲线与线性范围 取“2.3.1”项下对照品溶液0.4、0.8、1.2、1.6、2.0 mL,置10 mL容量瓶中,加蒸馏水定容至刻度,可得浓度分别为0.04、0.08、0.12、0.16、0.20 mg/mL的苦参碱对照品溶液,分别量取0.5 mL上述溶液置20 mL具塞试管中,以氯仿为空白,用“2.3.2”项下酸性染色法测定吸光度。以浓度为横坐标,吸光度(A)为纵坐标,绘制标准曲线,得回归方程Y=2.907 5X+0.068 1(r2=0.999 6)。表明苦参碱在0.04~0.20 mg/mL范围内与其吸光度线性关系良好。苦参总生物碱含量以苦参碱含量计。
2.3.4 样品测定 通过高速离心方法分离游离的苦参总生物碱与苦参总生物碱脂质体。吸取苦参总生物碱脂质体混悬液3 mL,置于超滤离心管中,7500 r/min[4]高速离心30 min,精密量取滤液1 mL置20 mL具塞试管中,以氯仿为空白,用“2.3.2”项下酸性染料比色法测定吸光度,代入标准曲线计算游离药物量(W)。精密吸取0.15 mL脂质体混悬液置于10 mL量瓶中,用甲醇定容,放置1 d破乳后,精密量取上层清液1 mL置20 mL具塞试管中,以氯仿为空白,用“2.3.2”项下酸性染料比色法测定吸光度。代入标准曲线计算脂质体混悬液中总药物量(M)。按下列公式计算包封率和载药量。
包封率(%)=(M-W)/M×100%
载药量(%)=[(M-W)/M+G]×100%(G为卵磷脂与胆固醇的量)
2.3.5 精密度考察 精密吸取同一破乳后的苦参总生物碱脂质体溶液5份,每份1 mL,置20 mL具塞试管中,以氯仿为空白,用“2.3.2”项下酸性染料比色法测定吸光度,计算样品含量,RSD=1.98%,表明精密度良好。endprint
2.3.6 稳定性考察 精密吸取破乳后苦参总生物碱脂质体溶液1 mL,置20 mL具塞试管中,以氯仿为空白,用“2.3.2”项下酸性染料比色法分别在制备后0、10、20、30 min测定吸光度,结果RSD=2.04%,表明苦参总生物碱脂质体溶液在30 min内稳定。
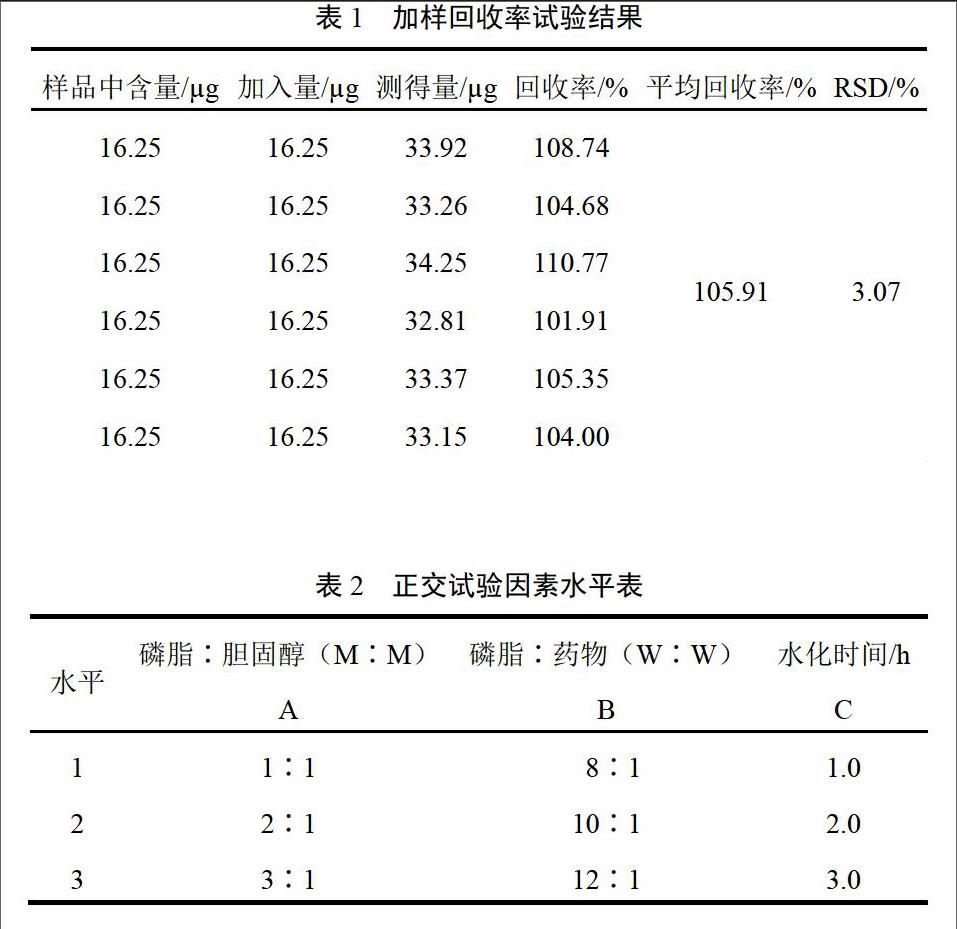
2.3.7 加样回收率试验 精密吸取6份破乳后的苦参总生物碱脂质体溶液0.5 mL,加入苦参碱对照品溶液0.5 mL(浓度32.5 ?g/mL),置20 mL具塞试管中,以氯仿为空白,用“2.3.2”项下酸性染料比色法测定吸光度,计算平均回收率为105.91%,RSD=3.07%,见表1。
2.4 脂质体的处方与工艺优化
根据预试验结果及相关参考文献[4],以脂质体载药量、包封率两者综合作为指标,将对脂质体载药量和包封率有显著影响的磷脂与胆固醇摩尔比(A)、磷脂与药物的质量比(B)、水化时间(C)作为考察因素,设计三因素四水平正交试验,对脂质体的制备工艺进行优化[5],因素水平见表2,试验结果见表3、表4,方差分析见表5。由试验结果可知,影响脂质体包封率和载药量综合考察因素顺序为:磷脂与胆固醇摩尔比(A)>水化时间(C)>磷脂与药物的质量比(B),而影响脂质体包封率和载药量综合考察因素中,A的影响最大,其次是C,因此优化的处方和工艺为A2B3C2。可以得出磷脂与胆固醇的摩尔比为2∶1,水化时间为2 h,磷脂与药物质量比为12∶1,此时苦参碱脂质体的包封率和载药量综合评分最高。在此工艺条件下,制得的脂质体粒径分布范围窄,粒径均匀。
2.5 苦参总生物碱脂质体凝胶与苦参总生物碱凝胶的制备
称取10 mL苦参总生物碱脂质体混悬液,加入2.5 g泊洛沙姆-407,放置于4 ℃冰箱内24 h,使其充分溶胀,制得苦参总生物碱脂质体凝胶剂[6]。称取22.7 mg苦参总生物碱,同法制备苦参总生物碱凝胶剂。
2.6 苦参总生物碱2种释药基质研究
2.6.1 离体鼠皮的制备 断颈法处死小鼠,剔除腹部毛后剥取其皮肤,除去皮下组织和脂肪,生理盐水漂洗干净,泡于生理盐水中,4 ℃冰箱保存,24 h内使用。
2.6.2 扩散池条件 Franz扩散池透皮面积为2.8 cm2,接收池体积为18 mL,磁力搅拌速度为400 r/min,(37±1)℃恒温水浴,接收液为磷酸盐缓冲液(pH 6.5,称取磷酸氢二钠4.369 3 g和磷酸二氢钠1.216 9 g置于100 mL容量瓶中,加水溶解并稀释至100 mL,混匀,即得)。
2.6.3 体外透皮试验 将预处理好的小鼠皮肤固定在扩散池与接收池之间,角质层朝向供给池,接收液液面恰好与皮肤的下层接触,要求接收液与皮肤之间没有气泡。平行做2份,每份给药分别为0.5 g苦参总生物碱脂质体凝胶、0.5 g苦参碱凝胶。开动电磁搅拌器和恒温水浴,并保持速度为400 r/min、温度37 ℃,分别于0.5、1、2、3、4、6、10.5、20、24、48 h将接收液全部取出(同时补充同温、新鲜接收液)[7]。以氯仿为空白,用“2.3.2”项下酸性染色法测定吸光度,代入标准曲线,计算得苦参总生物碱的浓度(Ci),扩散池透皮面积为S,可求得其单位面积的累积释放量(Q)。Q=∑Qi·S-1(i=0.5、1、2、3、4、6、10.5、20、24、48 h)。
将透皮吸收0.5~48 h所得累积释放量Q、待释放量对数Ln(100-Q)及累积释放量对数LnQ与时间t、t1/2、Lnt分别按零级、一级、Higuchi和Ritger-Peppas方程处理,初步研究药物的体外释药类型[8]。
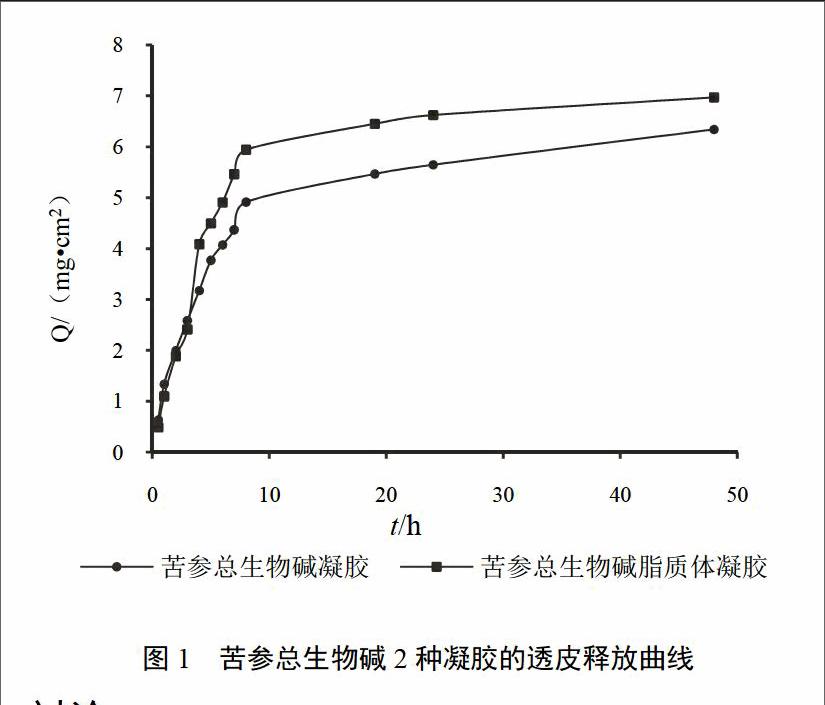
结果表明,将数据进行模型拟合,苦参碱2种凝胶释放拟合Ritger-Peppas模型较其他模型优势明显。苦参碱脂质体凝胶剂:LnQ=0.667Lnt+0.074,r?=0.902,k=1.95;苦参碱凝胶剂:LnQ=0.553Lnt+0.197,r?=0.937,k=1.74。说明苦参总生物碱2种凝胶在体内的释药均遵循Ritger-Peppas释放。苦参总生物碱脂质体凝胶剂与苦参碱凝胶剂相比,在促进药物透过皮肤角质层及皮肤蓄积方面具有显著效果[9]。苦参总生物碱凝胶平均累积蓄积量为0.96 mg,苦参总生物碱脂质体凝胶平均累积蓄积量为1.95 mg,透皮释放曲线见图1。
图1 苦参总生物碱2种凝胶的透皮释放曲线
3 讨论
本研究通过正交试验设计优化苦参总生物碱脂质体的处方和工艺为:磷脂与胆固醇摩尔比为2∶1,水化时间为2 h,磷脂与药物质量比为12∶1。优化工艺条件下制备的苦参总生物碱脂质体大小均匀,包封率和载药量均较高。
在预试验中,测量发现苦参碱在198 nm波长处也有最大吸收,但其溶剂磷酸盐缓冲液在此波长附近有一定吸收,测量时会产生很大程度的干扰,且测量区域位于远紫外区,对紫外测定条件非常不利[10]。运用液相进样测定苦参碱耗时较长,经查阅文献,可用酸性染料比色法测定苦参碱的含量[3],确定413 nm为测定波长,结果令人满意。试验过程中,样品加入氯仿及pH 7.6溴麝香草酚蓝缓冲液后,需要充分振摇,使萃取完全,从而使苦参碱和染色剂形成的离子对转移到有机溶剂中。结果表明,选用酸性染料比色法简便、准确、专属性强,具有良好的线性关系,本方法可用于苦参总生物碱脂质体的处方优化、含量测定、质量控制[11]。
在正交试验前,对因素A、B、C进行了单因素考查,结果表明B中因素12∶1与15∶1无明显差异,且相对于其他因素,对苦参总生物碱脂质体处方与工艺优化的结果不具有明显的意义。因此,虽然12∶1已达到该因素的水平上限,为节约成本,提高载药量,仍决定选用12∶1作为最优方案。
结果表明,脂质体能促进苦参总生物碱透过皮肤,与普通凝胶相比,其累积透皮量、稳态透皮速率及48 h后在皮肤中的蓄积量都有显著提高。这种优势可以使苦参总生物碱脂质体凝胶应用于临床时,既避免了口服制剂的全身不良反应,提高局部药物浓度,透皮效果又高于普通凝胶。本试验为苦参总生物碱脂质体的体内研究奠定了基础。endprint
粒径小于200 nm的脂质体较容易透过皮肤[12],本试验制得的脂质体粒径为158.6 nm,不影响苦参总生物碱脂质体凝胶的透皮效果。苦参总生物碱脂质体凝胶是一个值得研究且用途广泛的药物。
参考文献:
[1] 曾昭武,王小丽.苦参碱醇质体的制备[J].中国组织工程研究与临床康复,2008,12(41):8107-8110.
[2] 郭咸希,何杨虎,何文,等.尼美舒利脂质体凝胶的研制及体外经皮渗透动力学考察[J].中国药学杂志,2008,43(1):35-39.
[3] 杨毅恒,翟所迪.酸性染料比色法测定鞣苦胶囊中苦参总生物碱的含量[J].北京中医药大学学报,2004,27(6):63-65.
[4] 郭海燕,莫穗林.脂质体物理稳定性和包封率的影响因素[J].中国新药杂志,2004,13(6):498-501.
[5] 赵玉美,高鹏飞,刘光明,等.苦参碱制剂的研究进展[J].云南中医中药杂志,2011,32(9):72-74.
[6] 郭咸希,何杨虎,何文,等.尼美舒利脂质体凝胶的研制及体外经皮渗透动力学考察[J].中国药学杂志,2008,43(1):35-39.
[7] 陈志明,宋金春.酮洛芬脂质体凝胶的研制及体外经皮渗透动力学考察[J].中国药师,2009,12(2):159-162.
[8] 谢吉福.改良辅料Ⅱ及其缓释性能的研究[D].广州:广东药学院,2014.
[9] 袁玉霞.复方消痔纳米乳原位凝胶的制备及其质量标准研究[D].郑州:河南中医学院,2014.
[10] 仵文英,刘硕,张抗怀,等.酸性染料比色法测定苦参碱脂质体中苦参碱的含量[J].中国药房,2005,16(22):1734-1735.
[11] 李俐,马颖哲,闫晓凯,等.超氧化物歧化酶脂质体制备方法包封率的比较[J].吉林大学学报(医学版),2003,29(4):535-536.
[12] 赵玉美,高鹏飞,刘光明,等.苦参碱制剂的研究进展[J].云南中医中药杂志,2011,32(9):72-74.
(收稿日期:2015-12-16)
(修回日期:2016-03-21;编辑:陈静)endprint

