富锂锰基材料充电过程中的动态
王雅思,吴 锋,2,张存中,2
(1.北京理工大学化工与环境学院,北京100081;2.国家高技术绿色材料发展中心,北京100081)
王雅思1,吴 锋1,2,张存中1,2
(1.北京理工大学化工与环境学院,北京100081;2.国家高技术绿色材料发展中心,北京100081)
以过渡金属乙酸盐原料,通过溶胶-凝胶法制备了两种富锂锰基正极材料Li[Li0.13Co0.61Mn0.26]O2和Li[Li0.2Co0.4-Mn0.4]O2,采用XRD、SEM和电化学技术对所得样品的结构、形貌及电化学性能进行了表征和分析。结果表明富锂锰基材料为层状固熔体,且一次颗粒粒径为纳米级。采用恒电流法研究充电过程中材料电荷转移阻抗的变化,结果表明:在充电过程中富锂锰基正极材料电荷转移阻抗先增大后减小,当SOC大约在30%~50%时达到最大,分别约为2 164~4 341 Ω和4 254~6 741 Ω,而在其余状态下相对较低。
锂离子电池;富锂锰基材料;电荷转移阻抗;溶胶-凝胶法;正极材料
随着世界能源危机加剧和对环境保护的日益重视,锂离子电池的研究成为各国研究的重点和热点。而富锂锰基材料由于具有价格低廉、比容量高等特点,被认为是未来可代替LiCoO2成为商业电池的材料之一。人们普遍看重电池的安全性能、放电比容量以及循环效率,这其中安全问题是其推广及商业化的限制因素,而热效应是引发安全问题的重要环节因素。通过焦耳定律可知,电池的产热量与电池内阻有密切关系,而电荷转移阻抗()是电池内阻的重要组成部分。人们发现富锂锰基材料的[1-2]差异巨大,其中Li[3]和Singh等人[4]采用EIS发现某些SOC条件下富锂材料的数值非常大,而在4.5 V(相当于SOC=90%处的电压)时达到最小值,然而他们并未得到材料充电全过程的变化。事实上准确、全面了解电极材料充电动态过程中是充分认识电池整体的热行为、安全性和能量转化效率的基本前提之一。一般地由于阻抗测量需要使用专门电化学阻抗测量仪器,而且对阻抗谱的分析涉及较多基本等效电路模型,这样无论测试仪器还是解析方法均不利于广泛采用。如果可以直接使用充放电曲线来评估材料在各个SOC状态下的电荷转移阻,对于认识、评价电极材料性能和整体电池性能则具有广泛的实际意义。本文基于常规充放电曲线对两种富锂材料在不同荷电态下的进行全面评估,目的是建立一种准确、便捷的工业分析方法,并用来衡量充放电过程中高能量密度材料的阻抗变化特征。
1 实验
1.1 材料制备
以CH3COOLi·2 H2O,(CH3COO)2Co·4 H2O,(CH3COO)2-Mn·4 H2O为原料,取计量比为(制备材料A的原料比)和(制备材料B的原料比),并采用溶胶-凝胶法制备前驱体。而后在450℃下煅烧5 h后,研磨成细粉状,再于900℃煅烧15 h,在-20℃下充分淬火后置于干燥器中升温至室温,然后研磨成最终产物作为待测样品。
1.2 材料结构和形貌的表征
材料的微观结构采用Ⅳ-185型旋转阳极衍射仪进行XRD分析,测量条件:Cu Kα辐射,40 kV,100 mA,扫描范围为10°~90°,扫描速度为8(°)/min,步长0.02°;材料微观形貌采用SEM,放大倍率为20 000倍。
1.3 涂片及组装电池
将制备的材料A和材料B、Super-p以及含5.0%PVDF(质量分数)的粘结剂按活性物质∶Super-p∶PVDF=8∶1∶1(质量比)的比例混合均匀,并加入适量NMP溶剂稀释,涂于光滑平整的铝箔上,120℃下真空干燥24 h,然后裁成直径为11 mm的电极极片。以金属锂片做对电极,Celgard 2003多孔聚合物膜为隔膜,1 mol/L LiPF6/(EC+DMC+EMC)(体积比1∶1∶1)的三元混合溶液作为电解液,在氩气手套箱内将材料组装成CR2025型扣式半电池。
1.4 恒电流分析与循环伏安分析
采用LAND电池测试系统对上述扣式半电池进行恒电流充放电循环测试,充放电电压区间为2.0~4.8 V,充放电流密度范围为0.025C~5C(1C=250 mA/g);采用CHI608E电化学工作站测试材料的循环伏安行为。电化学分析均在室温下进行。
2 结果与讨论
2.1 XRD、SEM结果分析
两种材料的XRD如图1所示。
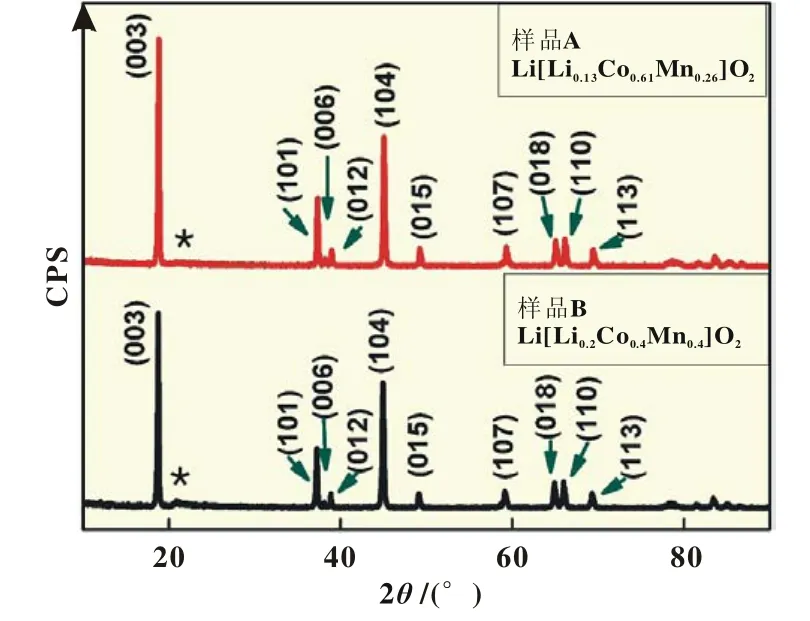
图1 样品A(Li[Li0.13Co0.61Mn0.26]O2)和样品B(Li[Li0.2Co0.4Mn0.4]O2)的XRD图谱
XRD结果表明A材料和B材料均具有α-NaFeO2结构,属R3m空间群,且出现超晶格结构 (见图中*标出的低强度峰),说明具有典型富锂锰基的结构特点。但由于A材料所含Li2MnO3成分少,所以在XRD图中特征峰衍射强度小,特别是含有钴元素的时候更不明显,而B材料所含Li2MnO3成分多,所以XRD图能够清晰看出超晶格特征峰。可以观察到(006)/ (012)和(108)/(110)峰有明显分裂,表明该材料具有很好的二维层状结构。文献[1]报道可以根据(003)与(104)峰强度的比值R的大小来衡量阳离子混排程度,当R<1.2时表明出现阳离子混排,本研究所合成材料(003)与(104)峰强度的比值分别为R=1.757 4和1.551,说明所合成的材料阳离子的有序度较高。在衍射角(2)20°~25°的衍射峰与在过渡金属层LiMn6中的有序排列有关[5]。基于上述XRD结果,我们可以认为所合成的两种材料分别为Li[Li0.13Co0.26Mn0.61]O2(等同于0.3 Li2MnO3· 0.7 LiCoO2,即材料A)和 L i[Li0.2Co0.4Mn0.4]O2(等同于 0 .5 Li2MnO·30.5 LiCoO2,即材料B)。
两种材料的SEM图如图2所示。

图2 样品A(a)和样品B(b)的SEM图谱
结果表明,采用溶胶-凝胶法制备的材料A和材料B一次颗粒较小且均匀,粒径大约在100~250 nm,颗粒表面相对平滑,但有一定的团聚现象。
2.2 两种富锂锰基材料电极的循环伏安行为
在室温下,采用电化学工作站分别测量了两种材料的第一周循环伏安行为,扫描速度分别为0.1、0.2和0.5 mV/s,结果如图3所示。
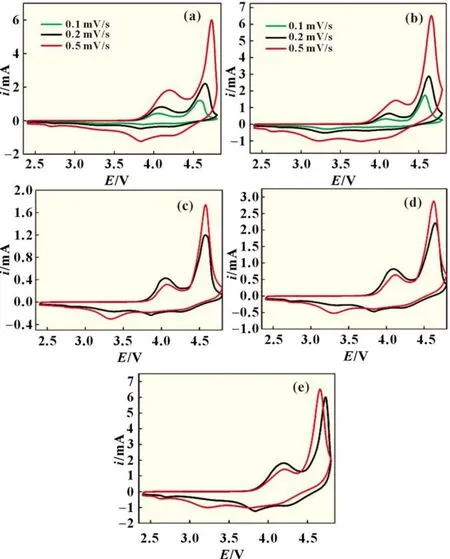
图3 (a)0.3 Li2MnO3·0.7 LiCoO2和(b)0.5 Li2MnO3·0.5 LiCoO2材料分别在扫描速度为0.1,0.2和0.5 mV/s下第一周的CV曲线;扫描速度分别为(c)0.1 mV/s,(d)0.2 mV/s,(e)0.5 mV/s下0.3 Li2MnO3· 0.7 LiCoO2(黑线)和0.5 Li2MnO3·0.5 LiCoO2(红线)的CV曲线
总体上看两种富锂锰基材料的可逆性较差,且随着扫描速度的提高峰电流密度逐渐增大,氧化峰向正向移动,还原峰向负向移动,这些行为与以往研究结果[6]相同。在第一周循环伏安曲线中富锂锰基材料发生氧化,在约4.5 V形成显著的氧化峰,以往的研究[7-8]已经证明该峰是由于富锂材料中Li2MnO3部分被氧化而发生析氧反应所导致的;循环伏安曲线还显示在约4.11 V有另一个氧化峰,该电流被认为是钴元素氧化产生的;在还原过程中,依次在约3.75、3.25和2.75 V三处出现还原峰,它们依次对应钴元素还原、锰元素还原以及Mnn+还原形成类尖晶石结构的过程[2,7]。根据合成条件和XRD结果可知材料B比材料A所含Li2MnO3成分比例较高,所以在相同扫速下析氧反应(约4.5 V)峰电流较大;而材料A较材料B所含LiCoO2成分比例较大,所以材料A在4.1 V左右钴元素氧化峰电流较大;相应的,材料A在3.75 V左右的还原峰较大,在3.25 V左右的还原峰较小,这些都与前人的解释能够很好地吻合。
2.3 倍率及循环性能
分别测量A、B两种材料的倍率性能和循环稳定性结果(图4)。
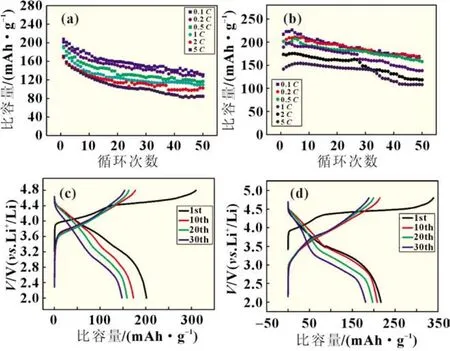
图4 (a)0.3 Li2MnO3·0.7 LiCoO2(材料A)和(b)0.5 Li2MnO3·0.5 LiCoO2(材料B)在不同电流密度下的循环性能;Li//(c)0.3 Li2MnO3· 0.7 LiCoO2和(d)0.5 Li2MnO3·0.5 LiCoO2在0.1C下第1、10、20、30周充放电曲线
总体上看,两种富锂锰基材料的电化学可逆性能均较差,与前人结果[8]基本一致,这意味着无论充电还是放电过程中Rct均非常大。结果还表明,材料A的倍率性能要优于材料B,低倍率充放电时,材料B的首次循环的比容量要优于材料A。由此我们可以认为富锂锰基正极材料中LiMO2部分 (LiCoO2)有利于提高倍率性能,而Li2MnO3部分有利于提高首次循环的比容量。

图5 在0.025、0.05、0.2C循环第三周时(a)A和(b)B材料的充放电曲线
结果表明,当在超低倍率条件下(例如0.025和0.05C)充放电时极化曲线基本维持不变,说明此时最接近平衡电压,即超电势已经非常小。我们在0.025C下得到的充/放电曲线上分别找到荷电态为10%条件下(SOC=10%)的电压数值,以两者的中值电压[E(charge)+E(discharge)]/2作为SOC=10%下的平衡电压。以此类推得到两种材料在SOC为20%~90%下的平衡电压,将平衡电压作为相应SOC状态下的条件平衡电势,将高倍率条件下相应SOC下的电压与平衡电势之差作为超电势,将超电势与放电电流密度对数作图,可以得到某一SOC条件下半对数关系。图6为SOC为30%条件下材料A和材料B的半对数关系,数据点为实验读数。
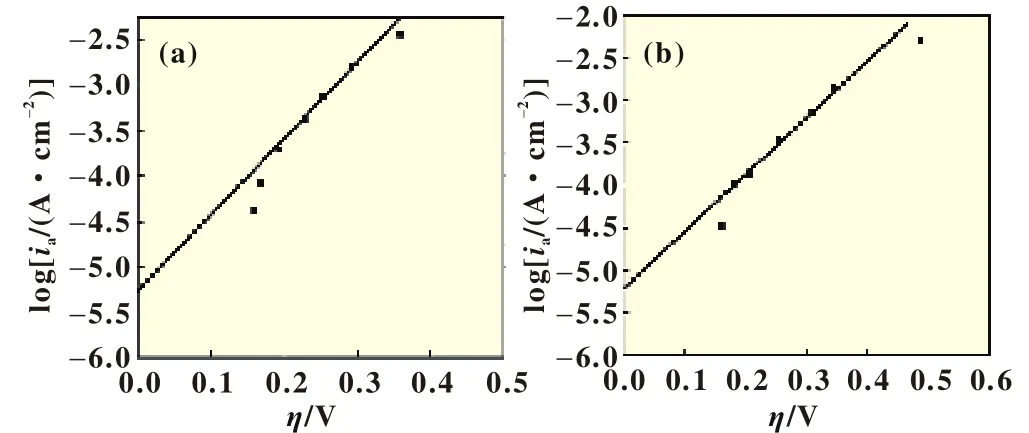
图6 (a)为0.3 Li2MnO3·0.7 LiCoO2充电30%的Tafel图;(b)为0.5 Li2MnO3·0.5 LiCoO2充电30%的Tafel图
结果发现,相同SOC下中等极化倍率条件下超电势与电流密度的半对数之间确实存在直线关系,而在低倍率和高倍率下偏离直线关系。这意味着可以采用Tafel公式(1)处理恒电流测量结果来得到材料在不同荷电状态下的。
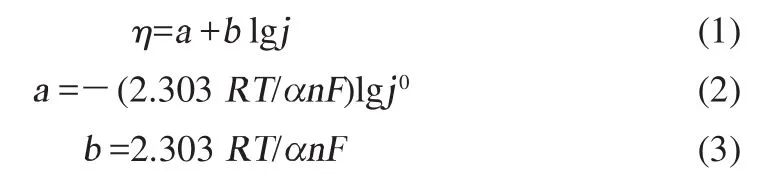
式中:η为超电势;j为电流密度;b为塔菲尔斜率;a为塔菲尔线在电势轴上的截距。
由此可见,我们的结果与Li[3]和Singh等人[4]的研究结果有一定的相似性,另外,我们的结果表明采用充放电曲线可以得到充电动态全过程中的变化趋势,这为准确把握电池总阻抗以及各个阶段的产热速度变化程度提供必要依据。另外,通过与充放电曲线相对照可以发现当SOC=30%~50%时富锂锰基正极材料电位大约在3.80~3.99 V。通过与上文得到的数据以及前人研究[6,9]结果对比,我们还可以发现该电位区间基本处于的电化学氧化还原电位区间,这说明元素的电化学氧化还原速度是比较缓慢的,Wang等人[10]通过中子衍射技术也发现了这个电位区间Mn4+/3+电荷转移速度的迟缓特征,这与表观上出现巨大的之间构成合理的因果关系。对比两种材料的发现材料B(Li2MnO3部分份额高)的高于材料A(Li2MnO3部分份额低)的,这也说明,富锂锰基材料中含Li2MnO3成分份额少有利于降低(提高),从而提高倍率性能,这也与图4所得结论相同。
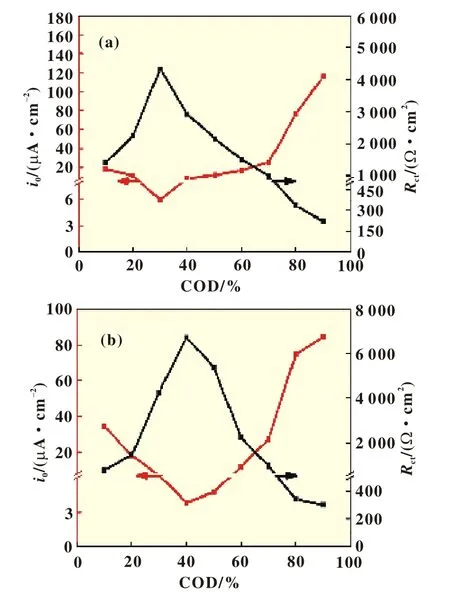
图7 (a)为0.3 Li2MnO3·0.7 LiCoO2充电时交换电流密度、电荷转移阻抗与充放电深度图;(b)为0.5 Li2MnO3·0.5 LiCoO2充电时交换电流密度和电荷转移阻抗与充放电深度图
由斜率[式(3)]得到两种材料能量转移因子(α)与SOC的关系,结果如图8所示。

图8 (a)材料A和(b)材料B在不同荷电态时的能量转移因子α
结果表明,材料A和材料B发生氧化反应的能量转移因子随SOC的变化趋势之间存在差异,而且在某些SOC条件下显著偏离0.5,按照Marcus的观点看,能量转移因子涉及电荷得失核心部分的结构重排以及功函差异,如式(4)所示:

而由于锂离子的嵌/脱过程涉及到固熔体内部有关微观结构,所以α显著偏离0.5意味着固熔体内部有关微观结构在氧化还原前后发生显著的结构重排或者Li+从这些位置上发生移动所伴随的功函差异较大;由于两种固熔体成分之间存在差异,可以发现材料A在大部分SOC范围中α都偏离0.5,而材料B在SOC为40%~80%的范围中α基本维持在0.5,这意味着富锂锰基材料中Li2MnO3部分的份额略高,有利于维持材料的微观稳定性。
3 结论
两种富锂锰基材料在电池充放电过程中,交换电流密度和电荷转移阻抗随荷电态的变化而变化,当荷电态处于30%~50%时阻抗最高,分别约为2 164~4 341 Ω和4 254~ 6 741 Ω,相当于其他荷电态条件下阻抗的2~20倍。结果表明富锂锰基材料中Li2MnO3部分所占份额高有利于提高材料的交换电流密度以及大倍率性能,而LiMO2部分的份额增高则有利于提高材料在低倍率条件下的循环稳定性。
通过传统的恒电流充放电曲线,可以得到两种富锂锰基正极材料在不同荷电态下的基本电化学参数——电荷转移阻抗和能量转移因子,这有利于全面认识富锂锰基正极材料充放电过程中的阻抗行为,也可以为评估阻抗相关的热效应、安全性提供更为准确的电化学依据。
[1]ZHENG J,WU X,YANG Y.A comparison of preparation method on the electrochemical performance of cathode material Li[Li0.2-Mn0.54Ni0.13Co0.13]O2for lithium ion battery[J].Electrochimica Acta, 2011,56(8):3071-3078.
[2]SHI S,LOU Z,XIA T,et al.Hollow Li1.2Mn0.5Co0.25Ni0.05O2microcube prepared by binary template as a cathode material for lithium ion batteries[J].Journal of Power Sources,2014,257:198-204.
[3]LI Z,DU F,BIE X,et al.Electrochemical kinetics of the Li[Li0.23-Co0.3Mn0.47]O2cathode material studied by GITT and EIS[J].The Journal of Physical Chemistry C,2010,114(51):22751-22757.
[4]SINGH G,WEST W,SOLER J,et al.In situ Raman spectroscopy of layered solid solution Li2MnO3-LiMO2(M=Ni,Mn,Co)[J].Journal of Power Sources,2012,218:34-38.
[5]BRÉGER J,JIANG M,DUPRÉ N,et al.High-resolution X-ray diffraction,DIFFaX,NMR and first principles study of disorder in the Li2MnO3-Li[Ni1/2Mn1/2]O2solid solution[J].Journal of Solid State Chemistry,2005,178(9):2575-2585.
[6]LIU G,KONG X,SUN H,et al.Extremely rapid synthesis of disordered LiNi0.5Mn1.5O4with excellent electrochemical performance[J].Ceramics International,2014,40(9):14391-14395.
[7]PARK S H,KANG S H,JOHNSON C,et al.Lithium-manganesenickel-oxide electrodes with integrated layered-spinel structures for lithium batteries[J].Electrochemistry Communications,2007,9(2):262-268.
[8]LIU X,WU J,HUANG X,et al.Predominant growth orientation of Li1.2(Mn0.4Co0.4)O2cathode materials produced by the NaOH compound molten salt method and their enhanced electrochemical performance[J].Journal of Materials Chemistry A,2014,2(36):15200-15208.
[9]YANG T,ZHANG N,LANG Y,et al.Enhanced rate performance of carbon-coated LiNi0.5Mn1.5O4cathode material for lithium ion batteries[J].Electrochimica Acta,2011,56(11):4058-4064.
[10]WANG R,HE X,HE L,et al.Atomic structure of Li2MnO3after partial delithiation and relithiation[J].Advanced Energy Materials, 2013,3(10):1358-1367.
Studies on charge transfer impedance of Li-rich manganese based materials in charging process

Two kinds of lithium rich manganese based cathode materials Li[Li0.13Co0.26Mn0.61]O2and Li[Li0.2Co0.4Mn0.4]O2were successfully synthesized via sol-gel method by using transition metal acetate as raw material.The as-prepared materials were characterized by XRD,SEM and electrochemical performance tests.The result proves the structure of lithium rich manganese based cathode materials are layered solid-solution, and the size of primary particles of materials are nanoscale.The change of charge transferimpedance()of lithium rich manganese based cathode materials during charging in the same cycle was studied through chronopotentiometry.The results indicate that during charging process,reaches maximum values about 2 164~4 341 Ω and 4 254~6 741 Ω respectively,at scope of state-of-charge(SOC)form 30%to 50%and a lower relative value at rest scope of SOC.
lithium-ion battery;li-rich manganese-based material;charge transfer resistance;sol-gel;positive electrode materials
TM 912
A
1002-087 X(2016)03-0503-04
2015-08-27
北京市科学技术委员会专项基金资助项目(Z1311-00003413001);国家重点基础研究发展计划基金资助项目(2014CB932300)
王雅思(1987—),女,河北省人,硕士生,主要研究方向为锂离子电池。
张存中,E-mail:czzhangchem@bit.edu.cn

