2015年国家评价性抽验复方丹参片的质量分析
杨建龙 韩 晶 王 辉 徐 丹 蔡广知 贡济宇*
(1长春市食品药品检验中心中药科室,长春130012;2吉林省食品检验所检验二部,长春130103;3长春中医药大学药物分析实验室,长春130117)
2015年国家评价性抽验复方丹参片的质量分析
杨建龙1韩 晶2王 辉1徐 丹1蔡广知3贡济宇3*
(1长春市食品药品检验中心中药科室,长春130012;2吉林省食品检验所检验二部,长春130103;3长春中医药大学药物分析实验室,长春130117)
目的根据国家评价性抽验任务,对2015年吉林省全省范围内市场中流通的复方丹参片进行质量分析研究。方法根据《中国药典》2010年版第一增补本及《药品补充检验方法和检验项目批件号2008010》对全省范围内抽检的46批复方丹参片进行了全项检验,并对检验结果进行了统计分析与比较。结果按照现行标准检验,样品合格率为97.8%,但是通过对片剂中樟脑成分的检测发现,各厂家中樟脑的含量差异参差不齐。结论吉林省内抽检的46批样品根据现行检验标准检验,只有1批样品不合格,根据检验依据和结果可以认为,当前吉林省内生产、经营、流通使用的复复方丹参片质量较好。但是发现了不少问题,建议有关部门加强对复方丹参片中冰片投料的监管,以保证产品质量。
复方丹参片;国家评价性抽验;质量控制;药品管理
复方丹参片处方由丹参、三七、冰片三味药组成[1],主要用于冠心病、心绞痛以及气滞血瘀所致的胸痹、胸闷、心前区刺痛等,其中丹参为君药,三七为臣药,冰片为佐使药。此处方由上海中药二厂于1975年研制成功[2],1977年版至2015年版《中国药典》均有收载,并收载于《国家基本药物目录》,由于其价格低廉、疗效确切、服用方便,是临床常用的现代中药复方制剂。在国家食品药品监督管理局网站上查询得知,关于复方丹参片的相关记录有685条信息。其中有642家获批生产药企,可见此药的销量之大。本单位按照国家要求,对吉林省内市场中流通的复方丹参片进行国家评价性抽验研究,以便全面的了解省内药品的质量并发现找出存在的问题。
1 药品、试剂与仪器
GR202型电子分析天平(日本AND公司);POWER I型纯水仪(北京普析通用仪器有限公司),Agilent 1260高效液相色谱仪。复方丹参片(46批),丹参酮IIA(批号:110766-200619,20 mg,纯度:98.9%),丹酚酸B(批号:111562-201212,20 mg,纯度:93.7%),三七皂苷R1(批号:110745-200617,20 mg),人参皂苷Rg1(批号:110703-201128,20 mg,纯度:93.4%),人参皂苷Rge(批号:110754-200822,20 mg,纯度:88.8%),人参皂苷Rb1(批号:110704-201223,20 mg,纯度:95.9%),异龙脑(批号:111512-200802,20 mg,纯度:97.5%)龙脑(批号:110881-201107,20 mg,纯度:99.3%)樟脑(批号:110747-201409,20 mg,纯度:98.7%),冰片对照品(批号:110743-200905),三七对照药材(批号:120941-200506),丹参对照药材(批号:120923-201113),以上均来自中国食品药品检定研究院,甲醇和乙腈(色谱纯,Fisher公司),其他试剂为分析纯。
2 抽样情况
本次评价性抽验共计抽取复方丹参片样品46批。抽样单位为吉林省内各地区食品药品监督管理局和食品药品检验所共17个单位。被抽样单位为经营企业29家、制药企业7家、医疗单位10家。生产单位为分布于14个省的22家企业。本次抽检样品的供货单位主要来自于广东、北京、吉林、山东、四川、云南等省市地区。
3 评价标准
本次国家评价性抽验为全项检验,检验的质量标准采用《中国药典》2010年版第一增补本及《药品补充检验方法和检验项目批件号2008010》。
4 评价结果
4.1 性状本品为糖衣片或薄膜衣片,除去包衣后显棕色至棕褐色;气芳香,味微苦。46批样品中,符合规定46批,其中糖衣片6批,薄膜衣片40批。
4.2 鉴别46批样品显微鉴别与薄层鉴别检验结果均符合规定。复方丹参片的制剂工艺为丹参提取物、三七原粉及冰片原粉混合压制成片,因此复方丹参片的显微特征主要为三七的显微特征。实验结果表明,每个厂家的样品均能看到树脂道碎片,所以从46批的复方丹参片中均能鉴别出三七和冰片,与HPLC测定三七结果一致。
4.3 检查异性有机物:视野中除三七原药材显微特征外,均未检出其它植物组织,46批样品均符合规定。三七茎叶皂苷:46批样品中,均符合规定,结果说明样品中并没有违法添加三七茎叶皂苷提取物来替代三七粉。崩解时限:46批样品中,均符合规定。标准中要求60分钟内全部崩解,实验结果发现均在30分钟内全部崩解,说明吉林省内流通的复方丹参片能够较好的崩解。重量差异:46批样品中,均符合规定。樟脑:根据国家药品补充检验方法和检验项目批件号2008010规定,本品每片含樟脑(C10H16O)计,不得大于0.2 mg。43批未检出樟脑色谱峰,3批检出樟脑色谱峰,经过计算含量为0.1 mg/片,在限度之内。均符合规定。
4.4 含量测定丹酚酸B:本品每片含丹参以丹酚酸B (C36H30O16)计,不得少于5.0 mg。46批样品中,全部符合规定,丹酚酸B含量为5.1%~14.6%,其中40批样品含量在6.0 mg/片以上区间,有的样品达到5.0%以上。天津天士力(辽宁)制药有限责任公司生产的复方丹参片丹酚酸B为14.6 mg/片,吉林省通化博祥药业股份有限公司生产的复方丹参片丹酚酸B为5.1 mg/片,前者几乎为后者的三倍。企业原料与生产工艺的不同导致了含量有如此大的差距,企业应该严格控制生产流程,保证生产的稳定性。

图1 丹酚酸B含量比较图
丹参酮IIA:本品每片含丹参以丹参酮ⅡA (C19H18O3)计,不得少于0.20 mg。46批样品中,符合规定样品45批,丹参酮IIA含量为0.25~0.77 mg/片,不符合规定样品1批,不合格率为2.1%。从检验结果可以看出,大部分样品含量均在限度以上,1批样品含量不合格可能是原药材不合格或者生产工艺有问题,丹参酮IIA需要尽量避光才能保证含量达标,也可能丹参原药材被提取过,也可在生产过程中工艺出现问题。

图2 丹参酮IIA含量比较图
三七:本品每片含三七以人参皂苷Rg1 (C42H72O14)、人参皂苷Rb1(C54H92O23)、三七皂苷R1(C47H80O18)及人参皂苷Re(C48H82O18)的总量计,不得少于6.0 mg。
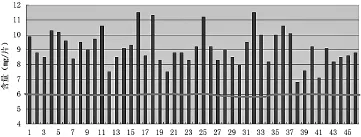
图3 三七含量比较
复方丹参片组方中的三七药材,其比例仅次于丹参,是复方丹参片中的重点中药。在2010年药典之前复方丹参片质量状况堪忧,原因是2010年药典没有收载三七的含量测定项目,加上三七药材比较贵,导致许多不法企业为了谋求最大利益而偷工减料或者用三七茎叶来代替三七药材[3],以劣充优,最终通过完善药典的标准,将三七含量测定纳入到标准、补充检验方法检查三七茎叶皂苷提取物,这两个项目的大力监督,最终推动复方丹参片中三七含量步入正轨。46批样品均符合规定。从检验结果可以看出,全部样品含量均在限度以上,且97.8%的样品含量在7.0 mg/片以上,建议修改三七的含量测定项目,提高三七的含量测定限度。
5 拓展研究
5.1 隐丹参酮、丹参酮IIA测定药典中只规定了复方丹参片中丹参酮IIA的含量限度,而隐丹参酮、丹参酮ⅡA均是复方丹参片中的主要药效成分[4]。为了考察复方丹参片的内在质量,本研究对复方丹参片的药效成分隐丹参酮、丹参酮ⅡA的含量同时进行测定,并对46批复方丹参片进行比较研究。46批样品中,有46批样品含量在0.40 mg/片以上,只有2批样品在0.40 mg/片以下(其中1批丹参酮IIA不符合规定)。此处建议复方丹参片中丹参酮IIA检验项目修改为隐丹参酮与丹参酮IIA的总量作为脂溶性有效成分指标。限度暂定为0.40 mg/片。
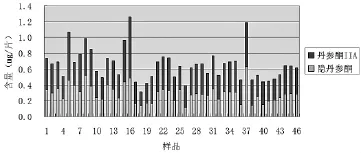
图4 隐丹参酮与丹参酮IIA的比较
5.2 冰片含量测定不同厂家生产的复方丹参片质量和疗效存在很大差异。由于其法定标准中只对丹参的主要成分丹参酮ⅡA和丹酚酸B和三七规定了含量限度,而未对冰片中龙脑与异龙脑规定含量限度,因而不同厂家的产品中冰片含量差别较大。采用气相色谱法测定了多家药厂生产的复方丹参片中冰片含量,并进行了分析比较,为保证其临床用药有效性提供参考。

图5 异龙脑与龙脑含量的比较
从以上测定结果可以看出,46批样品中冰片含量最高2.7 mg/片,最低仅0.15 mg/片,前者是后者的十多倍,差别较大,而按法定标准检验均符合规定,因此很有必要对其含量进行控制,建议严格监管企业关于冰片的投料,建议增订冰片的含量。
5.3 HPLC谱比较针对46批样品进行了HPLC谱图比较。
图6 丹酚酸B的含量测定谱图比较
图7 丹参酮IIA的含量测定谱图比较
对丹参酮IIA和隐丹参酮的含量测定在测定丹参酮IIA时,发现隐丹参酮的色谱峰较大,且隐丹参酮也属于丹参中的有效成分,而复方丹参片现行标准中缺少隐丹参酮的含量测定,为此,探索采用高效液相色谱法同时测定复方丹参片中丹参酮IIA和隐丹参酮的含量测定方法,并进行了方法学验证,取得了满意的结果。
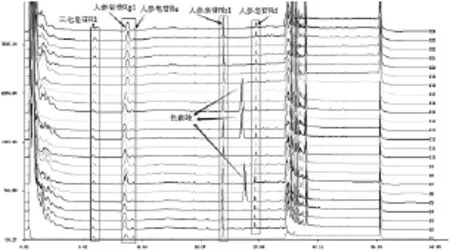
图8 三七的含量测定谱图比较
图8中通过直观观察,三个样品(同一厂家)出现异常色谱峰,其余厂家样品均没有出现此样品峰,经过确认此色谱峰为薄膜衣表面残留的色素峰,此色素为何种色素、是否对人体有害仍需进一步研究。即使无害此色谱峰处于人参皂苷Rb1与人参皂苷Rd之间,干扰判断,建议此厂家更换色素。通过指纹图谱比较可以判断该复方丹参片药品的基本情况,可以通过指纹图谱对复方丹参片建立谱库对样品进行质量评估,可以对大批量样品进行质量评价。复方丹参片的指纹图谱研究需要进一步研究,此处仅供参考。
6 评价与建议
依据检验依据判断,本次评价性抽验共抽取样品46批,合格45批,不合格1批(丹参酮IIA含量不合格)。当前,吉林省内流通和使用的复方丹参片质量较好。复方丹参片处方虽然简单,但是关于复方丹参片的标准从2005年到2015年是一直跟随市场而变化的,要严格控制好经典中成药的质量必须不断的完善药品标准,现在复方丹参片标准中虽然只有三味药,但是已经有6个含量测定成分,一个气相检查成分(樟脑)。各企业之间冰片的含量差别较大,而按法定标准检验均符合规定,因此很有必要对其含量进行控制,建议严格监管企业关于冰片的投料,建议增订冰片的含量。三七的限度为6.0 mg/片,限度较低,46批样品有45批样品在7.0 mg/片以上。隐丹参酮和丹参酮IIA的色谱峰在测定时均比较高,况且隐丹参酮也属于丹参的有效成分。
[1]中国药典委员会.中华人民共和国药典:2010年版第一增补本[M].北京:中国医药科技出版社,201-202.
[2]朱盛山,谢凯,赵磊磊,等.复方丹参缓释片脂溶性成分体外释放度[J].中国中药杂志,2007(23):2557-2560.
[3]费毅琴,杨萍,肖凌,等.HPLC法快速筛查中成药中三七、人参茎叶代替根和根茎[J].中成药,2015,37(8):1730-1733.
[4]李国,林小茹,刘湘,等.丹参酮ⅡA和隐丹参酮的药物代谢动力学研究进展[J].广东医学院学报,2014,32(2):236-237.
Quality Analysis of National Assessment Programs for Compound Danshen Tablets in 2015
YANG Jianlong1,HAN Jing2,WANG Hui1,XU Dan1,CAI Guangzhi3,GONG Jiyu3*
(1.Chinese Medicine department Changchun Center for Food and Drug Control,Changchun 130012,China; 2.Jilin Institute for Food Control,Changchun 130103,China 3.Drug analysis Laboratories,Changchun University of Chinese Medicine,Changchun 130117,China)
Objective According to evaluation of the national drug sampling and testing tasks,circulating in the market Danshen tablets for quality analysis in Jilin Province in 2015.Methods According to Chinese Pharmacopoeia 2010 first supplement and Drug Testing Methods and Complementary Project Approval Document Number 2008010,a province-wide sampling of 46 batches of Salvia tablets were full term tested,and the test results were statistically analyzed and compared.Results Under the current standard test, the sample pass rate was 97.8%,but by the detection of camphor tablets ingredients found differences in the content of the manufacturers of camphor mixed.Conclusion The 46 batches of samples within a sampling of Jilin Province under the existing test standard test,and only one batch of samples failed.According to test results,and based on the view that the current production of Jilin Province,management,compound Danshen tablets in circulation are of good quality.But we found a lot of problems,and recommend relevant departments to strengthen compound Danshen tablet borneol feeding regulation,to ensure product quality.
compound Danshen tablets;evaluation of national drug sample testing;quality analysis;drug management
10.3969/j.issn.1672-2779.2017.01.064
1672-2779(2017)-01-0139-03
李海燕 本文校对:谢鹏飞
2016-06-17)
*通讯作者:gjy0431@126.com

