高效液相色谱—电化学法检测蜜蜂脑部单胺类神经递质及其酸性代谢产物含量
赵晓蒙,苏松坤
(福建农林大学蜂学学院,福建福州350002)
高效液相色谱—电化学法检测蜜蜂脑部单胺类神经递质及其酸性代谢产物含量
赵晓蒙,苏松坤
(福建农林大学蜂学学院,福建福州350002)
建立同时测定蜜蜂脑部神经物质左旋多巴(l-DOPA)、去甲肾上腺素(NE)、3,4-二羟基苯乙酸(DOPAC)、多巴胺(DA)、5-羟吲哚乙酸(5-HIAA)、高香草酸(HVA)和5-羟色胺(5-HT)的高效液相色谱—电化学检测(HPLC-ECD)法.采用Acclaim C18色谱柱,以磷酸二氢钠、辛烷磺酸钠、柠檬酸、乙二胺四乙酸及乙腈的混合液为流动相,流速0.2 mL·min-1,进样量10 μL,柱温38℃,检测电压300 mV.蜜蜂脑组织样品经高氯酸、焦亚硫酸钠和乙二胺四乙酸混合溶液去除蛋白,再由0.22 μm滤膜过滤后上样检测.结果表明:脑组织中各待测神经物质线性回归方程相关系数均大于0.997,加样回收率平均值大于90%,日内、日间精密度指数RSD平均小于5.7%.经初步研究,意大利蜜蜂脑部l-DOPA、NE、DOPAC、DA和5-HIAA的含量分别为(0.232±0.107)、(1.288±0.630)、(2.555±1.201)、(0.574±0.233)、(0.393±0.123)ng·脑-1,中华蜜蜂脑部的对应物质含量分别为(0.331±0.162)、(0.894±0.395)、(2.819±0.974)、(0.636±0.255)、(0.353±0.163)ng·脑-1.
神经递质;液相色谱;电化学;蜜蜂;脑
单胺类神经递质(monoamine neurotransmitters,MNTs)及其酸性代谢产物,是蜜蜂脑内一类重要的神经活性物质,参与调节视觉、嗅觉、学习记忆等神经活动[1,2],因而准确测定蜜蜂脑部相关物质的含量对于认识调控其行为的分子机制具有重要的意义.MNTs主要包括儿茶酚胺和吲哚胺两大类,前者包括肾上腺素(epinephrine,E)、多巴胺(dopamine,DA)和去甲肾上腺素(norepinephrine,NE),后者主要指5-羟色胺(serotonin,5-HT).MNTs的主要酸性代谢产物有3,4-二羟基苯乙酸(3,4-dihydroxyphenylacetic acid,DOPAC)、高香草酸(homovanillic acid,HVA)、5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)[3].左旋多巴(levodopa,l-DOPA)作为儿茶酚胺类神经递质合成过程中的重要中间物,亦被视作动物脑中重要的神经物质而一并检测.目前用于动物脑部MNTs及其酸性代谢产物的检测方法有很多,其中高效液相色谱—电化学检测法(HPLC-ECD)灵敏度高、选择分离性好,被广泛应用于痕量物质的检测.根据本实验室的仪器条件并参考相关文献,建立了一种快速、简便、灵敏的HPLC-ECD方法测定单一蜜蜂脑部MNTs及其酸性代谢物的含量,为进一步研究这种神经活性物质的生理作用奠定基础.
1 材料与方法
1.1 仪器与试剂
超高效液相色谱仪和5041A安培池检测器(Thermo Scientific);Acclaim C18色谱柱(2.2 μm,2.1× 100 mm)(美国戴安公司);高速冷冻离心机(Eppendorf);纯水机(中国科尔顿纯水机MINI-8).l-DOPA、NE、DOPAC、DA、5-HIAA、HVA和5-HT标准品(纯度均>98%,Sigma);甲醇和乙腈(色谱纯,德国默克公司);HClO4和Na2S2O5(Sigma);辛烷磺酸钠(高效液相专用,山东禹王实业有限公司);其余试剂均为分析纯(国药集团化学试剂有限公司).
1.2 溶液的配制
1.2.1 标准品的配制 准确称取一定量的l-DOPA、DOPAC、DA、5-HIAA、HVA和5-HT标准品,用超纯水分别定容至浓度100 μg·mL-1,即为各标准品母液.称取一定量NE标准品用0.1 mol·L-1盐酸溶解,同样配成浓度100 μg·mL-1的母液.临用前取等量各标准品母液制成混合标样,并用超纯水稀释至所需浓度. 1.2.2 蛋白沉淀液的配制 称取一定量的Na2S2O5和EDTA溶解于HClO4溶液,用水稀释为0.4 mol·L-1高氯酸混合溶液(Na2S2O52.6 mmol·L-1,EDTA 2.7 mmol·L-1),即为蛋白沉淀工作液[4].
1.3 色谱条件
流动相的配制:将90 mM NaH2PO4和乙腈按照90∶10(体积比)配成磷酸盐缓冲溶液,然后加入1.7 mmol·L-1辛烷磺酸钠和50 μmol·L-1EDTA,并用柠檬酸调节pH=3.使用前经0.22 μm微孔滤膜过滤,并超声脱气30 min.流速为0.2 mL·min-1,柱温38℃,工作电压为300 mV.
1.4 蜜蜂脑组织单胺类神经递质及其酸性代谢物的提取
将蜜蜂于液氮中冻毙,于干冰与冰的混合物上解剖去除腺体及单复眼色素层的完整脑组织,以一只脑为一个样本,-80℃保存备用.向脑组织样品加入100 μL冰预冷的蛋白沉淀工作液,在冰浴环境下破碎匀浆.13 000 rpm 4℃离心30 min取上清液,用0.22 μm有机型微孔滤膜过滤,10 μL上样检测.
1.5 统计学分析
数据以(±S)表示,采用线性回归最小二乘法计算各单胺类神经递质及其代谢物的标准曲线.
2 色谱条件的优化
2.1 检测电势的选择
本试验所选用的安培检测器的工作原理是在外加电压的作用下,检测待测物在电极表面发生氧化还原反应时的实时电流变化.由于7种待测神经物质发生氧化还原反应的电位不同,选择合适的电势对实现物质分离及精准含量分析非常重要.在流动相、进样量、流速、标准品浓度等因素保持不变的情况下,从50 mV开始,每次升高50 mV,做出峰高(即电流响应)在不同电势条件下的趋势变化图,如图1所示.电势过低,说明待测物尚未被完全氧化,导致电流响应值较低.电势过高,检测噪音增大,同时也增大了共淋洗成分被氧化的可能,给检测带来干扰.最终确定300 mV为检测电势.
2.2 流速与梯度的选择
基于待检测的7种神经物质含量较低,保留时间短,并且选用的色谱柱粒径小,为避免杂质峰干扰检测、检测系统压力过大导致基线不稳定,选取0.1~0.2 mL·min-1进行尝试.结果显示,各物质峰形分离良好.然而流速过低会导致检测时间延长且峰形出现拖尾迹象,因而选择0.2 mL·min-1作为检测流速.流动相的洗脱分梯度洗脱和等度洗脱两种.梯度洗脱通常用于样本成分复杂,较难分离杂质峰与特征峰时使用,或用于缩短检测时间.而在各物质分离较好且保留时间比较接近时,梯度洗脱有可能造成峰形与基线重叠,影响结果的精准程度.基于此,等度洗脱更适合本试验的检测要求.
2.3 标准品、样品稀释液的选择
液相色谱检测通常选用的稀释液有流动相、超纯水及样品处理液.分别用此3种作为溶剂稀释标准品和样品进行检测.样品处理液中包含少量高氯酸作为蛋白沉淀剂,但若选为样品稀释液,增大用量,则高氯酸本身的强酸性和强氧化性可能会对待测神经物质造成影响.对比流动相和超纯水稀释后的色谱图,用流动相作稀释溶剂,左旋多巴与去甲肾上腺素两种物质基线分离效果较差.以超纯水作稀释液,相同浓度待测物特征峰分离度、不对称因子、理论塔板数等指标均好于流动相作稀释液,故本实验选用超纯水作稀释溶剂.
3 结果
3.1 色谱学行为
在本实验条件下,脑组织样品中的各待测物质均得到良好的分离,未见其他杂质因出峰时间相近等原因干扰测定结果,待测物及混合标样色谱图如下,见图2.l-DOPA、NE、DOPAC、DA、5-HIAA、HVA和5-HT保留时间分别为2.2、2.4、3.7、4.3、5.4、8.2和9.1 min.
3.2 线性关系分析及最低检测限
将混合标样用超纯水稀释定容至100、80、60、50、40、30、20、10、5 ng·mL-1,10 μL上样检测,每浓度混合标样平行进样3次.以各组分的已知设定浓度为横坐标,各浓度对应标准物质的峰面积为纵坐标进行线性回归分析,结果如下表1所示.由表看出,混合标样不同进样浓度与各神经物质特征峰峰面积线性关系良好.
以混合标样线性范围最低浓度5 ng·mL-1为初始浓度,减少各神经物质标准品的加入量,配置成浓度依次降低的系列混合标样,按相同的色谱条件进行检测,以信噪比3∶1计,得出各物质的最低检测限,结果如表1所示.
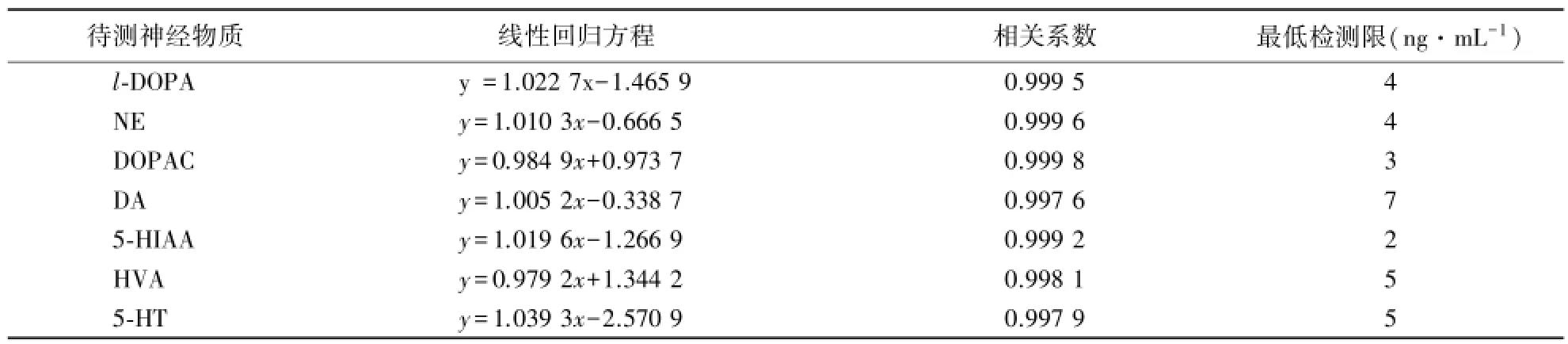
表1 神经物质的线性回归方程、相关系数和最低检测限Table 1 Linear regression equations,correlation coefficients and detection limits of neuro substances
3.3 准确度与精密度
取按上述方法处理的蜜蜂脑组织匀浆液,加入低、中、高浓度的混合标准品工作液(5、10、20 ng· mL-1),按照拟定的检测方法进样检测.于同日内连续进样6次,测定各神经物质特征峰的峰面积,记录结果,计算日内精密度及对应的回收率.按同样方法,连续6 d重复相同实验,测定各神经物质特征峰的峰面积,计算日间精密度及对应的回收率(表2).由于HVA和5-HT在蜜蜂脑中含量较低,所获数据达不到统计要求,因而在后续分析中舍去.由表可知,各物质回收率尚佳,除DA外,其余均在80%以上,RSD值基本维持在10以内,表明精密度良好.
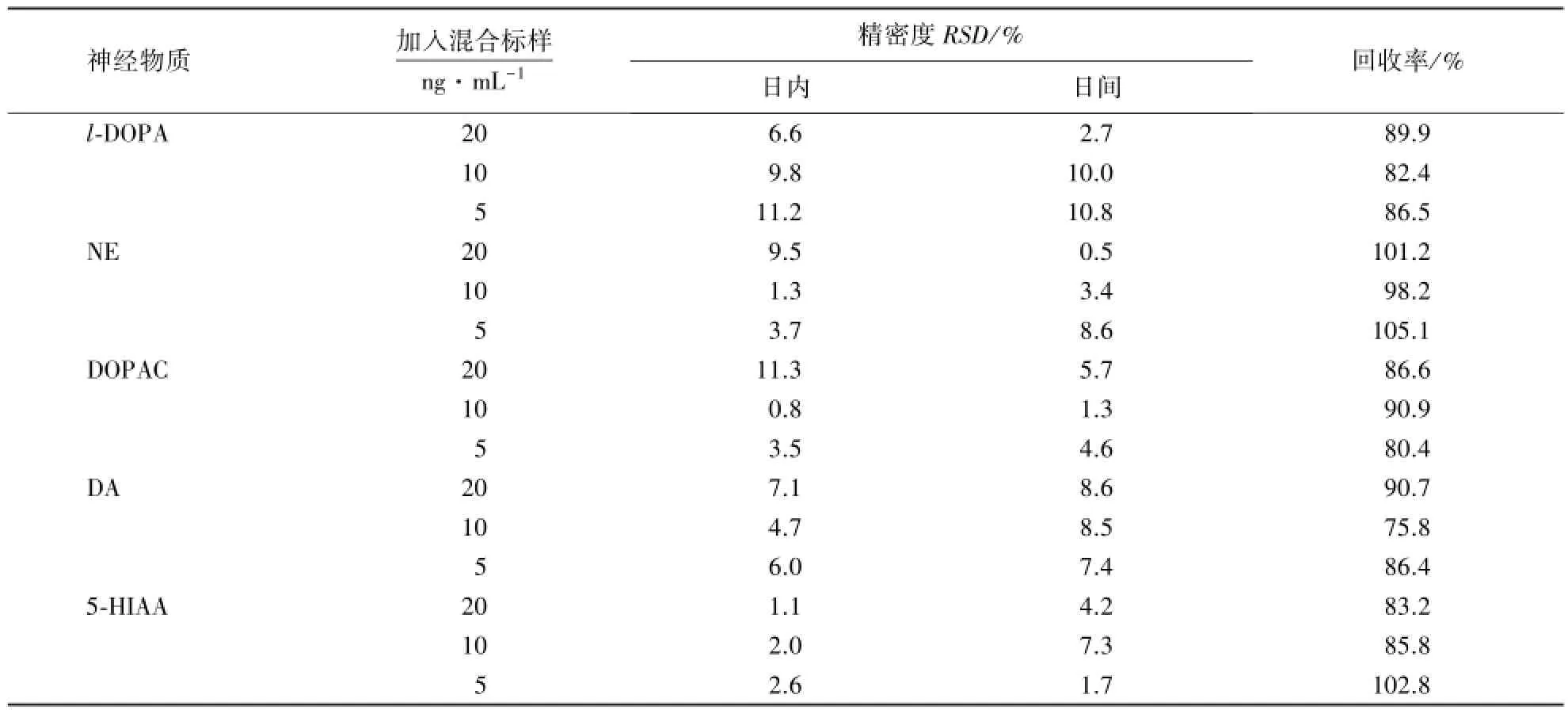
表2 脑组织样品日内、日间精密度及加样回收率Table 2 Results of inter-and intra-day precision and recovery rate of honeybee brain samples
3.4 蜜蜂脑部样品的检测
随机取意大利蜜蜂(Apis mellifera)、中华蜜蜂(Apis cerana)各10只,按上述方法进行样品处理,上样检测.各种神经物质含量结果见下表3.

表3 意大利蜜蜂和中华蜜蜂脑部神经物质含量(ng·脑-1,n=10)Table 3 Contents of neuro substances inApis melliferaandApis cerana
4 讨论与展望
(1)仪器维护:由于分析检测需要,流动相中含有大量的缓冲盐成分,且pH较低,接近一般反相色谱柱pH耐受最低限,长期以此方法进行检测会严重损害色谱柱的柱效.为防止缓冲盐成分在色谱柱内部形成结晶,延长其寿命,使用完毕后分别用10%、50%、100%的甲醇溶液冲洗色谱柱,下次使用前,再反向使用此三种溶液对色谱柱进行活化.
此方法的检测原理为测定液体流经电极表面发生氧化还原反应时的电流响应值,因而电极表面光滑程度、洁净程度关系着检测方法的灵敏度与结果的准确性.随着检测时间的延长,样品与流动相中杂质会逐渐沉积在电极表面,每次检测完毕,应对电极进行清洗.若电极表面沉积物较多,可适当提高分析电势,彻底氧化还原表面残留物,或用特定装置对电极表面进行打磨.
(2)方法评价:较之HPLC-UV、HPLC-荧光等其他检测方法,高效液相色谱联合电化学检测器灵敏度更高,检出限更低,更适于检测脑组织中痕量的单胺类神经递质及其代谢产物的含量.本方法除可在300 mV电压下进行单胺类神经递质及其代谢物的检测,在检测电势700 mV条件下亦可进行章鱼胺的检测.但由于安培检测器选用流经式电极,无法对不同电势响应物质进行一次性测定,而库仑检测器选用穿透式电极,可对同一样品分通道分电压进行检测.针对此种情况,可选用库仑检测器分通道设置不同电压,实现不同电化学活性物质一次性分批次分离测定.
(3)展望:本实验针对蜜蜂脑组织的特点,通过借鉴其他动物脑组织神经物质检测条件,对色谱及电化学的具体参数设置进行摸索.经方法学验证,此检测条件时长短,线性好,精密度及检测限均符合定量统计分析要求.单胺类神经递质及其代谢物参与调控蜜蜂学习记忆[5]、运动[6]、进食[7]、生殖[8]等行为,本文提供的检测方法可同时对单胺类神经递质及其代谢产物进行定量分析,有利于全面了解这些神经物质在蜜蜂行为生理改变时发挥的作用.
[1]MERCER A R,ERBER J.The effects of amines on evoked potentials recorded in the mushroom bodies of the bee brain[J]. Journal of Comparative Physiology,1983,151(4):469-476.
[2]WAGENER-HULME C,KUEHN J C,SCHULZ D J,et al.Biogenic amines and division of labor in honey bee colonies[J]. Journal of Comparative Physiology A,1999,184(5):471-479.
[3]寿天德.神经生物学[M].北京:高等教育出版社,2013:64-65.
[4]BEGGS K T,GLENDINING K A,MARECHAL N M,et al.Queen pheromone modulates brain dopamine function in worker honey bees[J].Proceedings of the National Academy of Sciences,2007,104(7):2 460-2 464.
[5]VERGOZ V,ROUSSEL E,SANDOZ J C,et al.Aversive learning in honeybees revealed by the olfactory conditioning of the sting extension reflex[J].PLoS One,2007,2(3):e288.
[6]MUSTARD J A,PHAM P M,SMITH B H.Modulation of motor behavior by dopamine and the D1-like dopamine receptor Am-DOP2 in the honey bee[J].Journal of Insect Physiology,2010,56(4):422-430.
[7]FRENCH A S,SIMCOCK K L,ROLKE D,et al.The role of serotonin in feeding and gut contractions in the honeybee[J]. Journal of insect physiology,2014,61:8-15.
[8]DOMBROSKI T,SIMÕES Z L P,BITONDI M M G.Dietary dopamine causes ovary activation in queenlessApis melliferaworkers[J].Apidologie,2003,34(3):281-289.
(责任编辑:吴显达)
Applications of high performance liquid chromatography-electrochemical method in content determination of monoamine neurotransmitters and their metabolites in honeybee brains
ZHAO Xiaomeng,SU Songkun
(College of Bee Sciences,Fujian Agriculture and Forestry University,Fuzhou 350002,China)
A method based on high liquid chromatography-electrochemical(HPLC-ECD)was established to simultaneously detect neuro substances in honeybee brains,which included levodopa(l-DOPA),norepinephrine(NE),3,4-dihydroxyphenylacetic acid (DOPAC),dopamine(DA),5-hydroxyindoleacetic acid(5-HIAA),homovanillic acid(HVA)and serotonin(5-HT).Monoamine transmitters and their metabolites were isolated by an Acclaim C18 column(2.2 μm,2.1×100 mm)in 38℃ in mobile phase,which consisted of NaH2PO4,sodium 1-octanesulfonate,citric acid,EDTA and acetonitrile,at a flow rate of 0.2 mL· min-1.After proteins of honeybee brains were precipitated by mixture of perchloric acid,Na2S2O5and EDTA,10 μL supernatant was filtrated with 0.22 μm membrane,and followed by being detected at 300 mV.Results showed that the correlation coefficient of each standard curve was over 0.997,with average relative standard differences(RSD)being less than 5.7%in inter-or intra-day assay for all neuro substances.Average recovery rate was higher than 90%.Contents ofl-DOPA,NE,DOPAC,DA and 5-HIAA inA-pis melliferabrains were(0.232±0.107),(1.288±0.630),(2.555±1.201),(0.574±0.233),(0.393±0.123)ng·brain-1,respectively.The corresponding results inApis ceranabrains were(0.331±0.162),(0.894±0.395),(2.819±0.974),(0.636± 0.255),(0.353±0.163)ng·brain-1,respectively.
neurotransmitter;HPLC;ECD;honeybee;brain
S891.4
:A
:1671-5470(2016)06-0668-05
10.13323/j.cnki.j.fafu(nat.sci.).2016.06.010
2016-01-07
:2016-03-23
国家现代农业产业技术体系(蜜蜂)项目(CARS-45).
赵晓蒙(1989-),女,硕士研究生.研究方向:蜜蜂脑部神经物质对蜜蜂行为的调节.Email:zhaoxm1027@163.com.通讯作者苏松坤(1970-),男,研究员,博士生导师.研究方向:蜜蜂科学.Email:susongkun@zju.edu.cn.

