高山红景天雌株特异性SRAP标记发掘及其关联基因功能分析
王延禹, 周雅卓, 郑大浩, 刘福鹏, 吴委林, 李美善
(延边大学农学院,吉林 延吉 133002)
高山红景天雌株特异性SRAP标记发掘及其关联基因功能分析
王延禹, 周雅卓, 郑大浩, 刘福鹏, 吴委林*, 李美善
(延边大学农学院,吉林 延吉 133002)
以长白山高山红景天雌株、雄株和两性株构建的不同性别植株的DNA集团混池(BSA池),利用相关序列多态性(SRAP)标记技术,发掘雌雄植株特异性SRAP标记,并通过生物信息学分析,阐明与其相关联基因的功能。结果表明:用228个SRAP引物组合在7个BSA池中所检出的1 044条SRAP条带中,仅Me03-Em02 SRAP引物组合在雌株BSA池中获得1条DNA序列长度为678 bp的雌株特异性Me03-Em02 SRAP-DNA片段;该片段属于叶绿体基因组的核骨架scaffold-ZJUL-2062946。Me03-Em02,SRAP-DNA片段作为高山红景天雌株特异性Me03-Em02 SRAP标记与叶绿体基因组上光合代谢途径中的psbE基因相关联;该基因编码的蛋白为细胞色素b559蛋白的α亚基,是一种叶绿体跨膜蛋白。
高山红景天;不同性别植株;SRAP;BSA;基因功能
高山红景天,又名库页红景天(RhodiolasachalinensisA. Bor),为景天科(Crassulaceae)红景天属(RhodiolaL.)多年生草本植物,与林蛙和不老草并称东北新三宝,为东北地区珍稀药用植物之一。高山红景天在其干燥根及根茎中含有红景天苷等18种有效成分[1],具有抗疲劳、抗缺氧、抗衰老、抗辐射、抗病毒、抗肿瘤、提高脑力和体力等多种功效[2]。
据研究,高山红景天不同性别植株的药用成份红景天甙含量存在显著差异,雄性植株显著高于两性植株及雌性植株[3];若能在早期区分雌雄植株,选择富含有效成分的雄性植株,将有利于提高高山红景天的开发利用率。目前,关于高山红景天早期性别鉴定方面的研究非常有限。吴委林等(2005)和李美善等(2009)曾对不同高山红景天性别植株形态和过氧化物酶进行了比较分析,认为虽然不同性别植株的叶长和叶宽在成株期存在极显著差异,但依然不足以有效区分雄株和雌株;而且,不同性别植株在花芽分化、开花期过氧化物酶酶带数及酶量上存在的一定差异,也难以用于早期区分雌雄植株[4-5]。卜媛媛等(2011)利用RAPD与AFLP分子标记在高山红景天不同性别BSA池之间进行扩增,不仅只有1对RAPD引物组合在雄株和两性株上分别扩增出1条约1 200 bp的特异性条,而且重复性不足,稳定性较差;而AFLP引物扩增出的差异条带虽然较多,64对AFLP引物组合共扩增出18条差异条带[6],但依然未能检出雌雄特异的条带。总体上,形态标记与同工酶标记受环境因素影响较大,RAPD标记稳定性较差,而AFLP标记操作繁锁、耗时费力且费用昂贵,故都未能在高山红景天性别早期鉴定中普及应用。
SRAP(Sequence-related amplified polymorphism)标记是一种基于相关序列扩增多态性的新型标记,具有操作简便、重复性好、分离的目标片段便于测序和克隆、共显性标记等优点。该标记技术自2001年开发以来,广泛应用于遗传图谱构建[7-11]、遗传多样性研究[12-18]、功能基因的标记及其克隆等方面[19-25]。由于自然界不同物种、不同个体、控制不同性状的不同基因的内含子变异大、启动子与ORF的间隔区间的长度变化大而存在广泛的多态性,SRAP标记通过独特的双引物设计对基因的ORF(Open Reading Frames,开放阅读框)的特定区域进行扩增,即上游引物位于结构基因的外显子区域,而下游引物位于结构基因的内含子区域和/或启动子区域,故SRAP标记锚定区段与相应的功能基因相关联,属于特定的功能性标记。
迄今为止, SRAP标记在植物性别鉴定方面的应用还比较少,尤其是SRAP标记用于高山红景天雌雄植株鉴定方面的研究未见报道。本研究采用SRAP分子标记技术,在高山红景天不同性别植株中分别进行PCR扩增,并通过目标DNA序列的生物信息学分析,发掘高山红景天雌、雄株相关联的特异性SRAP标记,为高山红景天性别的早期鉴定、性别分化、克隆性别决定基因及单性栽培与育种提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料
2015年6月,在吉林省和龙市福洞镇高山红景天栽培基地(42°30′29.1″N、129°03′19.7″E,海拔811 m),通过花器观察,选取30株高山红景天雌性(Female,缩写为F)植株、30株雄性(Male,缩写为M)和10株两性(Bisex,缩写为BS)植株,以单株为单位分别截取等量干净嫩叶;每10株等量混合,构建雄性和雌性植株各3个BSA池、两性植株1个BSA池,共7个BSA池。
1.1.2 克隆菌株与载体及主要试剂
克隆用菌株为E. coli DH5α;pMD19-T simple vector(T/A克隆载体);所用PCR产物回收试剂盒、质粒回收试剂盒等试剂均购自Omega公司,其它主要试剂均为进口试剂。
1.2 基因组DNA的提取与检测
所取池材料,以BSA池为单位,在液氮中迅速研磨,分装于2 mL离心管中;样品DNA的提取采用Zheng等(2008)的改良尿素法[26]。所提取的DNA,溶解于pH值为8.0的TE缓冲液中,经1%琼脂糖凝胶上检测DNA质量后,利用Quawell Q500检测DNA浓度,然后用TE缓冲液稀释成浓度100 ng/L。
1.3 SRAP引物及PCR扩增
SRAP引物序列选自Li和Quiros(2001)[19]、Ferriol等(2003)[20]和Li等(2003)[21]开发的SRAP引物库(表1),包括12条正向引物和19条反向引物,共组成228对引物组合;所选SRAP引物由Invitrogen公司合成。
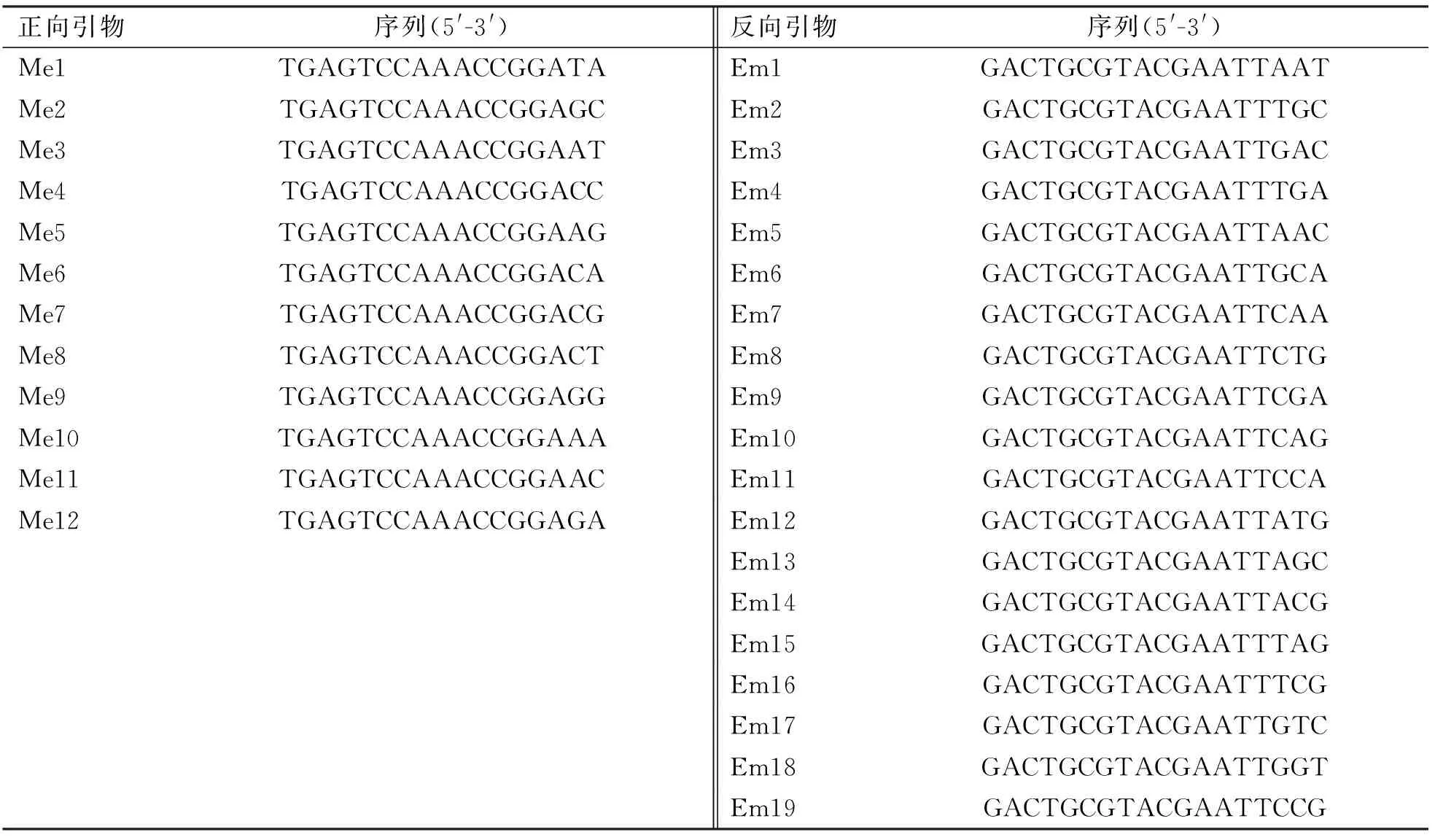
表1 SRAP引物列表及其序列
SRAP-PCR扩增,采用体积为20 μL的反应体系,包含200 ng BSA池DNA、10 μL天根2×PCR Mix、正反向引物各0.5 μM。PCR反应循环为94 ℃预变性3 min,接着94 ℃变性30 s、35 ℃退火30 s、72 ℃延伸1 min、5个循环,之后是94 ℃变性30 s、50 ℃退火30 s、72 ℃延伸1 min、35个循环,最后72 ℃延伸10 min。PCR反应在Eppendorf基因扩增仪上进行。PCR扩增产物在2%琼脂糖凝胶上进行电泳分离,用ZF-258全自动凝胶成像系统进行分析。
1.4 目标DNA片段的回收、克隆与测序分析
经琼脂糖凝胶分离和鉴定后,在凝胶成像仪上从凝胶中分离性别特异的目标DNA片段(PCR产物电泳谱带),按PCR产物回收试剂盒说明书进行操作和回收,然后连接到pMD19-T上获得重组质粒,采用热激法导入到E. coli DH5α感受态细胞中,再经过蓝白斑选择,挑选含有重组质粒的阳性克隆子,送至上海英骏生物工程技术服务有限公司进行测序,用DNAStar7.1和GeneDoc3.2软件进行序列分析。
1.5 特异性片段的测序与生物信息学分析
测序所得DNA序列,利用在线工具BLAST for 1 000 plants (https://www. bioinfodata.org/Blast4OneKP/home)中的mega blast模块进行分析;通过序列比对,搜索同源序列。利用NCBI网站上的在线工具ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/ gorf.html)以及CCD(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和EMBL-EBI网站的在线工具InterProScan(http://www.ebi.ac.uk/interpro/search/sequence-search;jsessionid =C340FBABA89429E901946DBF61C31CBF)对所获得同源序列进行开放阅读框(Open Reading Frame,ORF)及相关基因及由其编码的蛋白质氨基酸序列分析。目的蛋白的理化特性利用在线工具ProtParam tool(http://web.expasy.org/protparam/)分析;目的蛋白信号肽利用在线工具SignalP 4.1Server(http://www.cbs.dtu.dk/services/SignalP/)进行预测;蛋白质亲疏水、跨膜属性等利用TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)进行分析。
2 结果与分析
2.1 SRAP扩增分析
利用228对SRAP引物组合,对7个BSA池进行PCR扩增,共扩增出1 044条带,DNA片段大小为100~1 000 bp;其中,在3个雄株BSA池中扩增出943条带,两性株BSA池中扩增出944条带,雌株BSA池中扩增出907条带。由不同的SRAP引物组合扩增出的条带数为0~13条,平均每对引物扩增出4.58条带。其中,引物组合Me09-Em08扩增出的条带最多,共扩增出13条带;而Me03-Em01、Me03-Em19和Me06-Em17组合未能扩增出清晰条带。
在228对SRAP引物组合中,仅Me03-Em02引物组合在3个雌株BSA池中都扩增出1条雄株和两性株中所缺乏的条带(图1);而Me06-Em02等107个相组合在不同的BSA池中扩增出不同的条带,但在同性别的不同BSA池之间存在差异,缺乏性别特异性(图1)。由于Me03-Em02引物组合在雄株BSA池和两性BSA池中都未能扩增出相应的条带,该引物组合在雌株BSA池中扩增出的条带(即SRAP-DNA片段)可作为高山红景天雌株特异性SRAP标记。
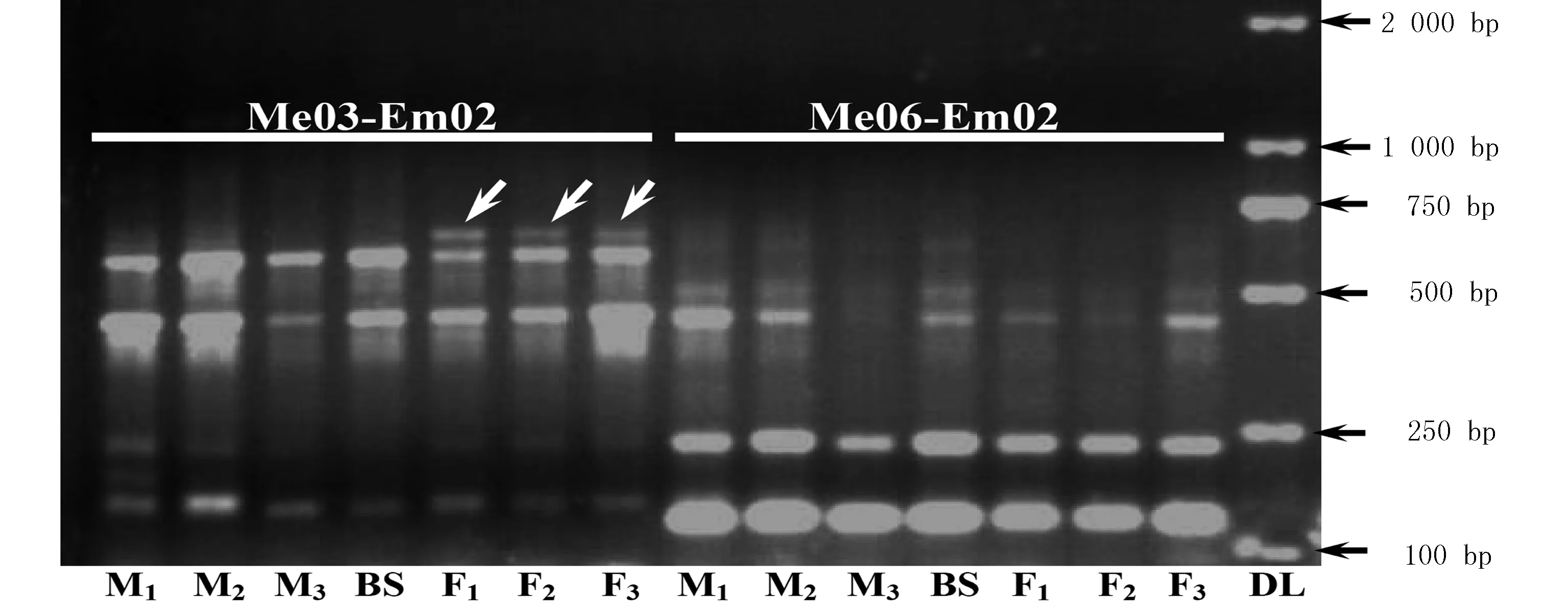
M1~M3分别表示不同雄株BSA池,BS表示两性株BSA池,F1~F3分别表示不同雌株BSA池。箭头表示雌株BSA池中扩增出的特异性DNA条带
图1 Me03-Em02和Me06-Em02引物组合在不同BSA池中的PCR扩增产物
Fig.1 PCR products amplified in different BSA pools with Me03-Em02 and Me06-Em02 primer pairs
2.2 目标DNA序列的同源物种搜索
在3个雌株BSA池中扩增出的雌株特异性Me03-Em02 SRAP标记的PCR产物(图1),测序结果表明,目标DNA序列长度为678 bp,其SRAP引物区间的DNA序列长度为643 bp。针对Me03-Em02 SRAP-DNA片段,利用在线搜索工具BLAST for 1000 plants上的mega blast模块进行物种搜索(表2),表明从高山红景天雌株中分离的目标DNA序列与共享生物信息数据库(Bioinfodata)上的红景天(Rhodiola rosea)的核骨架scaffold-ZJUL-2062946具有极高的序列一致性,同源一致性得分最高(1 115分),显著性水平为0。说明从高山红景天雌株基因组DNA中分离的目标DNA序列包含于已知红景天核骨架scaffold-ZJUL-2062946中。

表2 目标DNA片段的显著一致的核骨架
2.3 雌株特异性Me03-Em02 SRAP标记关联基因搜索
为确定与高山红景天雌株特异性Me03-Em02 SRAP标记关联的目的基因,利用包含引物的Me03-Em02 SRAP-DNA序列与所下载的长度为1 626 bp的Scaffold-ZJUL-2062946序列进行比对搜索(图2)。结果表明,目标DNA序列的反向互补序列与Scaffold-ZJUL-2062946上第731个碱基到第1 380个碱基之间的DNA序列相重叠(图2);Me03-Em02 SRAP-DNA序列横跨Scaffold-ZJUL-2062946上重叠区内存在的1个ORF(位于第589~840碱基)及其上游区序列;高山红景天雌株特异性Me03-Em02 SRAP标记的上游引物位于该ORF的DNA序列中,即位于反向互补序列的下游;而下游引物位于该ORF的上游区段,即位于反向互补序列的上游。与Scaffold-ZJUL-2062946序列相比,Me03-Em02 SRAP标记的正向引物序列中存在9个碱基替换突变,而反向引物中存在1个碱基的插入突变和6个碱基的缺失突变;而且在Scaffold-ZJUL-2062946重叠区ORF的上游区,在该标记上下游引物区间内还存在1个碱基缺失。由于1个ORF对应1个功能基因,本研究中发掘的高山红景天雌株特异性Me03-Em02 SRAP标记是由与其相关联基因的突变所形成的雌株特异性标记。

注:带下划线的浅黑色背景部分表示与Me03-Em02 SRAP-DNA重叠区中存在的开放阅读框(ORF);Me03-Em02 SRAP片段前后两端下划线部分为引物序列
图2 雌株特异性Me03-Em02 SRAP标记与Scaffold-ZJUL-2062946中所含基因的关联性
Fig.2 Association of the female plant specific Me03-Em02 SRAP marker with the gene involved in Scaffold-ZJUL-2062946
2.4 雌株特异性Me03-Em02 SRAP标记关联基因分析
2.4.1 雌株特异性Me03-Em02 SRAP标记关联基因的基因组学定位
为确定高山红景天雌株特异性Me03-Em02 SRAP标记相关联的基因在物种基因组上存在的位置,在NCBI上对核骨架Scaffold-ZJUL-2062946的DNA序列进行基因组学搜索(表3),结果表明Scaffold-ZJUL-2062946属于叶绿体基因组;Scaffold-ZJUL-2062946在叶绿体全基因组上覆盖率为15%。该核骨架与与竹岛景天(Sedum takesimense)叶绿体基因组上同源区的序列一致性高达100%,与其他植物的叶绿体基因组上同源区的序列一致性,也都为98%~99%。在NCBI共享数据库上,并未找到Scaffold-ZJUL-2062946与核基因组相关联的任何信息;说明在Scaffold-ZJUL-2062946上存在的与高山红景天雌株特异性Me03-Em02 SRAP标记相关联的基因属于叶绿体基因。
表3 包含雌株特异性Me03-Em02 SRAP标记关联基因的核骨架Scaffold-ZJUL-2062946的基因组学定位
Table 3 Genomic location of Scaffold-ZJUL-2062946 involving the gene associated with the female plant specific Me03-Em02 SRAP marker
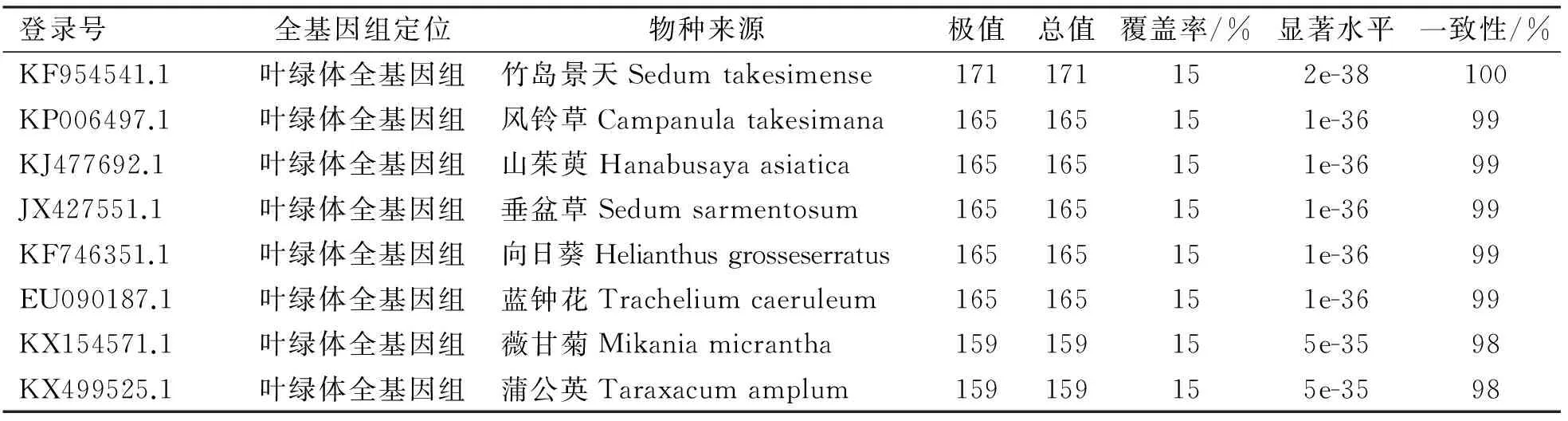
登录号全基因组定位物种来源极值总值覆盖率/%显著水平一致性/%KF954541.1叶绿体全基因组竹岛景天Sedumtakesimense171171152e-38100KP006497.1叶绿体全基因组风铃草Campanulatakesimana165165151e-3699KJ477692.1叶绿体全基因组山茱萸Hanabusayaasiatica165165151e-3699JX427551.1叶绿体全基因组垂盆草Sedumsarmentosum165165151e-3699KF746351.1叶绿体全基因组向日葵Helianthusgrosseserratus165165151e-3699EU090187.1叶绿体全基因组蓝钟花Tracheliumcaeruleum165165151e-3699KX154571.1叶绿体全基因组薇甘菊Mikaniamicrantha159159155e-3598KX499525.1叶绿体全基因组蒲公英Taraxacumamplum159159155e-3598
2.4.2 雌株特异性Me03-Em02 SRAP标记关联基因的生物信息分析
利用NCBI网站上在线工具ORF Finder和专用分析软件DNAStar7.1搜索的结果(图2),在Scaffold-ZJUL-2062946 DNA序列的负链第589~840碱基存在的、与高山红景天雌株特异性Me03-Em02 SRAP标记相关联的开放阅读框(ORF)编码1条由83个氨基酸组成的蛋白质(图3)。

注:浅黑色背景区表示开放阅读框(ORF);实线箭头表示阅读方向
经ProtParam(http://web.expasy.org/)理化特性分析表明(图4-A),该蛋白分子量为9.4 k Da,理论等电点(pI)为4.83,无信号肽;其不稳定系数Instability index (II)为49.93,>40.0,属于不稳定蛋白,无法以自由态存在。亚细胞定位分析表明,该蛋白存在于叶绿体膜上,是一种跨膜蛋白(图4-B);其N-末端第1~19氨基酸位于膜内侧(N-末端位于叶绿体膜的内侧),第20~42个氨基酸为跨膜区,第43~80个氨基酸位于膜的外侧(C-末端位于叶绿体膜外侧),延伸至细胞质中。

图4 与雌株特异性Me03-Em02 SRAP标记关联基因编码的蛋白质亚细胞定位(A)及其跨膜属性(B)
2.4.3 雌株特异性Me03-Em02 SRAP标记关联基因功能
与高山红景天雌株特异性Me03-Em02 SRAP标记相关联基因编码的蛋白,利用NCBI在线分析工具Conserved Domain Search Service (CD Search)模块进行分析(图5),结果表明,高山红景天雌株特异性Me03-Em02 SRAP标记相关联的基因为psbE;它编码细胞色素b559(Cytochrome b559)蛋白的α亚基,该亚基具有Cytochrom_B559超级家族功能结构域和Cytochrom_B559a超级家族功能结构域等2个结构域。从结构域的一致性来讲,其功能与Cytochrom_B559a更加一致。细胞色素b559是光合作用途径中重要的一种蛋白,它通过与血红素和金属离子结合参与光合系统II光反应中的电子传递。

图5 高山红景天雌株特异性Me03-Em02 SRAP标记相关联的基因编码的蛋白的功能
3 讨论与结论
一直以来,由于高山红景天雄性植株的有效成分含量明显高于雌性植株,人们对如何在植株幼苗生长的早期鉴别和区分雌雄植株、选择种植雄性植株进行了诸多尝试,包括通过植株形态学观察、同工酶检测,甚至采用RAPD、AFLP等分子标记技术,进行早期鉴定,但效果均不佳[3-6]。尤其是未能发掘出可直接用于早期鉴定和选择雄性植株的雄株特异性的形态学标记和分子标记。SRAP是一种新型的功能性分子标记;近年来,人们利用该标记技术进行快速定位质量性状单基因与数量性状主效基因,并获得成功;如,Lu等(2014)利用F2群体通过构建2个极端表型的BSA池(每池10株)并进行目标DNA测序,在黄瓜1号染色体Ef1.1区段中鉴定出1个早花候选基因Csa1G651710[25]。
本研究利用高山红景天不同性别植株构成的7个BSA池,从228个SRAP引物组合中发掘到1个雌株特异性Me03-Em02 SRAP标记;该标记与叶绿体基因组上psbE基因相关联。叶绿体psbE基因编码的蛋白是细胞色素b559(Cytochrome b559)蛋白的α亚基,通过与血红素和金属离子结合参与光合系统II光反应中的电子传递,是植物光合作用中必不可少的一种蛋白。
迄今为止,人们从性别决定的基因角度去寻找与雌雄植株相关的特异性分子标记,但并没有任何证据说明雌雄植株间有效成分含量的差异与其性别决定基因直接有关。实际上,高山红景天雄株,不仅有效成分含量高于雌株,而且形态上也与雌株存在差异。在成株期,雄株比雌株叶片狭长且薄,茎秆比雌株细,分枝数多于雌株,地下根茎粗,茎长和茎数等均大于雌株;与之相比,雌株株高比雄株高些,且比雄株健壮,茎秆更加粗壮,叶片更大更厚[4-5]。所以,高山红景天不同性别植株间有效成分含量和外观形态上的差异,根本原因很可能并不在于性别差异本身。本研究中,利用Me03-Em02 SRAP标记在高山红景天雌株池中扩增出的雌株特异的DNA片段,包含psbE基因的部分外显子DNA序列和该基因的上游序列。与包含psbE基因的叶绿体核骨架Scaffold-ZJUL-2062946的DNA序列相比,Me03-Em02 SRAP标记的上游和下游引物序列中均存在碱基替换和/或碱基缺失突变,尤其是上游引物序列中存在1个碱基的插入和连续6个碱基的缺失。这意味着本研究中发掘的高山红景天雌株特异性Me03-Em02 SRAP标记源于其雌株叶绿体基因组中psbE基因的突变。
目前,高山红景天雌株中与其特异性Me03-Em02 SRAP标记相关联的psbE基因序列中存在的突变是否导致高山红景天雌性植株失去psbE基因功能,造成雌株与雄株间的差异,以及psbE基因是否与高山红景天花器的发育有关,这些都还不清楚,待于进一步研究。但由于psbE基因是光合代谢途径中具有重要作用1个基因,高山红景天雌株叶绿体基因组psbE基因的突变很可能会造成雌株和雄株在光合代谢上的差异,进而影响雌株下游次生代谢,并造成高山红景天雌株的有效成分含量低于雄株。
总之,在本研究中发掘出1个高山红景天雌株特异性Me03-Em02 SRAP标记;虽然未能发掘出可直接用于雄株早期鉴定和选择的雄株特异性SRAP标记,但可以借助雌株特异性Me03-Em02 SRAP标记,通过早期鉴定和淘汰雌株,进而对雄株进行间接选择。
[1] 倪付勇,陈重,许琼明,等.高山红景天化学成份研究[J].中草药,2013,44(07):798-802.
[2] 孙英莲,师海波,苗艳波,等.高山红景天的强壮作用[J].中药药理与临床,2004,20(06):19-20.
[3] 张雪莲.高山红景天药用成份含量分析[D].延吉:延边大学,2007.
[4] 吴委林.不同性别高山红景天生物学特性研究[D].延吉:延边大学,2005.
[5] 李美善,许明子,李长军,等.高山红景天不同性别植株形态的比较研究[J].安徽农业科学,2009,37(04):1599-1600.
[6] 卜媛媛.分子标记技术在高山红景天性别鉴定中的应用研究[D].延吉:延边大学,2011.
[7] Li G, Quiros C F.Sequence-related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theoretical and Applied Genetics,2001,103(02):455-461.
[8] Lin Z,Zhang X,Nie Y,et al.Construction of a genetic linkage map for cotton based on SRAP[J].Chinese Science Bulletin,2003,48(19):2063-2067.
[9] 梁小玉,季杨,白史且,等.基于SRAP分子标记构建的菊苣遗传连锁图谱[J].草业学报,2015,24(05):153-158.
[10] Lin Z,Zhang X,Nie Y,et al.Construction of a genetic linkage map for cotton based on SRAP.Chinese Science Bulletin,2003,48 (19):2063-2067.
[11] 潘俊松,王刚,李效尊,等.黄瓜SRAP遗传连锁图的构建及始花节位的基因定位[J].科学通报,2005,15(02):167-172.
[12] Budak H,Shearman R C,Parmaksiz I,et al.Molecular characterization of buffalo grass germplasm using sequence-related amplified polymorphism markers[J].Theoretical and Applied Genetics,2004,108(02):328-334.
[13] Zeng B,Zhang X Q,Lan Y et al.Evaluation ofgenetic diversity and relationships in orchardgrass (Dactylis glomerata L.)germplasm based on SRAP markers[J].Canadian Journal of Plant Science,2008,88(01):53-60.
[14] Li X X,Yang Y H,Deng Z N,et al.Genetic diversity of pummelo germplasm in Hunan Province detected by morphological characters and SRAP markers[C].Wuhan:11th international citrus congress:Program And Abstracts,2008.
[15] Zheng L,Junsong P,Yuan G.et al.Development and fine mapping mapping of three codominant SCAR markers linked to the M/m gene in the cucumber plant (Cucumis sativus L.)[J].Theoretical and Applied Genetics, 2008, 117(08): 1253-1260.
[16] 郭海林,郑轶琦,陈宣,等.结缕草属植物种间关系和遗传多样性的SRAP标记分析[J].草业学报,2009,18(05):201-210.
[17] 周莹洁,王显国,张新全.野牛草种质基于SRAP标记的遗传多样性研究[J].草业科学,2011,28(11):1930-1935.
[18] 刘通,邓崇岭,程玉芳,等.利用SSR和SRAP技术分析广西柑橘种质遗传多样性[J].华中农业大学学报,2016,35(02):23-29.
[19] Li G,Quiros C F.Sequence-related amplified polymorphism (SRAP),a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica[J].Theoretical and Applied Genetics,2001,103(02):455-461.
[20] Ferriol M,Picó B,Nuez F.Genetic diversity of a germplasm collection of Cucurbita pepo using SRAP and AFLP markers.Theoretical and Applied Genetics,2003,107(02):271-282.
[21] Li G,Gao M,Yang B,etal.Gene for gene alignment between the Brassica and Arabidopsis genomes by direct transcriptome mapping.Theoretical and Applied Genetics,2003,107(01):168-180.
[22] Abe A,Kosugi S,Yoshida K,et al.Genome sequencing reveals agronomically important loci in rice using MutMap[J].Nature Biotechnology,2012,30(02):174-179.
[23] Liu C,Yuan D,Zhang X,et al.Isolation,characterization and mapping of genes differentially expressed during fibre development between Gossypium hirsutum and G.barbadense by cDNA-SRAP.Journal of Genetics,2013,92(02):175-181.
[24] Takagi H,Abe A,Yoshida K,et al.QTL-seq:rapid mapping of quantitative trait loci in rice by whole genome resequencing of DNA from two bulked populations[J].The Plant Journal,2013,74(01):174-183.
[25] Lu H,Lin T,Klein J,et al.QTLseq identifies an early flowering QTL located near Flowering Locus T in cucumber[J].Theoretical and Applied Genetics,2014,127(07):1491-1499.
[26] Zheng D H,Van K,Lee S H.Molecular diversity and relationships among elite maize inbreds from US and CIMMYT populations and current heterotic groups in China[J].Hereditas,2008,145(04):182-193.
Functional analysis of the gene associated with the SRAP marker specific to female plants of Rhodiola sachalinensis A. Bor
WANG Yanyu, ZHOU Yazhuo, ZHENG Dahao, LIU Fupeng, WU Weilin*, LI Meishan
(AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China)
BSA pools constructed using female, male and bisexual plants ofRhodiolasachalinensisA. Bor collected from Changbai Mountains as materials, a female plant specific SRAP marker was explored, subsequently the function of the gene associated with the SRAP marker was clarified. The results revealed that, among the 1044 fragments amplified from 7 BSA pools, only one 678 bp SRAP-fragment produced from female plant BSA pools with Me03-Em02 SRAP primer pair was specific to female plants ofRhodiolasachalinensis. The Me03-Em02 SRAP fragment was involved in scaffold-ZJUL-2062946 belonging to chloroplast genome, and the Me03-Em02 SRAP marker was associated with the gene psbE of the chloroplast genome. The polypetides encoded by the gene psbE was α-subunit of Cytochrome b559 was a trasmembrane protein, which was involved in photosynthesis metabolism.
RhodiolasachalinensisA. Bor; different sexual plants; SRAP; BSA; gene function
2016-11-10
吉林省教育厅项目(吉教科合字[2015]第29号);延边大学科研课题(延大科合字[2014]第26号);延边大学博士科研启动基金资助。
王延禹(1991—),男,吉林乾安人,在读硕士,研究方向为玉米分子育种,吴委林为通信作者。
E-mail: wlwu@ybu.edu.cn
1004-7999(2016)04-0283-09
10.13478/j.cnki.jasyu.2016.04.002
S567.239
A

