LGG混悬液吊瓶灌肠疗法和兽药结合治疗幼犬大肠杆菌感染性腹泻
金 东 春
(延边大学农学院,吉林 延吉 133002)
LGG混悬液吊瓶灌肠疗法和兽药结合治疗幼犬大肠杆菌感染性腹泻
金 东 春
(延边大学农学院,吉林 延吉 133002)
为观察鼠李糖乳杆菌(Lactobacillus rhamnosus,LGG)对大肠杆菌感染性腹泻疗效,采用不同剂量的鼠李糖乳杆菌对幼犬吊瓶灌肠和兽药治疗方法结合,以临床治疗处方药为对照,观察治疗5 d后细菌感染性泻的止呕时间、止泻时间、粪便形成时间及治疗后粪便中大肠杆菌和双歧杆菌菌数变化和血常规变化。结果表明:治疗Ⅲ组(1×108CFU/kg鼠李糖乳杆菌)比对照组明显缩短止吐和止泻时间,减少大便次数,且治疗第3天后大便完全成形,WBC、RBC、LY#和GR#均恢复正常。由第4和5天粪便标本中所含细菌菌属检测中发现,治疗Ⅲ组双歧杆菌菌数明显多于观察组幼犬粪便中双歧杆菌(P<0.05)菌属,且其治愈率97.97%(32/33)远远高于对照组治愈率87.88%(29/33)(P<0.05)。由此可见,治疗Ⅲ组(1×108CFU/kg鼠李糖乳杆菌)的治疗效果最明显。
鼠李糖乳杆菌;灌肠治疗;大肠杆菌;腹泻;双歧杆菌
致病性大肠杆菌感染性腹泻是人兽共患的外源致病性大肠杆菌侵入肠道,导致肠道微生态失衡引起消化道疾病症状,故致病性大肠杆菌感染性腹泻的治疗方法近年来越来越受到科研工作者的重视,尤其是微生态治疗方法。因为微生态制剂在肠道内不仅抑制外来侵袭,保护宿主,而且具有调节肠道内平衡,提高机体免疫力的作用[1]。
鼠李糖乳杆菌(Lactobacillusrhamnosus,LGG)为乳杆菌属的革兰氏阳性菌。现阶段研究证明,鼠李糖乳杆菌[2-3],具有肠道黏着率高[4]、定植能力强、调节肠道菌群、预防和治疗腹泻[5]、排除毒素和增强机体免疫力等作用。很多研究报道LGG对大肠杆菌、沙门氏菌有很好的抑菌作用[6-9]。但少有LGG对肠道黏膜的黏附、定植方面的研究报道。
目前国内关于治疗致病性大肠杆菌感染引起的幼犬细菌性腹泻的中西药治疗方法虽然很多,但高效,速效药物较少,并且国内很少有应用鼠李糖乳杆菌的灌肠疗法治疗幼犬大肠杆菌感染性腹泻的相关报道。
本试验借鉴人医治疗方法和前人研究为理论依据,通过LGG配制成无菌生理盐水细菌混悬液,采用吊瓶灌肠和兽药治疗结合的方法治疗致病性大肠杆菌感染引起的幼犬细菌性腹泻,并与兽医临床治疗方法相比较,观察LGG治疗效果。
本文研究了幼犬致病性细菌感染性腹泻临床治疗的新方法,为今后兽医临床工作提供技术支持。
1 材料与方法
1.1 材料
1) 仪器 生物显微镜(OLYMPUS生物显微镜CX31,上海维翰观点科技有限公司)、精密酸度计(PHS-3C,上海仪电科学仪器)、高台式速离心机(HC-2062,安徽中科中佳科学仪器)、智能恒温水浴锅(HW.SY21-KP4 ,北京长风仪器仪表厂)、细菌震荡培养箱(SH2000-DX,深圳是维斯比生物科技发展有限公司)和C02厌氧培养箱。
2) 试验动物 由延边大学动物医院临床诊断为感染致病性大肠杆菌引起急性腹泻的幼犬,3~6月龄(体重0.5~1.3 kg)左右的对照组33条和观察组(Ⅰ、Ⅱ、Ⅲ各33条)。治疗环境为延边大学农学院动物医院治疗室,治疗饲料为犬专用饲料。
3) 药物 ①对照处方药(临床治疗处方药):654-2(0.2 mL/kg)、穿心莲注射液(0.3 mL/kg)、强力解毒敏im(0.3 mL/kg)、碳酸氢钠iv(2.3 mL/kg)、止血敏(1.0 mL/kg)、高能保肝(0.5 mL/次)、V6(2.0 mL/次)、庆大霉素(0.5 mL/kg)、地塞咪松(0.5 mL/kg)、10%葡萄糖酸钙3.0 mL/次)、VC(2.0 mL/次)、注入30 mL(0.9%)复方氯化钠注射液(iv)。②观察组:用0.9%无菌生理盐水配制不同浓度(1×106、1×107、1×108CFU/kg)的鼠李糖乳杆菌(ATCC7469)细菌混悬液。
4) 临床症状 开始吐白色的带泡沫的黏液,弓背,口角流涎;触诊腹部有明显的压痛,空肠粗大,呈橡胶样,不愿动。
5) 临床检测 ①测T:38.6 ℃(平均)、P:120(平均)、R:56;CDV、CPV检测均为阴性;病历幼犬血常规检查血液分析仪(SYSMEx F.800,日本东亚公司)、WBC犬(7 300~18 000)×106/L~RBC(6.3~9.9)×1012/L)、LY#(2.2~5.4)、GR#(7.7~16.1)高于正常值。②实验室检查[10-11]:粪便采样并于实验室培养鉴定出大肠杆菌,但未发现其它细菌、病毒和寄生虫,确诊是大肠杆菌感染性腹泻(大肠杆菌鉴定方法:粪便采样经乳糖发酵、EMB平板选择性培养后,在 EMB平板上37 ℃细菌震荡培养箱里培养24 h后,产生的圆形、边缘整齐、隆起、光滑、黑色带金属光泽菌落,用革兰染色和生物显微镜鉴定为大肠埃希菌)。
6) 观察指标 临床疗效判断标准参照《中药新药治疗泄泻的临床研究指导原则》(2002年版)制定[12]。①治愈:大便性状、次数恢复正常,尿、血常规恢复正常;②显效:大便性状及次数明显好转,全身症状明显改善。大便次数(2~4次/d),近似成形,或便溏而每日仅1次,大便常规及细菌培养复查基本接近正常;③有效:大便性状、次数、血常规及细菌培养复查好转;④无效:大便性状、次数及全身症状均无好转甚至恶化或均无改善。注:采用尼莫地平法计算疗效指数进行疗效判断。疗效指数=[(治疗前症状-治疗后症状)/治疗症状]×100%。
1. 2 方法
1.2.1 治疗方法―灌肠疗法[13](吊瓶灌肠法)
灌药前禁食(不禁水)16 h,将病犬两后肢轻轻提起,前低后高式保定,将涂抹石蜡油的导尿管插入肛门内(不同大小的犬,采用不同型号导管),进行深部灌肠。灌肠前先用6 ℃温水灌肠清除积粪后,将已配制好的30 mL无菌生理盐水LGG细菌混悬液输液瓶高挂起来,打开流速阀,利用高低形成的压力,使药液缓慢注入肠内。每天下午2点灌肠1次,LGG剂量分别为1×106CFU/kg(Ⅰ剂量组)、1×107CFU/kg(Ⅱ剂量组)、1×108CFU/kg(Ⅲ剂量组)
1.2.2 检测大肠杆菌、双歧杆菌总数
称取1 g粪样,加入1 mL稀释液,制成震荡混匀的原液。测双歧杆菌、大肠杆菌的数量及细菌总数。具体测定方法如下:取100 μL匀浆液涂布接种于所需培养基[大肠杆菌数量测定采用山梨醇麦康凯琼脂基础(SMAC)培养基,双歧杆菌数量测定采用双歧杆菌(TPY)琼脂培养基],放入37 ℃培养箱中培养48 h后,选取平均菌落数为30~300的稀释度进行菌落计数,即CFU/g(平均菌落数 ×稀释倍数×10),结果用其对数值,即lg(CFU/g)表示。每个稀释度在每种培养基上做3个重复,取其平均值。
1.3 统计分析
统计学分析结果数据采用SPSS13.0统计分析软件处理,技术资料用2检验,2组间比较用t检验,以P<0.05 判断为差异显著。
2 结果与分析
2.1 比较分析治疗后2组致病性大肠杆菌感染性腹泻临床症状的变化
由表1可知,以兽药治疗为主的对照组治疗2 d后开始止吐、止泻,治疗3 d后大便基本成形;观察组(Ⅰ剂量组)临床治疗效果与对照组相比,缩短了止吐、止泻和大便成形时间;观察组(Ⅱ,Ⅲ)临床治疗效果优于对照组,止吐、止泻和大便成形时间明显缩短(P<0.05);观察组(Ⅲ剂量组)临床治疗效果明显优于对照组(P<0.05)。

表1 对照组,观察组治疗后临床症状变化
注:t检验,与对照组比较,*表示结果差异及显著,P<0.05。
2.2 治愈后LGG对幼犬粪便中回收菌群数目的影响
1) 以兽药治疗为主的对照组治疗5 d后,粪便中大肠杆菌总数为(6.98±0.15)×109,双歧杆菌总数为(5.08±0.15)×106,少于正常值范围细菌菌数。
2) LGG结合兽药治疗5 d后,观察组(Ⅰ、Ⅱ、Ⅲ)粪便中的大肠杆菌总数恢复到正常值范围,而双歧杆菌总数观察组(Ⅰ、Ⅱ、Ⅲ)高于对照组,统计学检查差异显著(P<0.05)(表2)。

表2 治愈后LGG对幼犬粪便中回收菌群数目的影响
注:108表示活菌数,平均值±标准差。*表示结果差异极显著,P<0.05。
2.3 对照组和观察组(Ⅰ、Ⅱ、Ⅲ)治疗致病性大肠杆菌感染性腹泻疗效比较
由表3可知,观察组(Ⅲ)总治愈率(97.97%)明显优于对照组总治愈率(87.88%),且有显著性差异(P<0.05)。
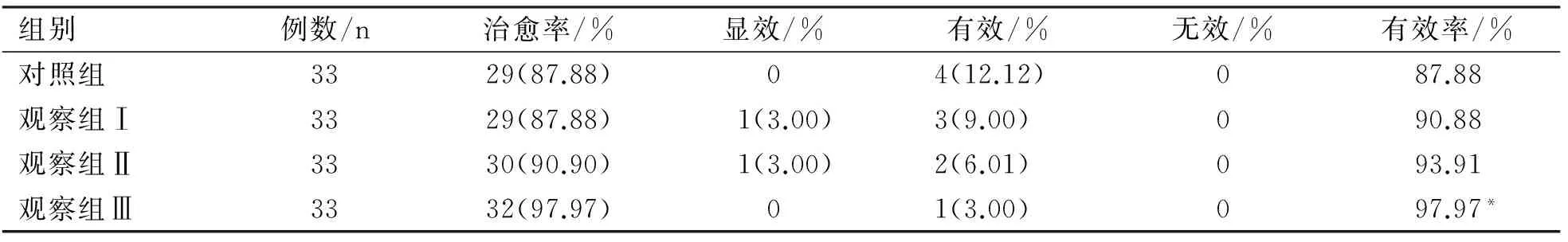
表3 对照组.观察组的疗效比较(n=33)
注:t检验,与对照组比较,*表示结果差异及显著,P<0.05。
2.4 对照组和观察组(Ⅰ、Ⅱ、Ⅲ)治疗后安全性检查
对照组和观察组(Ⅰ、Ⅱ、Ⅲ)治疗后,血常规检测结果,WBC、RBC、 LY#和GR#均恢复正常。

表4 两组治疗后安全性检测(n=33)
3 讨论与结论
本研究结果表明,治疗致病性大肠杆菌感染引起的幼犬细菌感染性腹泻,经LGG混悬液吊瓶灌肠疗法和兽药结合方法治疗5 d后,观察组(Ⅲ剂量组)总治愈率(97.97%)远远高于对照组(87.88%),疗效也明显优于对照组,而且治愈的幼犬粪便采样检测细菌总数,观察组的双歧杆菌细菌总数[Ⅱ,Ⅲ分别为(6.26±0.18)×106和(6.36±0.08)×106]明显高于对照组[(5.80±0.54)×106],统计学检验差异显著(P<0.05),说明LGG能够在幼犬肠道内黏附定植和存活,并有调节肠道菌群平衡的作用。
在此研究基础上,用LGG细菌混悬液、葡萄糖酸钙锌口服液和430 μg/mL烟酸同时灌肠,研究致病性大肠杆菌感染引起的幼犬细菌感染性腹泻,结果止吐、止泻和大便成形时间比对照组长1~2 d,但粪便成形后形态(含水比率)和精神状态都优于对照组,而且治愈率(96.31%)也远高于对照组(87.88%)。进一步证实LGG能够在幼犬肠道内黏附定植和存活,并具有调节肠道菌群平衡的作用。
综上所述,LGG对治疗致病性大肠杆菌感染引起的幼犬细菌感染性腹泻有疗效。深入研究LGG调节肠道菌群,增殖有益菌群,重建肠道生物屏障,抑制大肠杆菌感染性腹泻的致病菌作用,可为临床应用提供坚实的理论基础。
[1] Zuhuillaga M,Weill R,Postaire E,et a1.Effect of probioties and functional foods and their use in different diseases[J]. Nutr Res,2001,21:569-579.
[2] Ewaschuk J B,Naylor J M,Zello G A.Lactobacillus rhamnosus strain GG is a potential probiotic for calves[J].Can Vet J, 2004,68:249-253.
[3] Weese S J,Anderson M E C.Preliminary evaluation of Lactobacillus rhamnosus strain GG,a potential probiotic in dogs[J]. Can Vet J,2002,43:771-774.
[4] Mack D R,Ahme S,Hyde L,Wei S,et al.Extracellular MUC3 mucin secretion follows adherence of follows adherence of Lactohacillus to intestinal epithelial cells in Vitro[J].Gut,2003,52(06):827-833.
[5] Isolauri E,Juntunen M,Rautanen T,et al.A human Lactobacillas strain GG(Lactobacillas caseisp.strain GG)promotes recove from acute diarrhoea in children[J].Pediatrics.1991,88(01):90-97.
[6] Mack D R,Ahme S,Hyde L,et al.Extracellular MUC3 mucin secretion follows adherence of follows adherence of Lactohacillus to intestinal epithelial cells in Vitro[J].Gut, 2003,52(06):827-833.
[7] Makras L,Triantafyllou V,Fayol-Messaoudi D,et al. Kinetic analysis of the antibacterial activity of probiotic lactobacilli towards Salmonella enterica semvar Typhimurium reveals a role for lactic acid and other inhibitory compounds[J].Research in Microbiology,2006,157(03):241-247.
[8] Nilkoskelainen S,Salminen S,Bylund G. Characterization of the properties of human and dairy-deriVed probiotics for prevention of infectious diseases in fish[J].Applied and Environmental Microbiology,2001,67:2430-2435.
[9] Wiedemann I,Benz R,Sahl H G.Lipid II mediated pore formation by the peptide antibiotic nisin:a black lipid membrane study[J].Journal of Bacteriology,2004,186:3259-3261
[10] 东秀珠,蔡妙英.常见细菌系统签定手册[M].北京:科学出版社,2001:350-362.
[11] 高新菊,侯羽浓,姚大伟,等.犬致病性大肠杆菌的分离与鉴定[J].畜牧与兽医,2014(11):87-89.
[12] 郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002.
[13] 金恩鸿,梁晚枫,鞠重基,等.8味中药复方灌肠治疗犬非感染性腹泻[J].延边大学农学学报.2015,37(04):344-348.
The treatment of LGG suspension clysis combined with veterinary medicine on infectious diarrhea of Escherichia coli in puppies
JIN Dongchun
(AgriculturalCollegeofYanbianUniversity,YanjiJinlin133002,China)
In order to observe the effect of rhamnosus LGG (Lactobacillus) on the treatment of infectious diarrhea ofEscherichiacoli, different doses of LGG combined with the treatment of veterinary medicine was used. Clinical prescription drugs as control, the antiemetic time, antidiarrheal time, stool formation time of bacterial diarrhea, and count changes ofE.coliandbifidobacteriain feces, the changes of blood rountine after treatment of 5 days were observed. The results showed that the antiemetic and antidiarrheal time in the treatment group (1×108CFU/kg ofLactobacillusrhamnosus) was significantly shorter than the control group, stool frequency reduced, stool was fully formed on 3d after treatment, WBC, RBC, LY# and GR# were normal. The number ofbifidobacteriain feces of puppies of the treatment group III was significantly more than the control group on 4d and 5d (P<0.05), the cure rate was 97.97% (32/33) , it was higher than that of 87.88% (29/33) of control group (P<0.05). It showed that the effect of the treatment group III (1×108CFU/kgLactobacillusrhamnosu) was the most obvious.
Lactobacillusrhamnosus;enema therapy;Escherichiacoli; diarrhoea;bifidobacterium
2016-10-06
金东春(1969—),男(朝鲜族),吉林和龙人,高级实验师,博士,研究方向为动物营养与中兽药开发。
1004-7999(2016)04-0337-05
10.13478/j.cnki.jasyu.2016.04.010
S858.292
A
——W 字幼犬队

