Cr掺杂对富锂锰基正极材料Li1.2Ni0.2Mn0.6O2结构和电化学性能的影响
张志强,征圣全,王起亮,窦爱春,苏明如,刘云建
(江苏大学材料科学与工程学院,江苏 镇江 212013)
Cr掺杂对富锂锰基正极材料Li1.2Ni0.2Mn0.6O2结构和电化学性能的影响
张志强,征圣全,王起亮,窦爱春,苏明如,刘云建
(江苏大学材料科学与工程学院,江苏 镇江 212013)
采用共沉淀-高温固相合成法制备锂离子电池正极材料Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)。利用X射线衍射(XRD)、扫描电镜(SEM)、恒电流充放电测试和电化学交流阻抗谱(EIS)对掺杂不同Cr含量的正极材料的结构、形貌和电化学性能进行分析测试。结果表明:制备出的Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2正极材料均具备层状固溶体结构。Cr掺杂不会改变材料的结构,而且能够有效抑制循环过程中材料由层状向尖晶石结构转变的过程。当Cr的掺杂量为8%(即x=0.08)时,得到的正极材料Li1.2Ni0.16Mn0.56Cr0.08O2具有最好的电化学性能。0.1C的首次放电比容量由未掺杂的230.4 mA·h·g−1增加到246.6 mA·h·g−1,在0.2C电流下50次循环后的容量保持率由93.5%提高至95.36%,5C的放电比容量由91.5 mA·h·g−1增加到104.2 mA·h·g−1。而且x=0.08时制备的样品具有最小的电荷转移阻抗。
锂离子电池;正极材料;富锂锰基;Li1.2Ni0.2Mn0.6O2;Cr掺杂
Key words: lithium-ion battery; cathode material; lithium- and manganese-rich; Li1.2Ni0.2Mn0.6O2; Cr-doping
引 言
近年来,富锂锰基层状材料xLi2MnO3·(1−x)LiMO2(M=Mn, Ni, Co, Cr等)由于比已经商业化应用的LiCo2等正极材料有更高的放电比容量(>250 mA·h·g−1)、更宽的工作电压范围(2.0~4.8 V)、更低的成本以及更好的安全性等优点而开始受到广泛关注[1-5],被认为是一种比较有前景的锂离子电池正极材料。其中 LiMnO3和LiNi0.5Mn0.5O2按摩尔比1∶1组成的Li1.2Ni0.2Mn0.6O2被证明是最具应用前景的正极材料之一[6],但是目前还存在很多问题阻碍其商业化发展,主要存在以下几个方面:①首次不可逆容量损失较大。只有当充电到较高电位(>4.5 V)时,该材料才会表现出高的放电比容量,但其首次充放电过程中的脱锂脱氧过程不可逆,而且高电压加剧电极材料与电解液之间的反应,因而导致其有较大的不可逆容量损失;②倍率性能差。因为材料中Li2MnO3的活性不高,离子导电率较低,在 18~400℃间的离子导电率仅为10−6~10−13S·cm−1,为电子的不良导体,对材料的电化学性能不利[7];③循环过程中容量衰减较快,高充电电位易导致电解液的不稳定,电解液易发生氧化,反应生成 HF对电极材料表面有腐蚀作用,导致材料在长期充放电过程中容量不断衰退[8-10];④循环过程中结构不稳定。Ni2+作为材料中充放电容量的主要提供者,容易与具有相似离子半径的 Li+在过渡金属层和锂层中进行混排,导致材料的热稳定性和循环稳定性变差,促使正极材料随着循环过程的进行,逐渐由层状结构向尖晶石结构转变[11-12]。
针对上述缺陷,目前研究者主要通过与其他材料进行复合、表面包覆修饰、掺杂金属阳离子以及颗粒纳米化等方式对其进行改性研究,来提高其电化学性能,使其能够更加接近大规模商业应用的要求[13-15]。掺杂改性主要是部分掺杂元素在循环过程中迁移到锂层,抑制Mn向锂层的迁移从而提高材料的结构稳定性和循环稳定性[16]。常用的离子有Mg2+、Al3+、Cr3+、Mo6+和 Ti4+等。朱伟雄[17]采用溶胶-凝胶法对Li1.2Ni0.2Mn0.6O2进行Cr掺杂,掺杂Cr的材料相比于未掺杂之前的性能得到提高,但是其充放电容量较低。因此本文拟采用氢氧化物共沉淀法制备出一系列正极材料Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12),利用Cr3+代替部分的Ni2+和Mn4+,增加材料的结构稳定性,以期能够改善材料的电化学性能。采用 X射线衍射、扫描电镜、半电池的充放电测试及电化学阻抗测试等方法来考察 Cr掺杂量对富锂锰基固溶体正极材料Li1.2Ni0.2Mn0.6O2形貌、结构及性能的影响。
1 实 验
1.1 材料的制备
根据正极材料 Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)的化学计量比将四水乙酸锰(C4H6MnO4·4H2O)、四水乙酸镍(C4H6NiO4·4H2O)和九水硝酸铬[Cr(NO3)3·9H2O]溶解于去离子水中配成200 ml金属阳离子总浓度为2 mol·L−1的混合盐溶液,并将 NaOH溶于去离子水中配制 450 ml浓度为1 mol·L−1的NaOH溶液作为沉淀剂,量取一定量的氨水制备NH4OH溶液作络合剂。将Ni、Mn、Cr过渡金属离子溶液置于50℃的恒温水浴锅中,然后滴加NaOH溶液,利用搅拌桨进行充分搅拌,并调节pH使之维持在11左右。反应完全后,在密闭条件下搅拌12 h,然后再静置24 h。最后进行过滤、洗涤、干燥得到 Ni0.2−x/2Mn0.6−x/2Crx(OH)2前驱体。按照化学当量配比,称取一定量的Li2CO3(过量5%)与制备的前驱体进行混合球磨5 h,使其充分混合。将球磨后的物质使用管式炉在空气氛围中采用二段烧结法进行烧结,先将混合物加热到500℃并保温5 h,然后升温到850℃并保温12 h,之后随炉冷却。最终得到掺杂不同含量Cr的正极材料Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12),分别记作a、b、c和d。
1.2 材料的表征测试
使用日本理学D/MAX-C型X射线衍射仪进行物相分析,其参数设置:加速电压为 40 kV,电流为300 mA,衍射靶为Cu Kα,扫描范围为10°~80°。使用JEOL JSM-7001F型高分辨场发射扫描电子显微镜(SEM)观察材料的表面微观形貌。
1.3 电极制备及半电池的组装
按照质量比8∶1∶1将正极活性物质、聚偏氟乙烯(PVDF)和乙炔黑进行混合研磨,然后加入溶剂 N-甲基-2-吡咯烷酮(NMP)混合均匀后,使用涂布刀涂刮到铝箔上,然后置于烘箱内于 120℃下进行干燥。压片后得到正极片,再在真空干燥箱中干燥12 h。在高纯氩保护的手套箱中,以金属锂片为负极,溶解于乙烯碳酸酯(EC)+碳酸二甲酯(DMC)+碳酸甲乙酯(EMC)(体积比为1∶1∶1)溶液的1 mol·L−1的LiPF6为电解液,聚丙烯微孔膜(Celgard 2400)为隔膜,组装成CR2025扣式半电池。
1.4 电化学性能测试
使用新威尔公司的 CT-3008高精度电池测试仪对组装好的 CR2025扣式半电池进行充放电测试。其充放电电压范围为 2.0~4.8 V,测试温度恒定为 25℃。首次充放电电流为 0.1C(1C=250 mA·h·g−1),循环性能测试电流为0.2C。
交流阻抗测试采用的是三电极体系,其辅助电极和参比电极均为金属锂片。测试仪器为上海辰华CHI660D电化学工作站,交流阻抗测试频率为0.01~100000 Hz。
2 结果与讨论
2.1 合成产物的X射线衍射分析
图1为正极材料Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)的 XRD 图。从中可以看出:Li1.2Ni0.18Mn0.58Cr0.04O2、Li1.2Ni0.16Mn0.56Cr0.08O2、Li1.2Ni0.14Mn0.54Cr0.12O2的 XRD 图 谱 与Li1.2Ni0.2Mn0.6O2的 XRD图谱基本一致,未发现其他杂相。其中20°~23°处的超晶格峰是材料过渡金属层中的Li、Mn原子的超晶格有序排列形成的不具有R-3m对称性,归属于C2/m空间群的单斜晶系,其余的衍射峰均属于层状结构α-NaFeO2的特征峰,为R-3m空间群的六方晶系[18]。从图中未发现其他杂相峰出现,而且通过(003)和(104)的局部放大图可以看出,掺杂Cr与未掺杂Cr的XRD曲线相比,其峰向左侧进行偏移。结合元素离子变径的查阅结果可知,这是由于Cr3+的半径(7.5 nm)比Ni2+半径(6.9 nm)和Mn4+的半径(5.3 nm)大,导致掺杂后的峰向左侧移动,表明Cr已进入材料晶格中,实现了体相掺杂。从图谱中可以看出(006)/(012)和(018)/(110)两处具有明显的分裂峰,表明合成的材料具有典型的层状结构特征,结晶性良好且为有序的二维层状结构[19]。该结果表明,Cr已进入材料晶格中,实现了体相掺杂并未改变材料的层状结构。
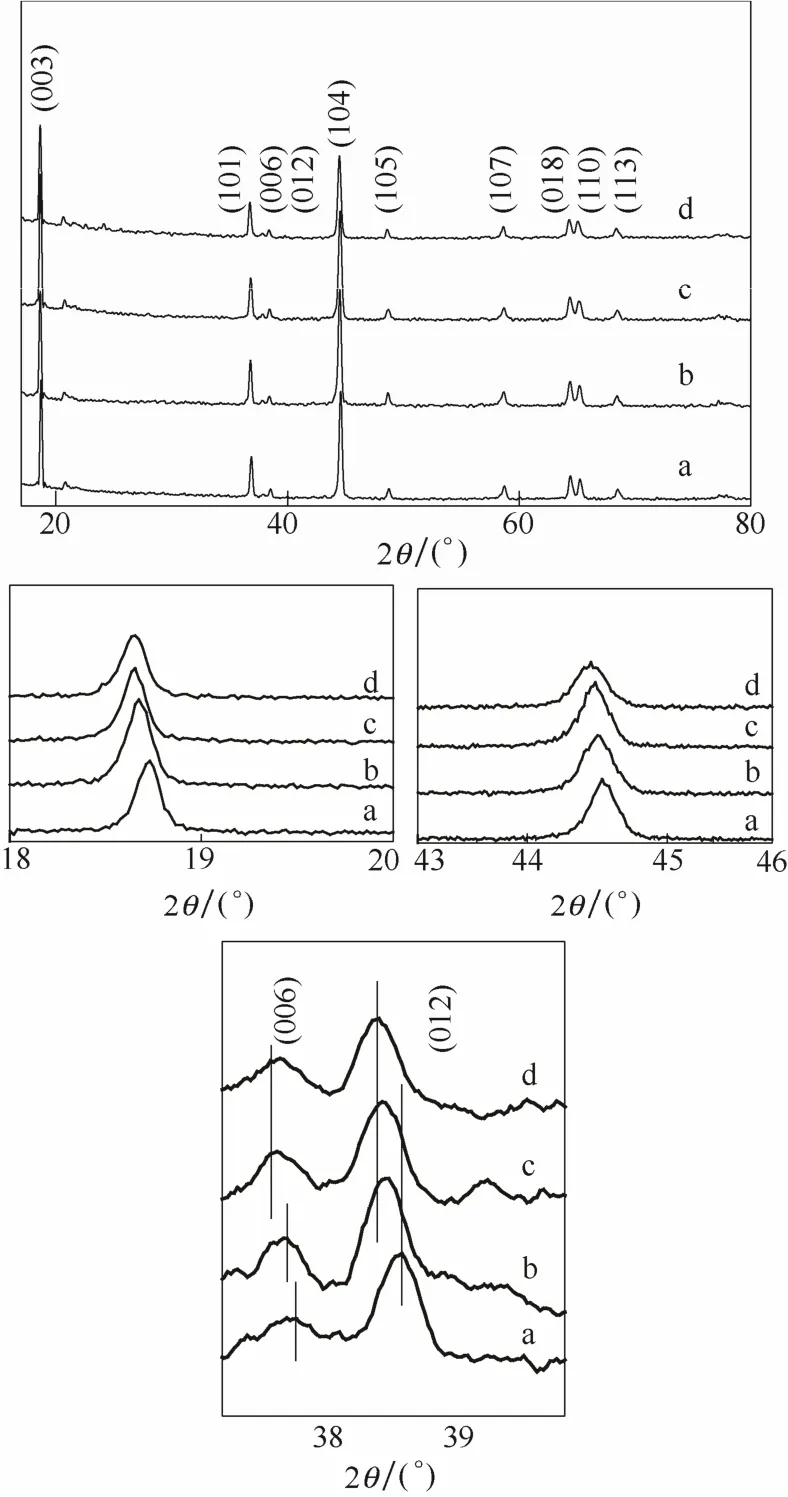
图1 掺杂不同Cr含量Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2的XRD谱图Fig.1 XRD patterns of Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2synthesized with different percent of Cr
2.2 合成产物的颗粒形貌分析
图2为正极材料Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)的SEM图和EDS图。从SEM图中可知,掺杂Cr与未掺杂Cr的正极材料相比,其形貌未发生较大的变化。但是随着掺杂量的增加,材料的颗粒逐渐增大,这说明Cr含量的增加在一定程度上促进了晶粒的生长,形成了较大的颗粒。当掺杂Cr量较大时,材料颗粒出现熔融现象。从EDS图中可以看出,在a样品中未检测到Cr,但是在b、c、d中都有Cr出现,再结合XRD分析中掺杂Cr后相较于未掺杂样品其峰值向左偏移,表明Cr已进入材料晶格中,实现了体相掺杂。

图2 Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2的SEM和EDS图Fig.2 SEM images combined with EDS results of Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2
图3为正极材料Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0,0.04, 0.08, 0.12)的高倍率透射电镜照片的晶面间距标定。经计算得到的晶面间距d=0.48 nm,为典型层状结构 R-3m相的(003)晶面。因此认为图中显示出清晰的晶格条纹为典型层状 R-3m相的(003)晶面,即掺杂前后材料的层状结构未发生变化[20]。

图3 Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2晶面间距标定Fig.3 Crystal plane spacing of Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2
通过XRD、SEM、TEM分析可以确定:Cr掺杂为材料的晶体结构,掺杂前后正极材料仍然维持典型的层状结构。
2.3 电化学性能测试分析
图4为不同样品的首次充放电曲线,充放电电压区间为2.0~4.8 V,充放电电流为0.1C。表1为不同Cr含量样品的首次充放电比容量及库仑效率。由图4可以看出,所有样品在首次充电过程中都存在两个电压区域。在4.4 V以下充电电压呈上升状态,对应着过渡金属Ni2+氧化为Ni4+;在4.5 V时出现了一个电压平台,这是由于充电至4.5 V时,Li2O从Li2MnO3结构中脱出所引起的[21-23]。由表1可知,当Cr掺杂量为8%时的掺杂效果最好,其首次充放电容量分别为322.6、246.6 mA·h·g−1,首次库仑效率为76%,而未掺杂Cr的样品首次充放电容量为325.7、230.4 mA·h·g−1,首次库仑效率为70.76%。这是由于适量的Cr掺杂可以增加氧层间距,降低锂离子扩散的能垒,同时Cr—O键键能(427 kJ·mol−1±29 kJ·mol−1)大于Mn—O键的键能(360 kJ·mol−1)和 Ni—O键的键能(391.6 kJ·mol−1±3.8 kJ·mol−1),且掺杂后材料的晶格参数增大,有利于锂离子在材料中的传输和脱嵌,从而改善材料的电化学性能[17]。以上结果表明:适量的Cr掺杂能够稳定材料的整体结构,促进锂离子的脱嵌,并能够有效抑制氧缺陷的产生,降低首次不可逆容量的损失,进而提高其首次库仑效率[24]。

图4 Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2的首次充放电曲线Fig.4 First charge and discharge curves of Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2
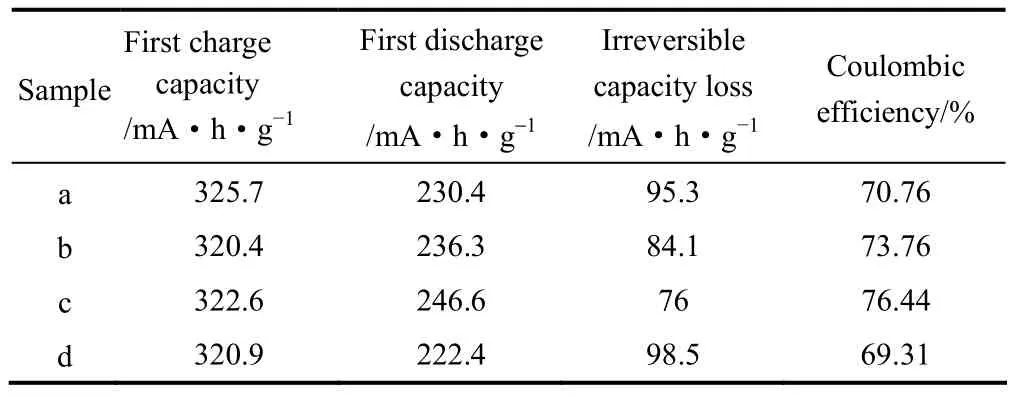
表1 样品的首次充放电比容量及库仑效率Table 1 First charge-discharge capacity and Coulombic efficiency of samples
图5为不同样品在0.2C充放电电流下的室温(25℃)放电循环性能曲线。从图5可以看出:50次循环结束后,样品c仍然保持最高的放电比容量,由224.3 mA·h·g−1衰减为213.9 mA·h·g−1,容量保持率为95.36%。然而未掺杂样品的放电比容量由217.7 mA·h·g−1衰减为203.6 mA·h·g−1,其容量保持率仅有93.5%。这是由于Cr3+的掺入,使得材料阳离子混排程度降低,减小了循环过程中因混排阳离子价态变化而引起的晶体结构的畸变,增强了晶体结构的稳定性,从而表现出更优的循环性能。
图6为不同样品的倍率性能曲线。在2.0~4.8 V范围内,充电电流为0.1C,而放电电流分别为0.1C, 0.2C, 0.5C, 1C, 2C和5C。从图6可以看出:随着放电电流的增大,样品的放电比容量有不同程度的衰减。在0.1C放电时,样品a, b, c, d的放电比容量分别为229.5、236.4、245.3、222.1 mA·h·g−1;1C下的放电比容量分别为169.4、172.9、179.4、165.9 mA·h·g−1;5C的电流下放电结束时,其放电比容量分别为91.5、97.4、104.2、82 mA·h·g−1。以上结果表明:样品c的倍率性能最佳,尤其是在大倍率下的放电性能。这是因为适量的Cr掺杂后增加了正极材料的电导率,减少进入四面体位的 Li+并抑制阳离子混排和Mn3+的含量,进而有利于降低锂离子的迁移阻力,从而提高其在高倍率下的放电性能。而且掺杂 Cr后材料的晶格参数增大[17],有利于锂离子在材料中的传输和脱嵌,从而改善材料的电化学性能,特别是倍率性能。但是当Cr的掺杂量过大时,材料的颗粒过于粗大,使得 Li+在固相中扩散的路径过长,反而不利于Li+在材料中的扩散,损害材料的电化学性能,导致放电比容量降低[19]。
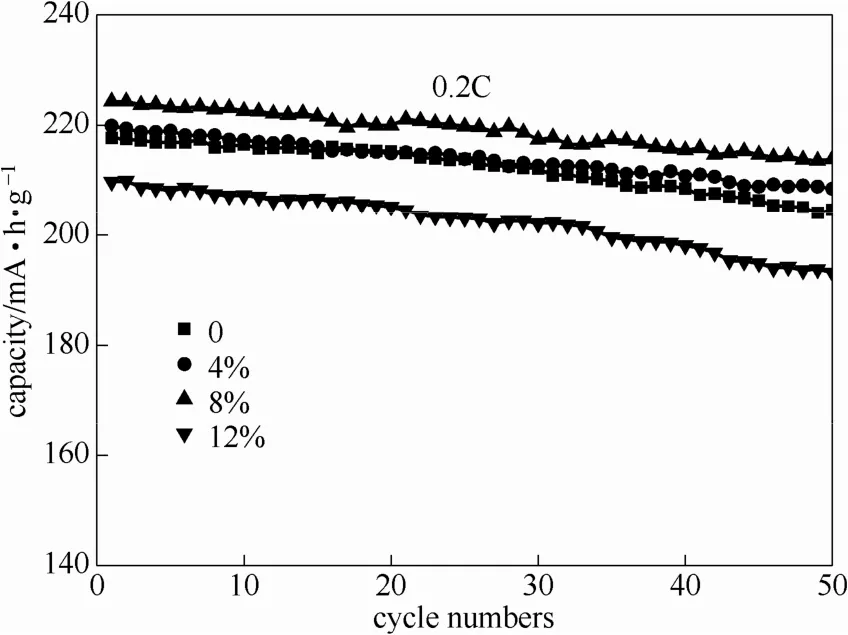
图5 Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2的循环性能Fig.5 Cycling performances of Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2

图6 Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2的倍率性能Fig.6 Rate capacity test results of Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2
图7为Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)在50次循环下的中值电压曲线。从图7中可以看出,样品c的中值电压的衰减趋势明显比其他样品缓慢,样品c的中值电压较高,为3.35 V,而其他3个样品的初始中值电压分别为3.32、3.27和3.07 V。随着循环次数的增加,样品c与其他样品的中值电压差逐渐增大,直至50次循环结束后,样品a、b、c、d的中值电压分别为2.67、2.78、2.97、2.62 V。这表明适量的Cr元素掺杂能够有效维持中值电压。这是由于Cr原子进入到八面体结构中,在充放电过程中,有效地稳定晶体结构,抑制阳离子的混排。Cr元素的掺杂,能够有效抑制循环过程中层状结构向尖晶石结构的转变,从而使得材料保持较高的中值电压。
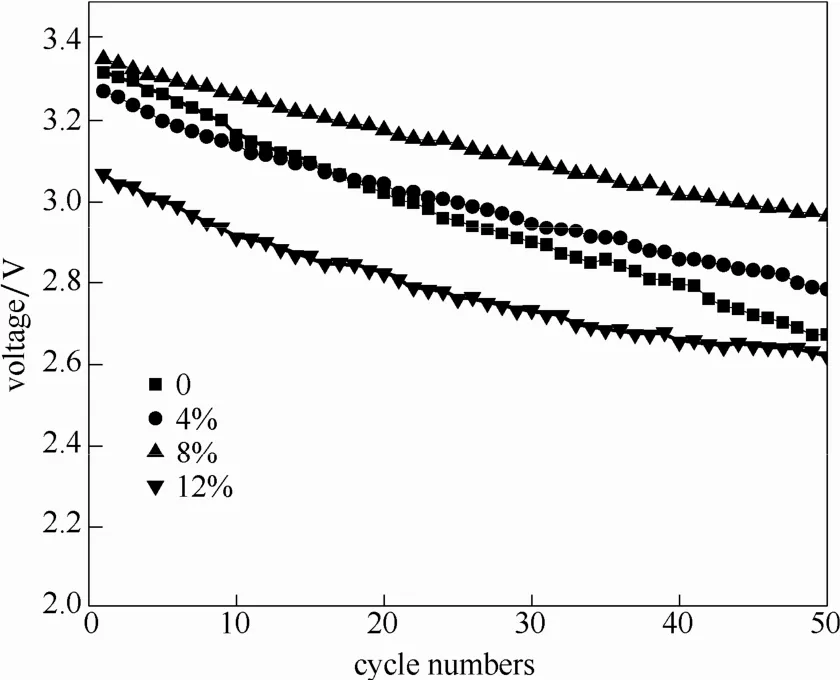
图7 Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2的中值电压曲线Fig.7 Mean voltage of Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2
图8分别为样品a和c以0.2C进行循环时的第1、10、30和50次的dQ/dV曲线。从图8中可以看出,随着循环进行,材料dQ/dV曲线的峰值逐渐减小并且不断向电势较低的方向移动。这是由于在循环过程中,材料中 Mn4+/Mn3+氧化还原反应使得正极材料由层状结构向尖晶石结构转变所导致的[22]。由图8可以明显看出,刚开始时两种材料的峰值都在3.25 V附近且两个峰值相差不大,但是随着循环过程的进行,未掺杂Cr的正极材料其峰值向低电势方向移动的速度明显要比掺Cr样品快,在50次循环结束时,未掺杂样品的峰值在2.7 V附近,而掺Cr样品的峰值在2.8 V左右。而且未掺杂Cr的样品的峰值减小速度也比掺杂 Cr材料快。由于材料在4.0 V以上放电时电压下降较快,因此在此出现了一个峰,但是随着循环过程的进行,电池电压的衰减导致此峰逐渐减弱[25]。掺杂Cr材料在50次循环结束时,仍能看到此处弱峰仍然存在,而未掺杂 Cr材料在循环结束时此峰已经消失。这就说明了掺杂Cr材料相较于未掺杂Cr材料,其由层状结构向尖晶石结构转变的速度较慢,即掺杂Cr能够提升材料的稳定性,抑制其结构的转变。
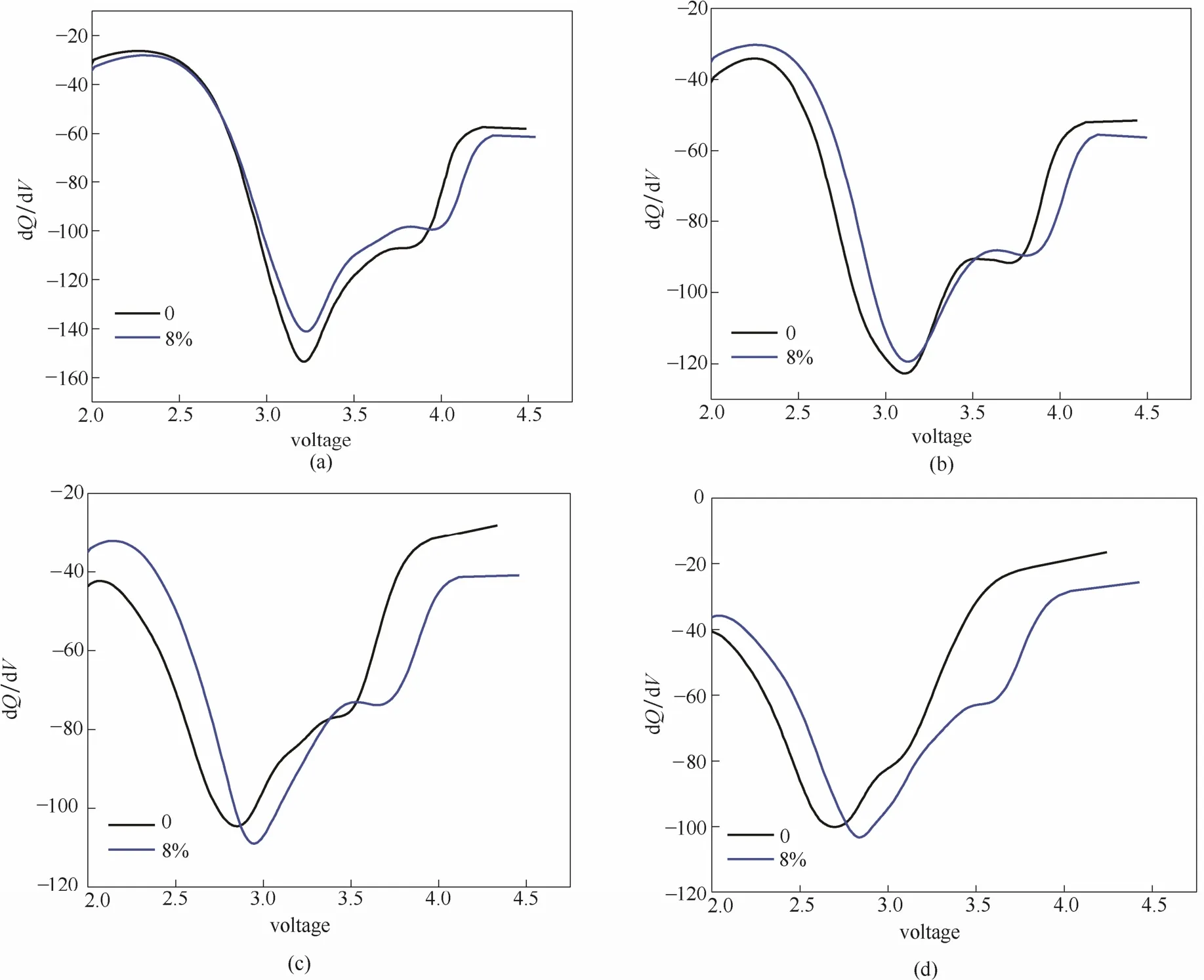
图8 Li1.2Ni0.2Mn0.6O2和Li1.2Ni0.16Mn0.56Cr0.08O2的微分容量曲线Fig.8 dQ/dV profiles of Li1.2Ni0.2Mn0.6O2and Li1.2Ni0.16Mn0.56Cr0.08O2after 1st(a), 10th(b), 30th(c), 50th (d) cycle at 0.2C
图9为Li1.2Ni0.16Mn0.56Cr0.08O2的Cr2p与Mn2p的 XPS谱图以及 Mn2p3/2的分峰拟合曲线和Li1.2Ni0.2Mn0.6O2的 Mn2p3/2的分峰拟合曲线。从图9(a)可以看出,Cr2p3/2处分裂为两个峰,电子结合能位置位于575.6、579 eV,对照结合能表可以发现这与 Cr3+和 Cr6+电子结合能相一致,说明Li1.2Ni0.16Mn0.56Cr0.08O2中Cr元素以正三价和正六价两种价态存在。在充放电过程中,Cr6+/Cr3+氧化还原电对可以作为电化学活性成分,从而提高电极比容量[26]。采用XPSpeak41软件对Mn4+与Mn3+分别位于 642.8、641.4 eV 的谱峰相互叠加形成的Mn2p3/2进行分峰处理并拟合,其中 Mn4+峰面积占总峰面积的 45.1%,Mn3+峰面积占总峰面积的54.9%。而未掺杂的Li1.2Ni0.2Mn0.6O2的Mn4+含量为56.7%,Mn3+为43.3%,这说明Cr元素掺杂在一定程度上改变了Mn4+与Mn3+含量,但掺杂后的材料依旧能够保持较高的放电比容量,说明这种变化有利于提高材料的电化学性能。

表2 不同样品的电子电导率Table 2 Electronic conductivities of different samples

图9 Li1.2Ni0.16Mn0.56Cr0.08O2的XPS谱图及Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2的Mn2p3/2的分峰拟合曲线Fig.9 XPS image of Li1.2Ni0.16Mn0.56Cr0.08O2and Mn2p3/2fitting curve of Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2
为了分析 Cr掺杂对正极材料电化学性能方面的改进,对材料进行了电子电导率和交流阻抗测试。表2所列的是用四探针方法测得的材料样品的电子电导率。从表中数据可知,随着Cr含量的增加,材料的电子电导率先增加后降低,样品c的数值最大,即 Li1.2Ni0.16Mn0.56Cr0.08O2的导电性能最好。图 10为Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)的交流阻抗及等效电路图,测试前应先对电池进行0.1C的充放电2次,使得Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)电极的电压稳定在3.8 V左右。样品的阻抗图谱由高频区的半圆及低频区的直线两部分组成。其中高频区的半圆弧代表的是正极材料表面的电荷转移阻抗Rct;而低频区的直线代表的是Li+在固相活性物质中的 Warburg阻抗 ZW。经过Zview软件模拟,Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)样品的电荷转移阻抗Rct如表3所示,8%的Cr3+掺杂使电荷转移阻抗Rct由372.4 Ω降低到335.2 Ω,说明Cr掺杂能提高材料电极表面的电荷转移速率。由此可见:随着 Cr掺杂量的增加,Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)样品的电荷转移阻抗先减小后增大;在x=0.08时,合成的 Li1.2Ni0.16Mn0.56Cr0.08O2样品的电荷转移阻抗最小,此结果与样品的倍率性能相吻合。
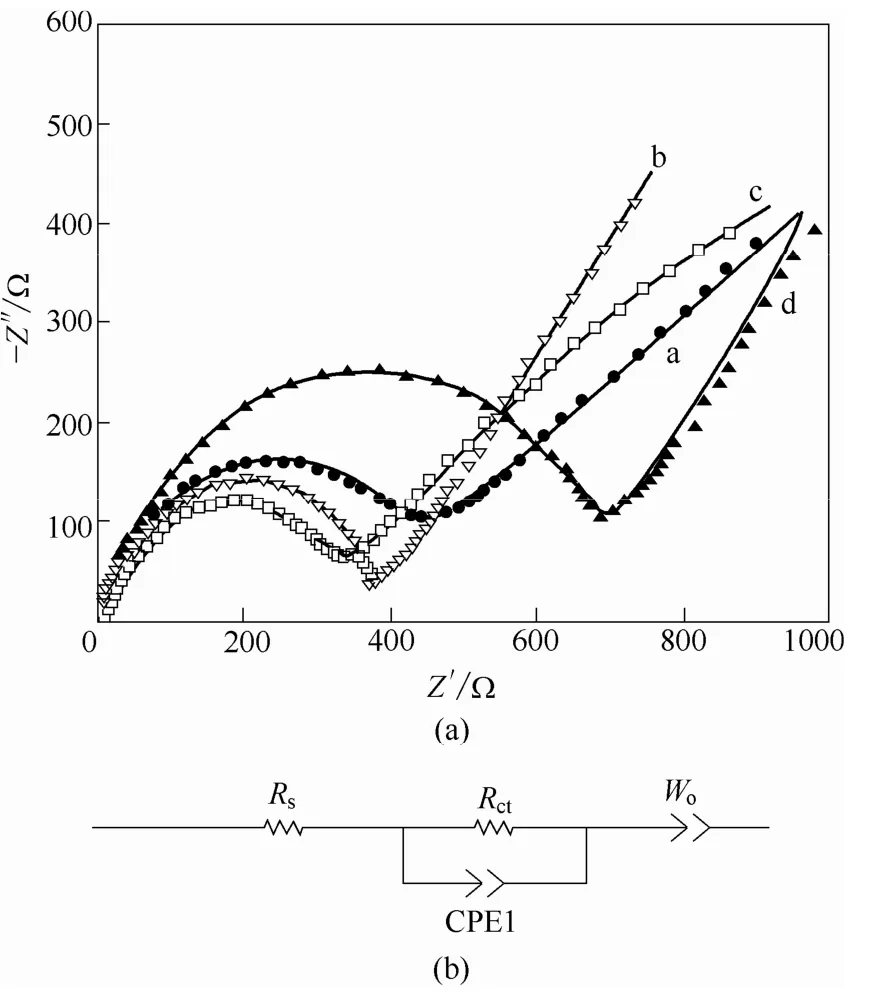
图10 Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)的交流阻抗图谱和模拟等效电路图Fig.10 AC impedence of Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)(a) and equivalent circuit model(b)

表3 等效电路的阻抗参数Table 3 Impedance parameters of equipment circuit
3 结 论
(1)采用共沉淀法制备掺杂 Cr的氢氧化物前驱体,用此前驱体制备出的富锂锰基正极材料Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)均保持良好的层状固溶体结构。
(2)随着Cr含量的增加,Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12)样品的首次库仑效率、循环性能及倍率性能都是先增加后降低。通过一系列的对比可知 x=0.08时制备出的 Li1.2Ni0.16Mn0.56Cr0.08O2的电化学性能最佳。其首次放电比容量由掺杂之前的230.4 mA·h·g−1增加到246.6 mA·h·g−1;5C的放电比容量由 91.5 mA·h·g−1提高到 102.4 mA·h·g−1;0.2C下50次循环结束后的放电比容量保持率由93.5%提高至95.36%。
(3)Cr掺杂量为8%(x=0.08)时制备的正极材料 Li1.2Ni0.16Mn0.56Cr0.08O2具有最小的电荷转移阻抗,为 1.0 Ω。较小的电荷转移阻抗是Li1.2Ni0.16Mn0.56Cr0.08O2具有最优的循环性能和倍率性能的重要原因。
综上所述,适量的 Cr掺杂能够有效改善锂离子电池正极材料Li1.2Ni0.2Mn0.6O2的电化学性能。
[1]CHUNG S Y, BLOKING J T, CHIANG Y M. Electronically conductive phospho-olivines as lithium storage electrodes [J]. Nature Materials, 2003, 1(2): 123-128.
[2]NUMATA K, SAKAKI C, YAMANAKA S. Synthesis of solid solutions in a system of LiCoO2-Li2MnO3for cathode materials of secondary lithium batteries [J]. Chem. Lett., 1997, 1997(8): 725-726.
[3]THACKERAY M M, JOHNSON C S, AMINE K, et al. Lithium metal oxide electrodes for lithium cells and batteries: US 6677082 [P]. 2004-01-13.
[4]KIM D H, KANG S H, BALASUBRAMANIAN M, et al. High-energy and high-power Li-rich nickel manganese oxide electrode materials [J]. Electrochem. Commun., 2010, 12(8): 1618-1621.
[5]KOENIGJR G M, BELHAROUAK I, WU H M, et al. Hollow lithiated metal oxide particles as lithium-ion battery cathode materials [J]. Electrochim. Acta, 2011, 56(8): 1426-1431.
[6]陈来, 陈实, 胡道中, 等. 不同组分下富锂正极材料xLi2MnO3·(1−x)LiNi0.5Mn0.5O2(x=0.1~0.8)的晶体结构与电化学性能[J]. 物理化学学报, 2014, 30(3): 467-475.CHEN L, CHEN S, HU D Z, et al. Crystal structure and electrochemical performance of lithium-rich cathode materials xLi2MnO3·(1−x)LiNi0.5Mn0.5O2(x=0.1—0.8) [J]. Acta Physico-Chimica Sinica, 2014, 30(3): 467-475.
[7]SONG B, LAI M O, LU L. Influence of Ru substitution on Li-rich 0.55Li2MnO3·0.45LiNi1/3Co1/3Mn1/3cathode for Li-ion batteries [J]. Electrochimica Acta, 2012, 80(1): 187-195
[8]ARMSTRONG A R, HOLZAPFEL M, NOVAK P, et al. Demonstrating oxygen loss and associated structural reorganization in the lithium battery cathode Li[Ni0.2Li0.2Mn0.6]O2[J]. Journal of the American Chemical Society, 2006, 128(26): 8694-8698.
[9]HONG Y S, PARK Y J, RYU K S. Synthesis and electrochemical properties of nanocrystalline Li[NixLi(1−2x)/3Mn(2−x)/3]O2prepared by a simple combustion method [J]. Journal of Materials Chemistry, 2004, 14(9): 1424-1429.
[10]HUANG X K , ZHANG Q S , CHANG H T, et al. Hydrothermal synthesis of nanosized LiMnO2-Li2MnO3compounds and their electrochemical performances [J]. Journal of the Electrochemical Society, 2009, 156(3): 162-168.
[11]VENKATRAMAN S, CHOI J, MANTHIRAM A. Factors influencing the chemical lithium extraction rate from layered LiNi1−y−zCoyMnzO2cathodes [J]. Electrochemistry Communications, 2004, 6(8): 832-837.
[12]DOU S, WANG W. Synthesis and electrochemical properties of layered LiNi0.5−xMn0.5−xCo2xO2for lithium-ion battery from nickel manganese cobalt oxide precursor [J]. Solid State Electrochemical, 2010, 15(2): 399-404.
[13]ZHANG J M, ZHANG Z R, WU X B, et al. The effects of AlF3coating on the performance of Li[Li0.2Mn0.54Ni0.13Co0.13]O2positive electrode material for lithium-ion battery [J]. Journal of the Electrochemical Society, 2008, 155(10): 775-782.
[14]WU Y, VADIVEL MURUGAN A, MANTHIRAM A. Surface modification of high capacity layered Li[Li0.2Mn0.54Ni0.13Co0.13]O2cathode by AlPO4[J]. Journal of the Electrochemical Society, 2008, 155(9): 635-641.
[15]KANG Y J, KIM J H, LEE S W, et al. The effect of Al(OH)3coating on the Li[Li0.2Ni0.2Mn0.6]O2cathode material for lithium secondary battery [J]. Electrochimica Acta, 2005, 50(24): 4784-4791.
[16]王伟东, 仇卫华, 丁倩倩, 等. 锂离子电池三元材料——工艺技术及生产应用[M]. 北京: 化学工业出版社, 2015: 30-35. WANG W D, QIU W H, DING Q Q, et al. Nickel Cobalt Manganese Based Cathode Materials for Li-ion Batteries Technology Production and Application [M]. Beijing: Chemical Industry Press, 2015: 30-35.
[17]朱伟雄. 裡离子电池富锂锰基 LiLi0.2Ni0.2Mn0.6O2正极材料的制备及改性研究[D]. 长沙: 中南大学, 2013: 40-49. ZHU W X. Preparation and modification of Li-rich Mn-based LiLi0.2Ni0.2Mn0.6O2cathode materials for Li-ion batteries [D]. Changsha: Central South University, 2013: 40-49.
[18]LIU Y J, GAO Y Y, DOU A C. Influence of Li content on the structure and electrochemical performance of Li1+xNi0.25Mn0.75O2.25+x/2cathode for Li-ion battery [J]. Journal of Power Sources, 2014, 248:679-684.
[19]FU F, HUANG Y Y, WU P, et al. Controlled synthesis of lithium-rich layered Li1.2Mn0.56Ni0.12Co0.12O2oxide with tunable morphology and structure as cathode material for lithium-ion batteries by solvo/hydrothermal methods [J]. Journal of Alloys and Compounds, 2015, 618: 673-678.
[20]赵煜娟, 岳影影, 孙玉成, 等 纳米材料Li1.2Ni0.2Mn0.6O2的合成及性能研究[J]. 电池, 2014, 44(4): 198-201. ZHAO Y J, YUE Y Y, SUN Y C, et al. The study on synthesis of nano Li1.2Ni0.2Mn0.6O2material and its electrochemical performance [J]. Battery Bimonthly, 2014, 44(4): 198-201.
[21]PARK S H, KANG S H, JOHNSON C S, et al. Lithium-manganese-nickel-oxide electrodes with integrated layered-spinel structures for lithium batteries [J]. Electrochemistry Communications, 2007, 56(9): 262-268.
[22]刘云建, 王亚平, 刘三兵, 等. LiNi0.2Li0.2Mn0.6O2正极材料的合成与碳包覆[J]. 中南大学学报(自然科学版), 2013, 44(2): 482-486. LIU Y J, WANG Y P, LIU S B, et al. Synthesized and carbon-coating of LiNi0.2Li0.2Mn0.6O2cathodes [J]. Journal of Central South University (Science and Technology), 2013, 44(2): 482-486.
[23]SONG B H, ZHOU C F, WANG H L, et al. Advances in sustain stable voltage of Cr-doped Li-rich layered cathodes for lithium ion batteries [J]. Journal of the Electrochemical Society, 2014, 161(10): A1723-A1730.
[24]YI T F, SHU J, ZHU Y R, et al. Structure and electrochemical performance of Li4Ti5O12-coated LiMn1.4Ni0.4Cr0.2O4spinel as 5 V materials [J]. Electrochemistry Communications, 2009, 11(1): 91-94.
[25]KANG S H, JOHNSON C S, VAUGHEY J T, et al. The effects of acid treatment on the electrochemical properties of 0.5Li2MnO3·0.5LiNi0.44Co0.25Mn0.31O2electrodes in lithium cells [J]. Journal of Electrochemical Society, 2006, 153(6): A1186-A1192.
[26]LU Z H, CHEN Z H, DAHN J R. Lack of cation clustering in Li[NixLi1/3−2x/3Mn2/3−x/3]O2(0≤x≤1/2) and Li[CrxLi(1−x)/3Mn(2−2x)/3]O2(0<x<1) [J]. Chem. Mater., 2003, 15(16): 3214-3220.
Effects of Cr-doping on structure and electrochemical performance of lithiumand manganese-rich cathode materials Li1.2Ni0.2Mn0.6O2
ZHANG Zhiqiang, ZHENG Shengquan, WANG Qiliang, DOU Aichun, SU Mingru, LIU Yunjian
(College of Materials Science and Engineering, Jiangsu University, Zhenjiang 212013, Jiangsu, China)
Lithium-ion battery cathode materials Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2(x=0, 0.04, 0.08, 0.12) were synthesized by co-precipitation and high temperature solid state reaction. The structure, morphology and electrochemical properties of cathode material, which was doped with different amounts of Cr, were characterized by X-ray diffraction (XRD), scanning electron microscopy (SEM), galvanostatic charge-discharge testing and electrochemical impedance spectroscopy (EIS). The results show that the cathode materials Li1.2Ni0.2−x/2Mn0.6−x/2CrxO2display the layered structure of solid solution. Cr-doping does not change the material structure, and stabilizes the host layered structure by prohibiting the speed of spinel structure formation during cycling. Li1.2Ni0.16Mn0.56Cr0.08O2has the best electrochemical properties. The first discharge specific capacity of Li1.2Ni0.16Mn0.56Cr0.08O2is 246.6 mA·h·g−1at 0.1C, while Li1.2Ni0.2Mn0.6O2is 230.4 mA·h·g−1. The capacity retaining ratio is improved from 93.5% to 95.36% after 50 cycles at 0.2C. The discharge capacity of Li1.2Ni0.16Mn0.56Cr0.08O2is 104.2 mA·h·g−1at 5C, while that of pristine is about 91.5 mA·h·g−1. EIS results show that Li1.2Ni0.16Mn0.56Cr0.08O2has the lowest charge transfer impedance.
LIU Yunjian, lyjian122331@163.com
TM 912.9
:A
:0438—1157(2017)01—0398—10
10.11949/j.issn.0438-1157.20160875
2016-06-27收到初稿,2016-10-18收到修改稿。
联系人:刘云建。
:张志强(1991—),男,硕士研究生。
国家自然科学基金项目(51304081);江苏省自然科学基金项目(BK20140581,BK20150506,BK20140558)。
Received date: 2016-06-27.
Foundation item: supported by the National Natural Science Foundation of China (51304081) and the Natural Science Foundation of Jiangsu Province (BK20140581, BK20150506, BK20140558).

