宽pH条件下Mn3O4/ACF复合阴极类电芬顿体系降解亚甲基蓝
何盈盈,孟建,马亚利,张潇予
(西安建筑科技大学理学院,陕西 西安 710055)
宽pH条件下Mn3O4/ACF复合阴极类电芬顿体系降解亚甲基蓝
何盈盈,孟建,马亚利,张潇予
(西安建筑科技大学理学院,陕西 西安 710055)
用电化学方法将Mn3O4负载于活性炭纤维(activated carbon fiber, ACF)表面制备了Mn3O4/ACF复合阴极,与铂丝阳极构成了异相类电芬顿体系对模型污染物亚甲基蓝(MB)进行降解,考察了该体系在不同pH条件下对MB去除率,并对体系中的活性氧物种进行了检测,初步探讨了降解机理。实验结果表明,在pH 3.0、pH 5.0和pH 7.0时亚甲基蓝脱色率分别达到97.3%、99.9%、99.8%,pH5.0时TOC去除率达到88.6%,pH 7.0和pH 3.0时也分别达到了80.4%和73.4%,拓宽了电芬顿反应的适宜pH范围。体系中活性氧物种的检测结果表明,氧在阴极电还原产生H2O2,并与Mn3O4反应生成羟基自由基·OH,同时,氧的一电子还原产物超氧自由基O2·-也对阴极表面污染物的脱色有重要贡献。
电解;催化剂;复合材料;类电芬顿;自由基;亚甲基蓝;降解
引 言
随着工业的快速发展,难降解有机污染物已成为水环境污染的主要来源之一[1]。电芬顿(electro-Fenton,EF)作为芬顿技术的分支,利用溶解氧在阴极的电化学还原反应产生过氧化氢,与溶液中加入的 Fe2+反应生成强氧化性的羟基自由基,进攻难降解有机污染物,实现污染物的矿化或者提高其生物可降解性[2-3]。相对于芬顿技术,EF法无须额外储存和加入过氧化氢,从而降低了技术的成本。已有技术主要通过外加金属催化剂[4-7]、牺牲铁阳极等办法产生Fe2+[8],需要在窄的pH范围内进行,通常要求溶液的pH为3左右。另外,溶液中加入的均相Fe2+催化剂需要在降解完成后去除,一方面产生了污泥,另一方面增加了处理成本。减少甚至杜绝污泥的产生,降低体系对溶液pH的要求,对改进该类体系具有重要意义。
为了克服以上电芬顿法的缺点,研究者提出多种改进思路。一方面,以固态金属氧化物作为催化剂的异相电芬顿法引起了广泛关注[9-11]。由于不存在金属离子催化剂水解的问题,该类体系有可能克服均相EF法对溶液pH的依赖,另外也使催化剂的分离更容易实现。张国亮[12]利用浸渍法制备Fe2O3/γ-Al2O3负载型多相催化剂,并通过催化填料床曝气电解体系降解对硝基酚(PNP),提高了降解反应的速率常数和COD去除率,出水中芳环类化合物含量也明显减小,PNP的可生化降解性显著增强。Ai等[13]尝试将核壳结构的球状Fe@Fe2O3负载于活性炭纤维上作为复合阴极,研究了其对罗丹明 B(RhB)的降解效果。该体系无须另外加入催化剂,进一步简化了操作步骤,在pH 2~3时RhB的去除率达到80%,pH 7~8时去除率为65%,证明将催化剂负载于阴极材料获得复合阴极用于EF过程的可行性。另一方面,研究者提出以具有多价态的过渡金属离子代替 Fe(II)作为芬顿反应的催化剂,以提高芬顿法的处理效率,拓展其适用的酸度范围。Khataee等[14]用 Mn2+催化类电 Fenton反应降解苯酚,其去除率达到78%,表明过渡金属离子替代Fe2+催化剂是可行的。
锰氧化物在能量储备、离子交换、均相催化等众多领域受到广泛关注[15]。四氧化三锰可用Mn(Ⅱ)Mn(Ⅲ)2O4表示,其中,Mn(Ⅱ)和Mn(Ⅲ)同时存在于晶格中,Mn(Ⅲ)可以通过电还原转化为EF过程所需的Mn(Ⅱ),可作为一种较好的芬顿试剂替代剂。本文以四氧化三锰作为催化剂,将其负载于活性炭纤维(activated carbon fiber, ACF)表面,制备了Mn3O4/ACF复合阴极材料用于类电芬顿法中,对模型污染物噻嗪类染料亚甲基蓝[氯化-3,7-双(二甲胺基)吩噻嗪-5-]进行降解,而无须另外加入试剂,无污泥产生,简化了处理过程。结果表明,该体系对亚甲基蓝(methylene blue,MB)在较宽的pH范围内均具有高效的降解效率,是较为理想的类电芬顿法处理体系。
1 实验部分
1.1 实验试剂与仪器
ACF(KJF-1500,江苏科净炭纤维有限公司);亚甲基蓝(分析纯,天津市天力化学试剂有限公司);纯氧(99.99%,腾龙化工有限公司,西安);其余试剂均为分析纯。
电化学工作站(CHI832B,上海辰华仪器公司);紫外-可见分光光度计(UV-2450,岛津分析仪器有限公司,日本);荧光分光光度计(F96PRO,上海凌光技术有限公司);X光电子能谱(XPS)(K-Alpha Thermo Scientific,美国Thermo Fisher Scientific);X射线能谱(EDS)仪(IncaEnergy300,英国Oxford Instruments);TOC仪(V-CPH,岛津分析仪器有限公司,日本);扫描电镜SEM(日立x-650)。
1.2 电化学法制备Mn3O4/ACF复合阴极材料
将活性炭纤维(7 cm×5 cm)浸入无水乙醇溶液中超声清洗 30 min,去离子水清洗后 80℃下烘干。将 0.135 mol·L−1MnSO4溶液用稀 H2SO4和NH3·H2O调节pH 7.0,通氮气15 min。以ACF为工作电极,铂丝为辅助电极,饱和甘汞电极(SCE)为参比电极,在上述溶液中于 40℃水浴条件下在−1.8~−0.8 V电位范围内进行循环伏安扫描8圈,扫速5 mV·s−1。ACF用去离子水冲洗后在200℃热处理2 h,得到Mn3O4/ACF复合材料,密封保存待用。用XPS对复合阴极材料表面元素进行分析,SEM观察材料的表面形貌,用EDS确定材料表面元素及成分的含量。
1.3 Mn3O4/ACF复合阴极类电芬顿法对目标污染物MB的降解实验
降解实验装置如图1所示。在500 ml的烧杯中,将 Mn3O4/ACF复合材料固定在有孔的聚四氟乙烯管外壁作为工作电极,铂丝为辅助电极,饱和甘汞电极(SCE)为参比电极,0.05 mol·L−1的Na2SO4为支持电解质,加入亚甲基蓝并用稀 H2SO4和NaOH调节溶液pH。实验中以2.5 L·min−1速度充O2,间隔一定反应时间取样,测定样品的吸光度及TOC。水中亚甲基蓝的吸光度采用紫外-可见分光光度计测定,检测波长为665 nm。

图1 Mn3O4/ACF复合阴极类电芬顿实验装置Fig.1 Schematic diagram of experimental setup
1.4 体系中活性氧物种的测定
采用碘试剂法[4]测定类电芬顿体系中产生的H2O2浓度。采用香豆素对羟基自由基进行测定[16]。含10.00 mmol·L−1香豆素的电解液中通氧电解,间隔一定时间取样。香豆素受到·OH攻击生成稳定且具有荧光特征的7-羟基香豆素,荧光检测时激发波长332 nm,发射波长460 nm。
1.5 体系中溶出锰离子的测定
采用高碘酸钾氧化光度法,将锰离子氧化为高锰酸钾,测定溶液在525 nm处的吸光度[17]。
2 结果与讨论
2.1 Mn3O4/ACF复合阴极材料的表征
对负载锰氧化物的材料表面微观形貌进行SEM 检测,结果如图 2所示,未负载锰氧化物的ACF表面平滑,负载锰氧化物之后表面有球状结构的晶粒均匀分布,粒径为80~200 nm。EDS测试分析结果如图3所示,表明活性炭纤维表面主要有C、O、Mn 3种元素,其质量百分比分别为81.35%、15.50%、3.15%(4次测量平均值),可见负载后的电极表面仍然以碳元素为主,氧元素主要以活性炭纤维表面含氧官能团如羰基、羧基等形式存在,部分氧与锰结合为氧化锰,氧化锰种类由XPS进行表征。XPS结果如图4所示,与EDS实验结果一致,XPS图谱显示材料表面存在C、Mn、O 3种元素[图4(a)]。以C1s结合能284.6 eV为基准定标,得到Mn2p能谱如图4(b)所示,图中642.08 eV和653.18 eV分别对应于Mn元素的Mn2p3/2和Mn2p1/2轨道结合能,该结合能明显高于Mn原子的轨道结合能638.7 eV和649.9 eV,也高于MnO的Mn2p3/2结合能640.2 eV,表明锰的氧化态大于+2[18]。用Themo Avantage软件以MnO、Mn2O3和Mn3O4分别对谱图进行拟合,由图可见,Mn3O4与谱图拟合效果最好,表明负载于 ACF表面的锰氧化物应主要为Mn3O4[15,19-20]。

图2 Mn3O4/ACF的SEM图Fig.2 SEM photos of Mn3O4/ACF cathode

图3 Mn3O4/ACF的EDS谱图Fig.3 EDS analysis of Mn3O4/ACF
2.2 Mn3O4/ACF复合阴极体系对目标污染物亚甲基蓝的去除效果
考察了不同pH条件下Mn3O4/ACF复合阴极类电芬顿法对目标污染物亚甲基蓝的去除效果,亚甲基蓝的紫外可见光谱随处理时间的变化如图 5所示。亚甲基蓝的助色团甲基和甲胺取代基容易受到亲电自由基的进攻而发生脱甲基或氨基的反应,主要引起612 nm和665 nm处n-π*跃迁吸收峰强度的降低;另外,C—S═C+键也易受到攻击而分解,使共轭结构破坏,造成吸光度值的降低[20]。不同 pH条件下亚甲基蓝的脱色率结果如图6(a)所示。由图可见,pH 5.0时,体系对亚甲基蓝的脱色效果最好,在46 min时即达到了99.6%,pH 7.0次之,为86.0%,而pH 3.0时相同时间仅为65.3%。在115 min时,pH 5.0和pH 7.0时脱色率达到99.9%、99.8%,而pH 3.0时也可达到97.3%。相同条件下pH 5.0时吸附对亚甲基蓝的去除率仅为76.0%。
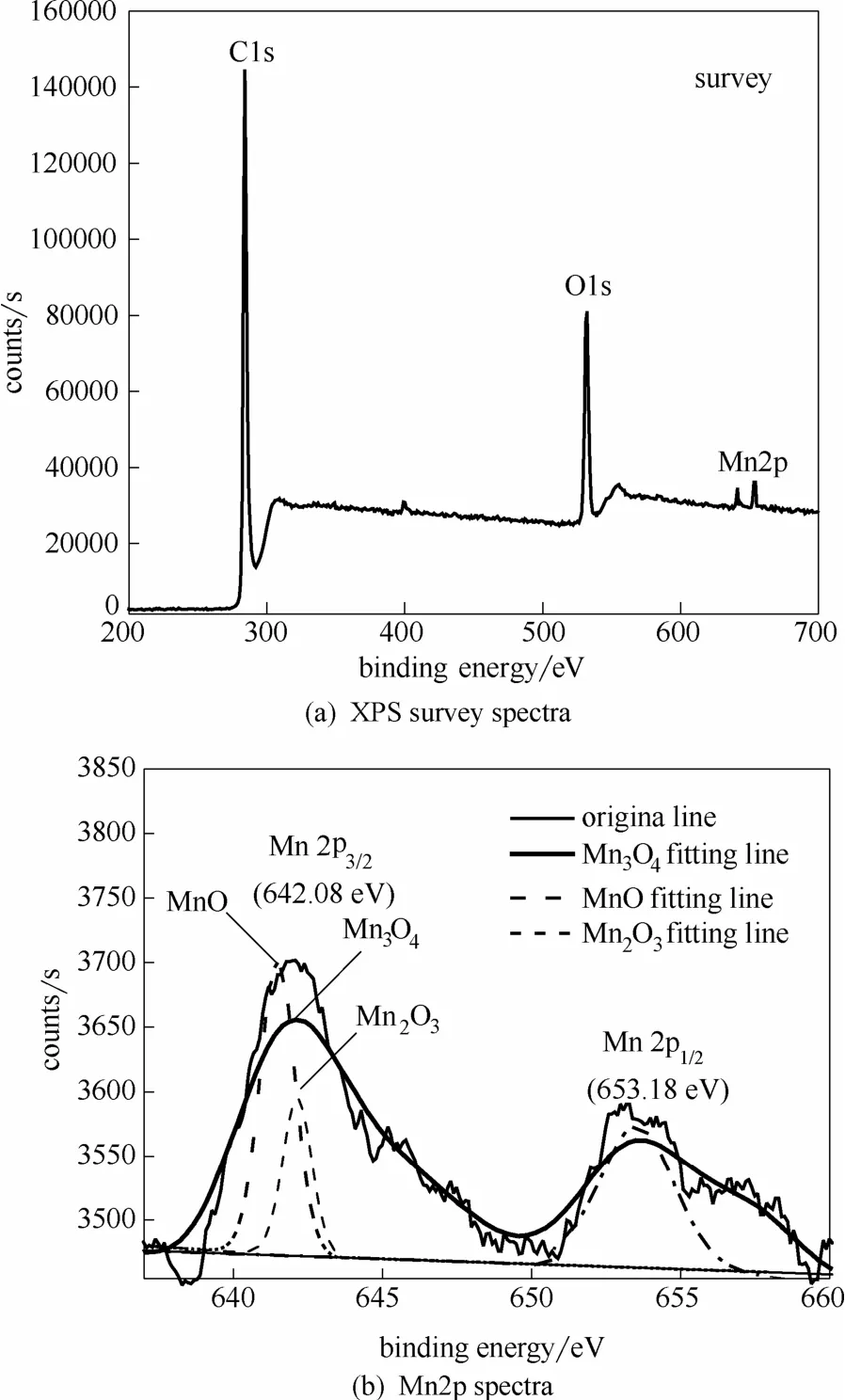
图4 Mn3O4/ACF复合阴极材料的XPS能谱图Fig.4 XPS spectra of Mn3O4/ACF

图5 亚甲基蓝吸收光谱随降解时间的变化Fig.5 Changing of UV-vis spectra of MB with electrolysis time[ c(MB) is 150 mg·L−1, c(Na2SO4) is 0.05 mol·L−1, potential is −1.0 V, pH5.0, oxygen aerating rate is 2.5 L·min−1]
对上述实验结果进行动力学模拟,发现在所研究的3个pH条件下亚甲基蓝的去除均符合准一级反应速率方程,模拟结果如图6(b)所示,表明亚甲基蓝在去除过程中活性氧物种的产生及供给为稳态过程,反应速率仅受反应物亚甲基蓝浓度的影响,呈现准一级反应的特点。反应速率常数在pH 3.0、5.0和7.0时分别为0.0263 min−1、0.111 min−1、0.0725 min−1。
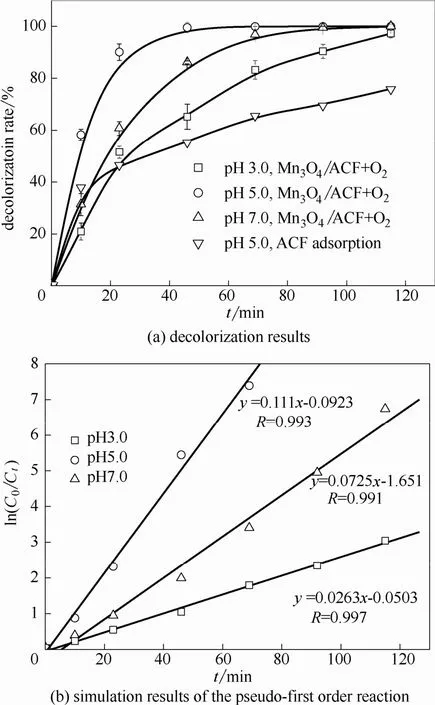
图6 不同pH条件下亚甲基蓝的去除效果Fig.6 Effect of pH on decolorization of MB (other conditions are as same as that in Fig.5)
以目标污染物的TOC去除率作为其矿化指标,考察了不同pH条件下该电化学体系对亚甲基蓝的矿化效率,结果如图7所示。由图可见,pH对亚甲基蓝TOC去除率的影响与脱色率相一致,在pH 5.0时呈现最好的矿化效果,反应70 min时,TOC去除率达到了88.6%,pH 7.0和pH 3.0时也分别达到了80.4%和73.4%。以上结果显示,该Mn3O4/ACF阴极电化学体系在所研究的pH 3.0~7.0范围内均对污染物亚甲基蓝有较好的矿化去除效果,其中在pH 5.0时最为突出,明显拓展了电芬顿反应的适宜pH范围。而未负载ACF阴极对亚甲基蓝的TOC去除率仅达到55.2%,远低于Mn3O4/ACF阴极处理体系。可见,该体系中负载的Mn3O4对亚甲基蓝的完全降解有明显的作用,而未负载的ACF由于吸附以及直接电解等对亚甲基蓝也有去除作用,但是矿化降解效果有限。
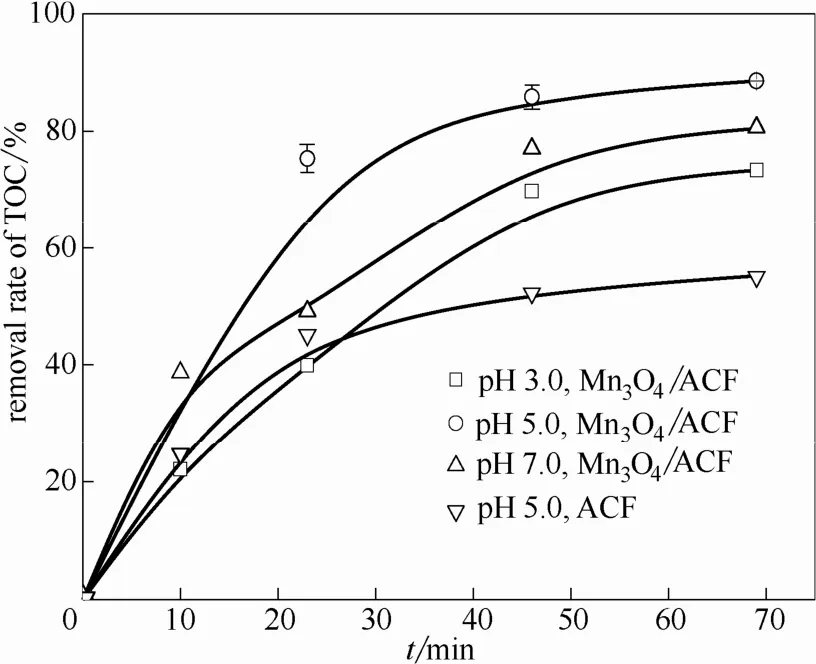
图7 不同pH条件下亚甲基蓝的TOC去除率Fig.7 Effect of pH on TOC removal of MB (other conditions are as same as that in Fig.5)
2.3 电解过程中 Mn3O4/ACF复合阴极表面锰的溶出
考察了不同pH条件下体系中锰在溶液中的溶出情况,结果如图8所示。由图可知在pH 3.0时,体系中有36.7 mg·L−1锰的溶出,随着反应时间的延长,溶液中锰离子的量逐渐减少,这是由于溶出的锰离子在静电吸引力的作用下重新附着至阴极表面的结果。pH 5.0时溶液中锰溶出量为 1.28 mg·L−1,pH 7.0时仅为1.14 mg·L−1。表明在pH 3.0时,复合电极表面锰离子溶出明显,其一方面可使电极性能受到影响,另一方面由于溶液中锰离子可与过氧化氢发生类芬顿反应[14],故该体系中也可能存在均相类芬顿反应。
2.4 Mn3O4/ACF复合阴极类电芬顿反应体系中活性氧物种的检测
考察了没有亚甲基蓝存在时 Mn3O4/ACF复合阴极类电芬顿反应体系中过氧化氢 H2O2和羟基自由基·OH的产生。如图9所示,溶液中过氧化氢浓度随 pH升高而降低,与文献结果一致[3,21],各个pH条件下反应10 min时,过氧化氢浓度均达到最大,随后随着反应的进行,过氧化氢的浓度反而降低,这与阴极负载的Mn3O4有关。Mn3O4与阴极表面产生的H2O2反应生成·OH,消耗部分H2O2,使其浓度减小,而减小的程度决定了活性氧自由基的产生量。实验结果显示,pH 3.0时,过氧化氢浓度由反应10 min时的71.7 μg·L−1降低至90 min时的65.0 μg·L−1,降幅为6.65 μg·L−1,而pH 5.0时降幅达到 21.6 μg·L−1,pH 7.0时浓度降幅为 17.5 μg·L−1。
比较了pH 5.0时未负载ACF阴极体系产生的过氧化氢,由图9可见,其过氧化氢产生量远低于Mn3O4/ACF复合阴极体系,这可能是由于负载的Mn3O4增大了阴极表面积,从而增加了氧还原的活性位点。
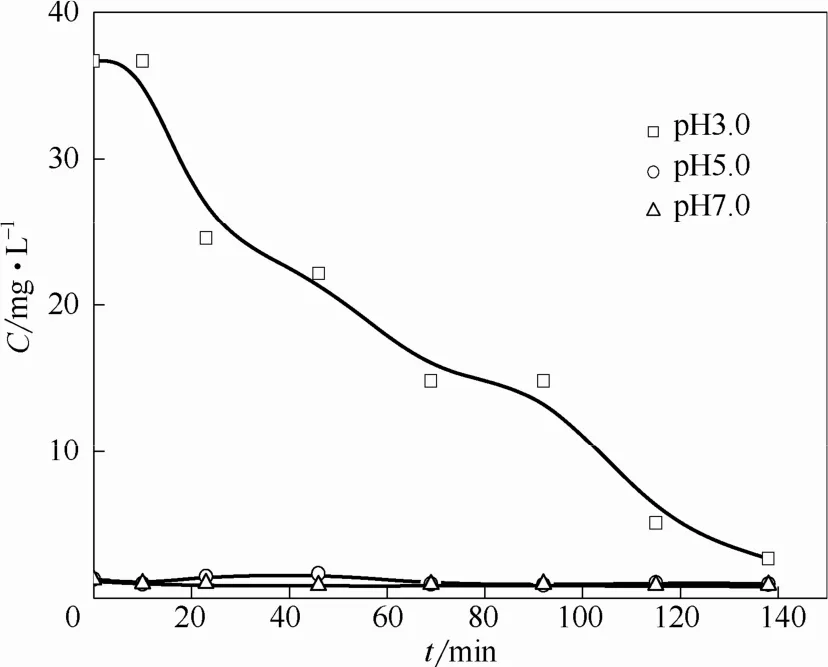
图8 电解过程中复合阴极表面锰离子的溶出Fig.8 Concentration of Mn2+released from composite cathode into electrolyte solution during electrolysis

图9 不同pH条件下过氧化氢的产生量Fig.9 Effect of pH on yield of H2O2during electrolysis(no MB is added; other conditions are as same as that in Fig.5)
用香豆素作为羟基自由基捕获剂,以生成的7-羟基香豆素荧光强度反映体系中的·OH含量,结果如图10所示。在ACF阴极体系中没有检出·OH,Mn3O4/ACF阴极体系中·OH产生量在pH 3.0时最小,与过氧化氢浓度随反应时间的减少量最小相一致。而pH 7.0时过氧化氢浓度在反应中降幅较大,其羟基自由基生成量也大。但pH 5.0时的情况则较为特殊,虽然过氧化氢浓度在反应过程中的降幅最大,但羟基自由基的生成量却与pH 3.0时相当,可能是由于该条件下部分过氧化氢与羟基自由基发生如式(1)的反应[22-23],致使羟基自由基的量减少,而超氧自由基的量增大。以下的实验结果证实了这一点。
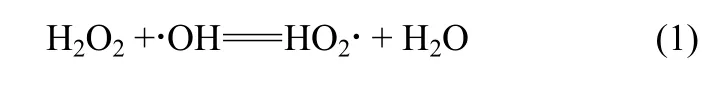
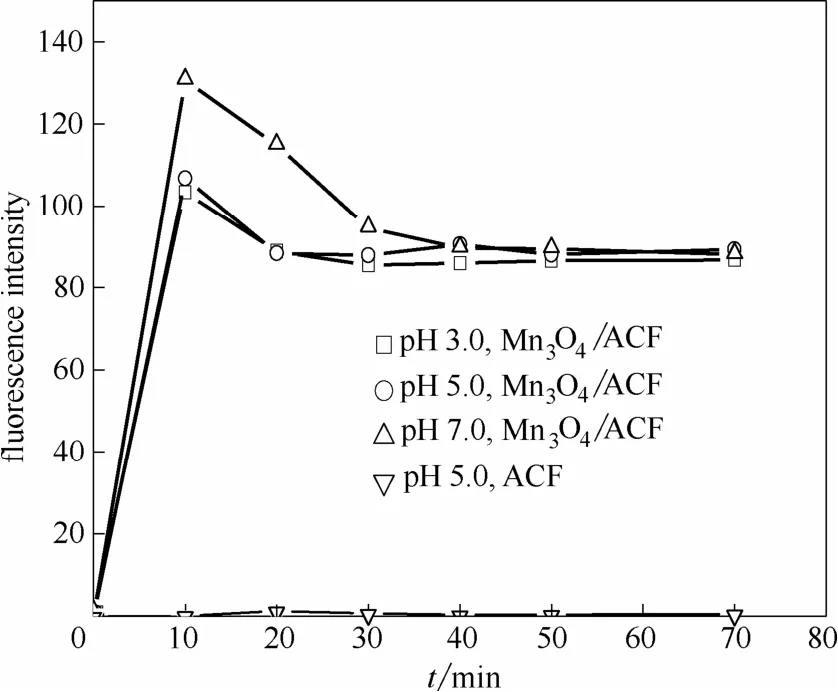
图10 以7-羟基香豆素荧光强度表示的羟基自由基浓度随pH的变化Fig.10 Effect of pH on yield of hydroxyl radical by detection of fluorescence intensity of 7-hydroxycoumarin(concentration of coumadin is 10 mmol·L−1; no MB is added; other conditions are as same as that in Fig.5)
为了阐明 Mn3O4/ACF复合阴极类电芬顿体系中另一活性氧物种超氧自由基O2·-是否也参与了污染物的氧化去除,向体系中分别加入了大浓度的·OH清除剂异丙醇和O2·-清除剂对苯醌[23-24],考察其对亚甲基蓝脱色率的影响。由图11可知,pH 7.0时,异丙醇的加入使亚甲基蓝的去除率降低了36.4%,对苯醌则使其降低了 31.9%,表明 pH 7.0时·OH对亚甲基蓝的去除贡献最大,而O2·-也有一定的贡献,这与过氧化氢和羟基自由基的测定结果相一致。pH 5.0时,对苯醌使亚甲基蓝的去除率降低了40.8%,而异丙醇仅使其降低了8.2%。结合过氧化氢和羟基自由基的检测结果可知,在pH 5.0时,氧在阴极电化学还原生成的H2O2部分地与·OH反应生成了 O2·-,导致了体系中 H2O2浓度的减小和O2·-浓度的增大。另一方面,活性炭纤维表面大量含氧官能团对氧在阴极一电子还原生成O2·-的过程有促进作用[25],也使阴极表面O2·-大量生成。尽管O2·-氧化能力有限,但本文所用的芳香杂环染料亚甲基蓝结构中荷正电的硫离子端在静电力的作用下吸附于阴极表面,使得电子云密度较高的另一端杂环靠近电极,与阴极产生的 O2·-接触,导致亲电性的O2·-更容易进攻亚甲基蓝的富电子端,共轭结构破坏而脱色,生成不完全降解产物,完成污染物降解的第一步。不完全降解产物进一步在·OH的作用下被矿化,达到去除的目的。pH 3.0时,对苯醌和异丙醇均对亚甲基蓝的去除率影响不大,一方面由于酸性条件下氧还原得到的O2·-容易进一步还原为 H2O2,使 H2O2生成量大而 O2·-产生量小,O2·-对污染物降解的贡献有限。同时,pH 3.0时电极表面锰的溶出造成电极表面异相Fenton反应减弱,而溶液中的均相类Fenton反应由于形成Mn2+-污染物配合物也受到干扰[26],故pH 3.0时O2·-和·OH都对亚甲基蓝的降解贡献不大,降解效率相对偏低。而在pH 5.0和7.0时,溶液中溶出锰离子的浓度较小,这种配位作用则不明显。

图11 自由基清除剂对亚甲基蓝脱色率的影响Fig.11 Effect of radical scavengers on decolorization percentage of MG(concentration of isopropanol is 150 g·L−1and p-benzoquinone is 4.45 g·L−1;other conditions are as same as that in Fig.5)
据以上实验结果和讨论,给出在最佳酸度 pH 5.0时,Mn3O4/ACF复合阴极体系对污染物亚甲基蓝的氧化降解机理如式(2)~式(5)所示,降解反应主要发生在电极表面。溶解氧首先在电极上一电子还原为超氧自由基[式(2)]。该自由基也可以与质子结合,并进一步被电还原为过氧化氢[式(3)]。电极表面负载的Mn3O4中Mn(Ⅱ)与过氧化氢发生异相类芬顿反应,生成羟基自由基[式(4)]。荷正电的污染物亚甲基蓝首先吸附在电极表面,其富电子一端被超氧自由基攻击,使其共轭结构破坏,发生不完全降解。亚甲基蓝分子和其不完全降解产物与羟基自由基进一步反应,发生完全降解。Mn(Ⅲ)可在电极上发生还原反应而使Mn(Ⅱ)再生[式(5)]。
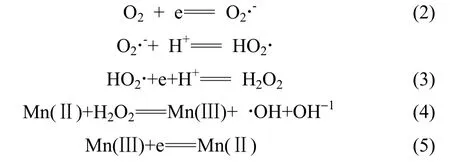
2.5 Mn3O4/ACF复合阴极材料的循环使用
图12考察了Mn3O4/ACF复合阴极材料循环使用次数对去除率的影响。由图可知,循环使用3次时对亚甲基蓝的去除率仍达到98%,但随后则降低至70%左右,这可能是由于ACF表面负载的锰氧化物的量较小,而在pH 5.0时反应过程中仍然有部分锰的溶解,导致复合阴极材料的循环利用次数偏低。
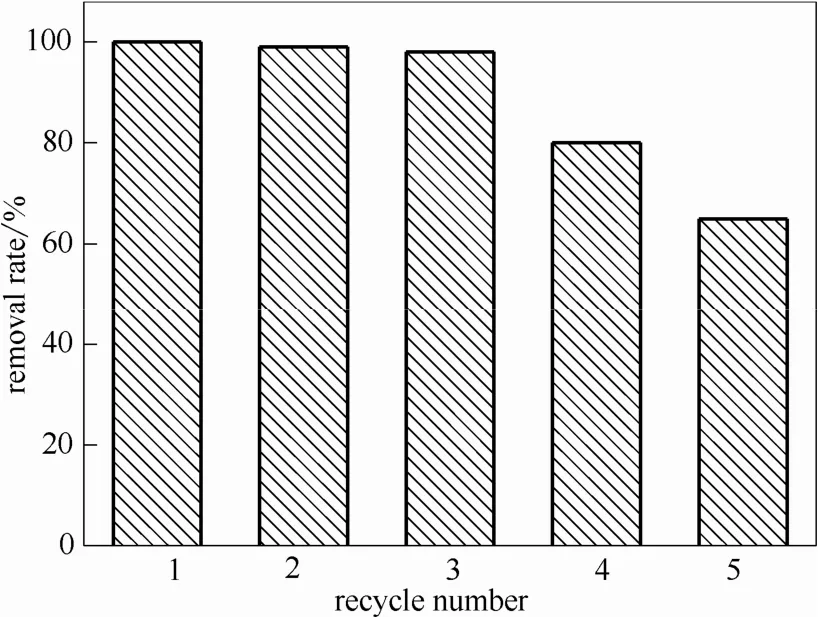
图12 pH5.0时Mn3O4/ACF循环使用次数对去除率的影响Fig.12 Effect of recycle number on removal rate of MG at pH5.0
3 结论与展望
通过考察 Mn3O4/ACF复合阴极在类电芬顿体系中对模型污染物亚甲基蓝的降解,得出以下结论:
(1)在pH 3.0、pH 5.0和pH 7.0条件下,亚甲基蓝的脱色率分别为 97.3%、99.9%和 99.8%,而TOC去除率可达到73.4%、88.6%和80.4%,表明该体系在较宽的 pH范围内均对污染物有强的去除作用。
(2)考察了体系中的活性氧物种,表明氧在阴极电还原产生的O2·-和·OH均对亚甲基蓝的脱色有作用,O2·-完成了污染物降解的第一步,·OH进一步使其不完全降解产物矿化,提出了降解机理。
(3)该Mn3O4/ACF复合阴极类电芬顿体系具有宽的适宜pH范围,无须外加催化剂,无污泥产生,且高效去除有机污染物的优势。
但是由于负载的锰氧化物有一定的溶解作用,该体系在pH 5.0的循环使用次数还不理想,后续研究中将从锰氧化物的负载量、锰氧化物负载条件和种类的优化等方面进行改进,以降低体系锰氧化物的溶解性,提高体系的稳定性。
[1]SOLPAN D, GUVEN O. Decoloration and degradation of some textile dyes by gammairradiation[J]. Radiat. Phys. Chem., 2002, 65(4): 549-558.
[2]王益平, 钱经纬. Electro-Fenton法处理印染废水应用研究进展[J].环境工程, 2014, 32: 117-120. WANG Y P, QIAN J W. Applications of electro-Fenton technique in dyeing waste water treatment[J]. Environ. Eng., 2014, 32: 117-120.
[3]NIDHEESH P V, GANDHIMATHI R. Trends in electro-Fenton process for water and wastewater treatment: an overview[J]. Desalination, 2012, 299: 1-15.
[4]WANG A, QU J H, RU J, et al. Mineralization of an azo dye Acid Red 14 by electro-Fenton's reagent using an activated carbon fiber cathode[J]. Dyes. Pigm., 2005, 65: 227-233.
[5]FERNADESRÊGO F E, MARTINEZHUITLE C A. Application of electro-Fenton process as alternative for degradation of novacron blue dye[J]. Environ. Chem. Eng., 2014, 2: 875-880.
[6]WANG C T, CHOU W L, CHUNG M H. COD removal from real dyeing wastewater by electro-Fenton technology using an activated carbon fiber cathode[J]. Desalination, 2010, 253: 129-134.
[7]胡晶晶, 莫文艳, 孙杰. 电芬顿降解活性艳红 X3B的阳极影响因素[J]. 化工学报, 2012, 63(11): 3694-3699. HU J J, MO W Y, SUN J. Anode effect on X3B degradation in electro-Fenton reaction[J]. CIESC Journal, 2012, 63(11): 3694-3699.
[8]JIA J P, YANG J, LIAO J, et al. Treatment of dyeing wastewater with ACF electrodes[J]. Water Res., 1999, 33: 881-884.
[9]CHEN J X, ZHU L Z. Catalytic degradation of orange II by UV-Fenton with hydroxyl-Fe-pillared bentonite in water[J]. Chemosphere, 2006, 65(7): 1249-1255.
[10]FENG J Y, HU X J, YUE P L. Novel bentonite clay-based Fe-nanocomposite as a heterogeneous catalyst for photo-Fenton discoloration and mineralization of orange II[J]. Environ. Sci. Technol., 2004, 38(1): 269-275.
[11]FENG J Y, HU X J, YUE P L. Discoloration and mineralization of orange II by using a bentonite clay-based Fe nanocomposite film as a heterogeneous photo-Fenton catalyst[J]. Water Res., 2005, 39(1): 89-90.
[12]张国亮. 电解耦合类芬顿多相催化降解水中对硝基酚[D]. 大连:大连理工大学, 2009. ZHANG G L. Study on catalytic decomposition of p-nitrophenol by electro-Fenton-like reaction[D]. Dalian: Dalian University of Technology, 2009.
[13]LI J P, AI Z H, ZHANG L Z. Design of a neutral electro-Fenton system with Fe@Fe2O3/ACF composite cathode for wastewater treatment[J]. Hazard. Mater., 2009, 164: 18-25.
[14]KHATAEE A R, FATHINIA M, ZAREI M, et al. Modeling and optimization of photo-catalytic/photo-assisted-electro Fenton like degradation of phenol using a neural network coupled with genetic algorithm[J]. J. Ind. Eng. Chem., 2014, 20: 1852-1860.
[15]赵莹. 四氧化三锰纳米粒子的制备与性质研究[D]. 长春: 吉林大学, 2011. ZHAO Y. Study on the synthesis and properties of hausmannite nanoparticles[D]. Changchun: Jilin University, 2011.
[16]ISHIBASHI K, FUJISHMA A, WATANABE T, et al. Detection of active oxidative species in TiO2photocatalysis using the fluorescence technique[J]. Electrochem. Commun., 2000, 2: 207-210.
[17]魏复盛. 水和废水检测分析方法 [M]. 4版. 北京: 中国环境出版社, 2002: 211-216. WEI F S. Water and Waste Water Detection Analysis Method [M]. 4th ed. Beijing: China Environmental Science Press, 2002: 211-216.
[18]周国伟, 李天铎, 徐桂英, 等. 红钛锰矿MnTiO3纳米材料的溶胶-凝胶法制备及光谱研究[J]. 中国科学, 2004, 34(6): 449-453. ZHOU G P, LI T Z, XU G Y, et al. The study of nano-MnTiO3preparation using sol-gel method and spectroscopic[J]. Chin. Sci. Ser., 2004, 34(6): 449-453.
[19]MOSES E R A, GRACE V S. XRD and XPS characterization of mixed valence Mn3O4hausmannite thin films prepared by chemical spray pyrolysis technique[J]. Appl. Surf. Sci., 2010, 256: 2920-2926.
[20]LI Y Q, QU J Y, GAO F. In situ fabrication of Mn3O4decorated graphene oxide as a synergistic catalyst for degradation of methylene blue[J]. Appl. Catal. B: Environ., 2015, 162: 268-274.
[21]古振澳, 柴一荻, 杨乐, 等. 以泡沫镍为阴极的电芬顿法对苯酚的降解[J]. 环境工程学报, 2015, 9(12): 5843-5848. GU Z A, CHAI Y D, YANG L, et al. Electro-Fenton degradation of phenol using foam nickel as cathode[J]. Chin. J. Environ. Eng., 2015, 9(12): 5843-5848.
[22]ZHAO H Y, WANG Y J, WANG Y B, et al. Electro-Fenton oxidation of pesticides with a novel Fe3O4@Fe2O3/activated carbon aerogel cathode: high activity, wide pH range and catalytic mechanism[J]. Appl. Catal. B: Environ., 2012, 125: 120-127.
[23]程丽华, 黄君礼, 倪福祥. Fenton试剂生成·OH的动力学研究[J].环境工程学报, 2003, 4(5): 12-15. CHENG L H, HUANG J L, NI F X. Generation kinetics of hydroxyl radicals by Fenton's reagent[J]. Chin. J. Environ. Eng., 2003, 4(5): 12-15.
[24]SUN M, RU X R, ZHAI L F. In-situ fabrication of supported iron oxides from synthetic acid mine drainage: high catalytic activities and good stabilities towards electro-Fenton reaction[J]. Appl. Catal., 2015, 165: 103-110.
[25]TAMMEVESKI K, KONTTURI K, NICHOLS R J, et al. Surface redox catalysis for O2reduction on quinone-modified glassy carbon electrodes[J]. Electroanal. Chem., 2001, 515: 101-112.
[26]IRMAK S, YAVUZ H I, ERBATUR O. Degradation of 4-chloro-2-methyphenol in aqueous solution by electro-Fenton and photoelectro-Fenton processes[J]. Appl. Catal. B: Environ., 2006, 63(3/4): 243-248.
A heterogeneous electro-Fenton-like system with composite cathode Mn3O4/ACF for efficient degradation of methylene blue in wide pH range
HE Yingying, MENG Jian, MA Yali, ZHANG Xiaoyu
(School of Science, Xi'an University of Architecture and Technology, Xi'an 710055, Shaanxi, China)
A composite activated carbon fiber (ACF) cathode Mn3O4/ACF, which was prepared using a cyclic voltammetry method, was employed in a heterogeneous electro-Fenton-like system for the degradation of a model dye, methylene blue (MB), with no other reagents added. The decolorization ratio and the mineralization of MB in the different pH were investigated and the active oxygen species involved in the system were also detected. The experiment results showed that when solution pH was set as 3.0, 5.0 and 7.0, the decolorization ratio reached to 97.3%, 99.9% and 99.8%, respectively, and TOC removal achieved to 73.4%, 88.6% and 80.4%, indicating the extensive feasibility of the system in broad pH range. The results of detection of the active oxygen species demonstrated that H2O2was electro-produced at the surface of cathode. The hydroxyl free radical ·OH generated by the Fenton-like reaction of Mn3O4with H2O2was responsible to the degradation of MB. The superoxide radical O2·-was also proved playing important role in decolorization of MB. The mechanism of degradation of the contaminant by this heterogeneous electro-Fenton-like system was preliminarily discussed.
electrolysis; catalyst; composite; electro-Fenton-like; free radical; methylene blue; degradation
HE Yingying, associate professor, 860087093 @qq.com
O 614.3;X 703.1
:A
:0438—1157(2017)01—0305—08
10.11949/j.issn.0438-1157.20160775
2016-06-06收到初稿,2016-09-29收到修改稿。
联系人及第一作者:何盈盈(1972—),女,副教授。
国家自然科学基金项目(51378414);陕西省自然科学基础研究计划项目(2015JM5172)。
Received date: 2016-06-06.
Foundation item: supported by the National Natural Science Foundation of China (51378414) and Shaanxi Natural Science Foundation Project (2015JM5172).

