干燥综合征的腮腺MRI特征
复旦大学附属华东医院MRI室(上海 200040)
马光慧 董 影 叶春涛嵇 鸣
论 著
干燥综合征的腮腺MRI特征
复旦大学附属华东医院MRI室(上海 200040)
马光慧 董 影 叶春涛嵇 鸣
目的探讨干燥综合征(SS)的腮腺MRI表现特点。总结并分析腮腺的MRI形态学表现,并根据水成像表现对腮腺导管扩张程度进行初步分析,旨在提高MRI检查对该病的诊断价值。方法选取80例SS患者作为研究对象,50例非SS患者作为对照组,所有患者均行常规腮腺MRI检查和双侧腮腺MR导管成像(MRS),MRI常规扫描序列包括平扫轴位T1WI、T2WI、T2脂肪抑制序列、冠状位,对各采集图像信号表现进行分析。结果SS腮腺MRI信号特点分为五型,SS组160例腮腺,0型0例、I型20例、II型60例、III型28例、IV型46例、V 型6例,以II型最多见,III、IV型较为多见;对照组100例腮腺,0型80例、I型20例,无其他四型表现,绝大部分MRI表现为腮腺信号均匀。在SS组中,II、III、IV型在MRI表现特异性最高,但其敏感性仅为37.5%、17.5%、28.8%。SS组腮腺径线小于对照组,差异有统计学意义,其中以纤维化萎缩型径线最小。SS组患者MRS均为双侧腮腺病变,表现为弥漫性腮腺末梢导管扩张。结论MRI能很好的显示干燥综合征的腮腺形态和信号的改变,MRS是利用唾液天然对比剂功能而进行的一种无创性涎管造影检查,能很直观反映腮腺各级导管扩张的情况,为临床诊断该病提供了客观的影像学依据。
干燥综合征;腮腺;磁共振成像;磁共振导管造影
干燥综合征(Sjogren's syndrome,SS)也称为舍格伦综合征,是一种累及外分泌腺体的慢性炎症性自身免疫性疾病。Sjogren于1933年首先报道该病。SS确诊主要依靠临床诊断标准,临床诊断标准由多个主观指标及客观指标组成,诊断过程繁琐,时间较长,而主观症状指标可信度及鉴别能力又相对较差,此外,非自身免疫病口干:如老年性腺体功能下降、糖尿病或药物等原因引起的类似症状,因此提高单项诊断指标的诊断价值具有重要的临床意义[1]。MRI高的软组织分辨率,多参数、多平面成像等特点使其可以客观评价腮腺病变。本研究通过对我院确诊的SS患者行腮腺MRI平扫和腮腺导管造影(MRI sialography, MRS)检查,总结并分析腮腺的MRI形态学表现,根据水成像表现对导管扩张程度进行初步分析,旨在提高MRI对该病的诊断价值。
1 资料与方法
1.1 研究对象SS组:80例,共160例腮腺。女70例,男10例,年龄21~86岁,平均年龄56.8岁,病程4个月~20年,均为自我院风湿免疫科2012年1月~2014年8月来我院就诊并经临床实验室检查确诊的SS患者,诊断标准参照2002年SS国际分类(诊断)标准[2]。对照组:选取非SS患者50例,共100例腮腺。女40例,男10例,年龄20~80岁,平均年龄55.6岁,10例其它疾病(类风湿关节炎2例,白塞病3例,系统性红斑狼疮1例,结缔组织病2例,痛风1例,甲状腺功能减退1 例)和正常对照40例。SS组和对照组均无头颈部放疗史、淋巴瘤、结节病、艾滋病史等。剔除标准:图像质量不合格。
1.2 仪器与方法采用Siemens公司MAGNETOM Trio 3.0T、Verio 3.0T及Skyra 3.0T MRI扫描仪,应用8通道头颅相控阵线圈。所有受试者在行MRI检查前禁饮食至少1h,嘱患者在检查过程中避免移动和吞咽动作。常规腮腺MRI的扫描序列包括:横轴位T1WI、T2WI及抑脂T2WI,冠状位T2WI及冠状位抑脂T2WI,MRS。各序列参数分别为:T1WI:TR 200ms、TE 2.46ms、层厚4mm、FOV 230mm×230mm、矩阵256×256;T2WI:TR 4000mm、TE 98mm、层厚4mm、FOV 230 mm×230mm、矩阵448×448;MRS:TR 4500mm、TE 898mm、层厚50mm、FOV 280mm×280mm、矩阵384×384,采用平行于腺体内主导管方向的斜矢状面采集。
1.3 图像分析由两名高年资放射科医生对腮腺MRI图像进行独立分析,根据表1对腮腺MRI影像进行分型,两名医师评判结论不一致者,由两人协商后确定最终结论。观察双侧腮腺MRI信号特征、各个径线大小及MRS末梢导管扩张情况。选取腮腺横断面的最大层面,测量其前后径和左右径,在其冠状面的最大层面测量其上下径,对两组腮腺的各个径线进行统计学分析。
1.4 统计学方法采用SPSS 19.0软件包对SS和非SS两组病灶的MRI征象进行统计学处理,计量资料用(±s)表示,组间均数的比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 本研究依据SS累及腮腺病程进展、腮腺MRI信号特点及大小将其分为五型(I-V),通常为双侧对称性改变,腮腺MRI分型。0正常:正常腮腺,腮腺实质信号均匀。I轻度不均匀型:腮腺实质信号轻度不均匀,T1WI、T2WI上为散在点、条状稍高信号影。II弥漫不均匀型:腮腺实质信号不均匀,弥漫分布着直径约<2m的小结节,结节间隙清晰,散在网格状高信号影,伴有末梢导管点状扩张。III多发结节型:实质内散在分布着直径约>2mm的结节,结节间隙清楚或模糊,弥漫分布着条索状高信号影,末梢导管弥漫性点、球状状扩张。IV纤维化萎缩型:腺体体积缩小,信号不均,弥漫分布斑片状高信号,可伴有末梢导管腔洞样扩张。V脂肪型:腺体信号欠均匀,腮腺组织在T1WI、T2WI为弥漫性高信号,T2WI压脂相呈低信号,正常腺体基本消失,可伴有末梢导管管腔样扩张,见图1-8。
2.2 不同腮腺的MRI影像分型在SS组和对照组中的分布SS组160例腮腺,腮腺分型0型0例、I 型20例、II型60例、III型28例、IV型46例、V型6例,以II型最多见,III、IV型较为多见;对照组大部分表现腮腺信号均匀,腮腺分型0型80例、I型20例,无其他四型表现。见表1。
2.3 以SS不同MRI表现作为分类诊断标准的诊断效力见表2。
2.4 SS组和对照组腮腺各个径线比较其中IV型三个径线的均值与对照组比较,差异具有统计学意义(P<0.05)。见表3。
3 讨 论
干燥综合征是一种由淋巴细胞介导的以损伤外分泌腺为主的全身性自身免疫性疾病。该病属全球性疾病,在我国的发病率为0.3%~0.7%,在老年人群中患病率为3%~4%。本病女性多见,男女比例1:9~20,发病年龄以40~50岁多见,也可见于儿童[3]。本研究中,SS组患者的好发年龄为50~60岁。本病病程长短不一,临床表现多样,除了有涎腺和泪腺受损、功能下降而出现口干、眼干外,尚有其他外分泌腺及腺体外其他器官的受累而出现多系统损害的症状。SS的病因和发病机制尚不明确,一般认为与遗传、免疫、病毒感染有关。其血清中则有多种自身抗体和高免疫球蛋白血症。SS分为原发性和继发性两种,前者指不具另一诊断明确的结缔组织病的SS,后者是指发生于另一诊断明确的SS,如系统性红斑狼疮、类风湿关节炎等的SS。唇腺活检作为诊断SS的重要客观依据,20多年广泛应用于临床,但是其病理阴性并不能排除SS,且唇腺活检创伤大,大多数患者不能接受,限制了其临床应用。常规的影像学检查方法有传统X线涎管造影、唾液腺核素检查、CT、超声等,但是上述方法存在有创性、对造影剂过敏、辐射损伤等不良因素,超声虽较方便但图像分辨率低,其临床应用具有一定的局限性。而且目前随着计算机的广泛应用,假性眼干的患者增多,这也需要一种无创、无辐射的诊断SS腮腺病变的影像学检查方法。MRI检查组织分辨率高,除了可以显示腮腺的大体形态改变,显示腮腺导管影像,同时还具有无创、无辐射、无造影剂过敏等优势,对于SS腮腺的诊断有着较广阔的应用前景[4]。目前,关于国内MRI诊断SS腮腺病变的报道较少,本文就SS腮腺病变的MRI特征进行初步探讨。
SS腮腺病变病理基础是腺体组织中灶性淋巴细胞、浆细胞、单核细胞浸润,形成淋巴滤泡样结构,导管上皮细胞化生、增生形成肌上皮岛[1,5],最终导致腺实质萎缩、导管扩张。

表1 MRI各型在SS组和对照组的检出率[例数(%)]

表2 MRI诊断SS腮腺的诊断效力(%)

表3 SS组和对照组腮腺各个径线比较
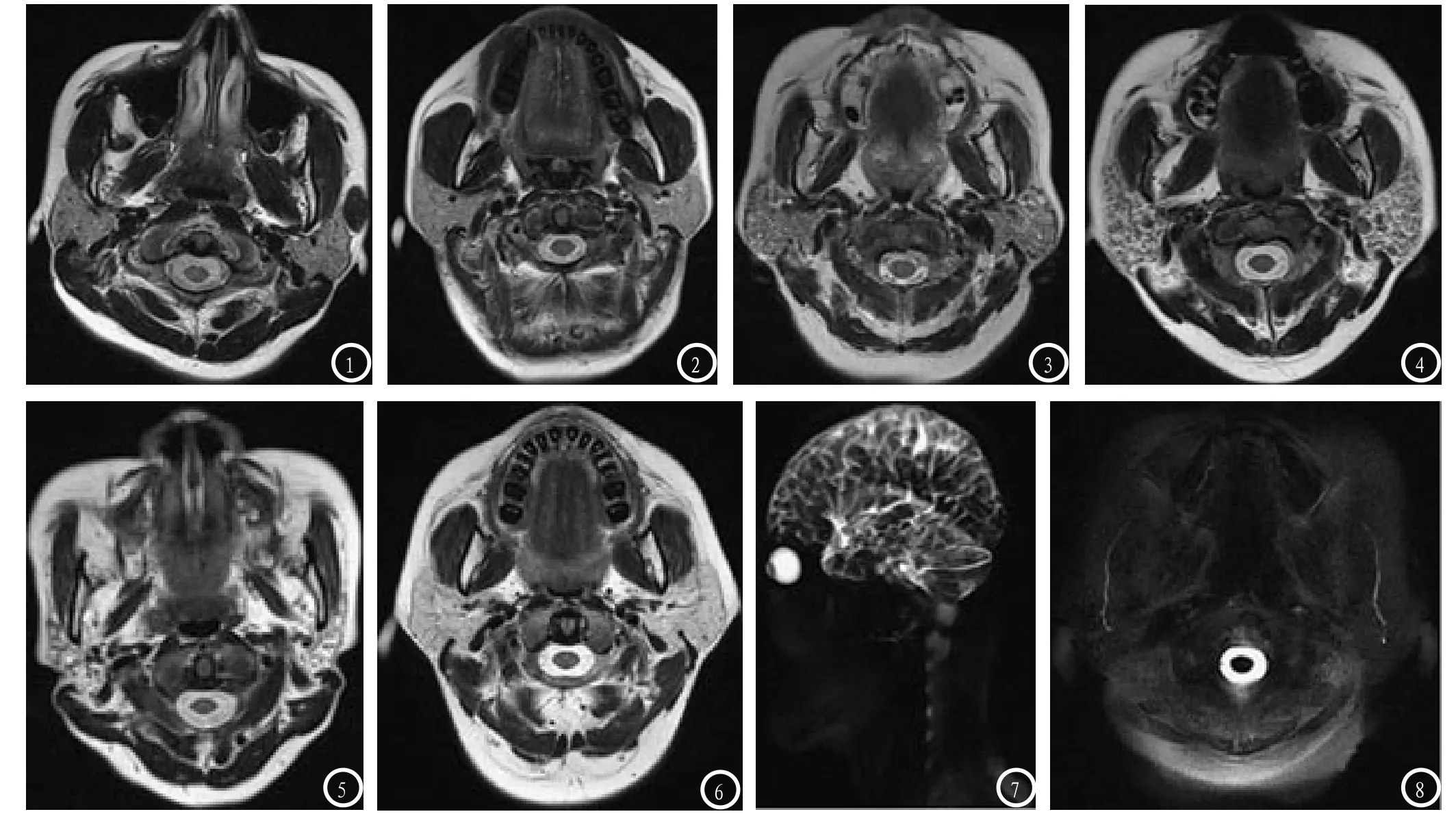
图1-6 为SS患者MRI分型。图1 信号均匀,正常腮腺图像;图2 轻度不均匀型,腮腺实质信号轻度不均匀,T1WI、T2WI上为散在点、条状高信号影;图3 弥漫不均匀型,腮腺实质信号不均匀,弥漫分布着直径约<2m的小结节,结节间隙清晰,散在网格状高信号影;图4 多发结节型,实质内散在分布着直径约>2mm的结节,结节间隙清楚或模糊,弥漫分布着条索状高信号影;图5 纤维化萎缩型,腺体体积缩小,信号不均,弥漫分布斑片状高信号;图6脂肪型,腺体信号欠均匀,腮腺组织在T1WI、T2WI为弥漫性高信号,T2WI压脂相呈低信号,正常腺体基本消失。图7-8 为SS患者的MRS图像。图7 为矢状位,显示主导管粗细不均伴有末梢导管点、球状扩张;图8 为横断位,显示主导管粗细不均、边缘毛糙。
本研究中SS组腮腺的MR表现与正常对照组明显不同,对照组无其他四型表现。本研究SS组腮腺II型MRI表现为腮腺实质信号不均匀,弥漫分布着直径约<2mm的小结节,结节间隙清晰,散在网格状高信号影,可伴有末梢导管点状扩张。淋巴细胞弥漫浸润腺小叶,腺小叶轮廓仍完整,此为弥漫均匀结节的病理基础,此型发生率最高。III型MRI表现为实质内散在分布着直径约>2mm的结节,结节间隙清楚或模糊,弥漫分布着条索状高信号影,末梢导管点、球状状扩张。此型病理基础为淋巴细胞浸润,纤维组织增生,局部腺小叶融合形成结节样。IV型MRI表现为腺体体积缩小,信号不均匀,弥漫分布斑片状高信号,可伴有末梢导管腔洞样扩张。由于腺体内淋巴细胞的广泛浸润最终小叶结构广泛破坏和大量纤维组织增生,是慢性炎症的结果。V型为脂肪型,MRI表现为腮腺内弥漫性脂肪信号,正常腺体基本消失。脂肪浸润为不可逆性改变,腮腺功能严重受损。
I-V型腺体内均有不同程度的脂肪浸润,目前,SS脂肪沉积原理尚不明确,可能是淋巴细胞浸润组织细胞,逐渐纤维化,周围的淋巴细胞或其他细胞产生细胞因子和其他分化的介质因子,增生的成纤维细胞又反过来通过诱导区分各种因子产生脂肪细胞。免疫系统中存在一种过氧化物酶体增殖物激活受体(PPAR-γ),它是一种有效的调控脂肪生成的受体,这进一步说明脂肪沉积和自身免疫病关系密切[6-7]。
笔者认为,MRI扫描软组织分辨率较高,能较敏感的显示SS腺体脂肪浸润情况,为SS腮腺的诊断提供诊断依据。
在以上各型中,II型最为多见,见于37.5%的SS患者,III、IV型较多见,II、III、IV型在MRI表现中特异性均最高,但其敏感性仅为37.5%、17.5%、28.8%。当淋巴浸润发展到腺体外时,可以表现为腺体周围的淋巴结肿大,反映了干燥综合征的淋巴细胞浸润由腺体内向腺体外组织发展的病理过程,T2WI冠状位上可以直观观察到淋巴结肿大及周围组织情况。
SS组患者的病程4个月~20年不等,腮腺大小的改变与病变不同时期密切相关,腮腺MRI信号改变与腮腺大小有明显的相关性。由于MRI多平面成像的特点,便于测量腮腺各个径线的大小。SS组中,I型各径线大于其他三型;IV型各径线均明显低于其他三型和对照组,SS晚期腮腺因淋巴细胞积聚,腺体小叶结构破坏和重度纤维化,造成腮腺缩小;II、III型腮腺各个径线值介于两者之间。
本研究显示SS患者腮腺的MRS可以表现末梢导管点状、球状或腔洞样扩张,但部分SS腮腺病变严重的患者并没有显示末梢导管扩张,其原因可能为MRS空间分辨率低,借助于自然状态下导管内液体显像,而SS患者唾液腺功能受损,分泌唾液量较少所致[8]。
SS腮腺病变注意与腮腺肿瘤和腮腺炎相鉴别。腮腺肿瘤好发于单侧腮腺,无口眼干燥等症状,MRI检查可见明显肿块影[9]。腮腺炎常累及双侧的弥漫性病变,起病急,好发于儿童,伴有颈部淋巴结的肿大,MRI表现可为弥漫性腮腺肿大,但无腮腺各级腺导管扩张情况;而SS累及腮腺病变好发于中老年人,起病缓慢,常伴有腮腺各级导管扩张,结合影像学和临床病史不难鉴别。
本研究的局限性在于只是对SS患者的MRI表现特点进行了初步分析,未将此结果和临床、实验室检查的相关性进行分析,另外,本研究为横断面研究,缺乏连续随诊的资料,对于腮腺治疗前后MRI影像的变化尚需进一步研究。
[1]许洪敏,嵇鸣.干燥综合征的腮腺3.0T MR检查.中国临床医学影像杂志,2014,25(5):318-320.
[2]Vitali C, Bombardieri S, Jonsson R,et al. Classification criteria for sjogren’s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group[J].Ann Rheum Dis,2002,61(6):554-558.
[3]中华医学会风湿病学分会.干燥综合征诊治指南(草案).中华风湿病学杂志.2003,7(7):446-447.
[4]Morimoto Y, Tanaka T, Yoshiokal, et al. Ultrasonography of salivary glands in primary Sjogren’s syndrome: A comparison with magnetic resonance imaging and magnetic resonance sialography of parotidglands[J]. Rheumatology,2004,43(7):875-879.
[5]顾呋丽,谭海波,邹和建,等.99mTc腮腺动态显像对干燥综合征诊断价值的研究[J].中华风湿病学杂志.2006,10(6):335-337.
[6]Lzumi M, Eguchi K, Nakamura H,et al. Premature fat deposition in the salivary glands associated with Sjogren’syndrome: MR and CT evidence[J].AJNR AM J Neuroradiol,1997,18(5):951-958.
[7]Lzumi M, Eguchi K, Ohki M, et al.MR imaging of the parotid gland in Sjogren’s syndrome: a proposal for new diagnostic criteria[J].AJR AM J Roentgenol,1996,166(6):1483-1487.
[8]丁长伟,郭启勇,邢晓菲,等.干燥综合征的MRI表现.中华放射学杂志.2014,48(5):386-390.
[9]邱喜雄,夏军,雷益,胡若凡,杜立新.腮腺病变的MRI诊断和鉴别诊断[J].中国CT和MRI杂志,2009,04:34-36.
(本文编辑: 刘龙平)
MRI Features of the Parotid Gland in Sjogren’s Syndrome
MA Guang-hui, DONG Ying, YE Chun-tao, et al., MRI Room, East Hospital Affiliated to Fudan University, Shanghai, 200040, China
ObjectiveTo investigate MR imaging features of the parotid gland in sjogren's syndrome(SS). We summarized and analysed MRI manifestations of the parotid gland, and analysed the catheter dilation of performance of the MR sialography (MRS) imaging preliminary, in order to improve the diagnostic value of MR for the disease.MethodsEighty cases of SS were seleted as research subjects and fifty cases with non-SS patients as a control group. All the subjects underwent conventional MRI of the parotid gland and MRS. MRI sequences including plain axial T1WI, T2WI, T2 with fat suppression sequences in axial, coronal and parotid duct water imaging sequence. Then, the image acquisition was analysed.Results160 parotid glands were divided into five types by parotid MRI signal features: 0 type (n=0 gland), I type (n=20), II(60), III type (n=28), IV type (n=46),V type (n=6). Signal intensity of the most parotid glands in control group was homogeneous: 0 type (n=80), 1 type (n=20). The types of II、 III、IV had high specificity, and the sensitivities were 37.5%、17.5%、28.8%. The size of parotid gland in the SS group (especially atrophy type) was significantly smaller than that of other group.The MRS manifestations of parotid gland in patients with SS were bilateral lesions, which showed diffuse expansion in peripheral catheter.ConclusionMRI can well show the changes of parotid gland morphology and signals in patients with SS. Parotid duct water imaging, the use of saliva natural contrast function for a noninvasive sialography examination, can visually reflect various duct dilatation in parotid gland, which can provide objective imaging evidence for diagnosing the disease.
Sjogren's Syndrome; Parotid Gland; Magnetic Resonance Imaging; Magnetic Resonance Sialography
R593.2;R445.2
A
10.3969/j.issn.1672-5131.2016.03.001
嵇 鸣
2015-02-15

