阿特拉津的在线监测预警方法初探
陈小娟,潘晓洁,邹怡,万成炎
(水利部水工程生态效应与生态修复重点实验室,水利部中国科学院水工程生态研究所,湖北武汉430079)
阿特拉津的在线监测预警方法初探
陈小娟,潘晓洁,邹怡,万成炎
(水利部水工程生态效应与生态修复重点实验室,水利部中国科学院水工程生态研究所,湖北武汉430079)
为探索我国水体阿特拉津污染的在线监测预警方法,利用藻类在线水体监测系统(A-TOX)研究了阿特拉津对蛋白核小球藻(Chlorella pyrenoidosa)、莱茵衣藻(Chlamydomonas reinhardtii)、斜生栅藻(Scenedesmus obliquus)的光合抑制作用。结果表明,该系统检测出低浓度阿特拉津在短时间(0.5 h、1 h、2 h)内对3种绿藻光合作用的抑制效应随着阿特拉津浓度的增加而显著上升;莱茵衣藻对阿特拉津最敏感。在线监测预警我国水体阿特拉津污染时,建议采用莱茵衣藻作为A-TOX的测试藻类;以3 μg·L-1作为阿特拉津污染的预警浓度值时,作用间隔时间0.5 h、光合抑制率3%可以作为A-TOX预警设置的一种参考,但在应用时还需根据监测水体实际情况进行校正。
阿特拉津;敏感藻类;光合抑制率;在线监测预警
随着工农业的迅速发展,水环境污染问题逐渐受到关注,水环境的生物监测技术也得到不断发展。传统生物监测主要是通过对生物形态、生理或发育与繁殖的变化,以及种群数量、群落生态系统等方面的变化进行监测统计。但是,这往往需要复杂的人工操作,实验周期较长,且不能连续监测,因而不能及时反映水体状况,在水环境监测预警应用中具有一定的局限性。20世纪80年代后,生物和现代电子科技的发展使生物信息检测逐渐数字化、智能化,进而建立了在线水体生物监测技术,通过连续地检测不同指示生物的行为或生理方面的变化,实现了对水环境自动、实时的监测和及时预警。根据选用的指示生物,应用较多的在线生物监测系统主要包括以下几种类型:细菌在线生物监测系统、藻类在线生物监测系统、水蚤在线生物监测系统、双壳软体动物在线生物监测系统和鱼类在线生物监测系统。德国、荷兰、英国、美国、日本和韩国等已将不同类型的在线水体生物监测系统应用于河流、水厂等水环境监测预警。Arnd等[1]将欧洲化学局化学物质数据库中近694种化学物质的生物毒性研究数据进行统计分析显示:相对于鱼类、蚤类毒性实验结果,藻类生长抑制实验所获得的EC50/LC50值最低的只有43.5%[2]。因此,以藻类为指示生物的在线监测系统如德国bbe公司生产的bbe algae toximeter(简称A-TOX)、DF algae test等通过测试水体对绿藻光合效率的影响以反映水体污染的综合毒性状况,成为欧洲河流(如莱茵河、易北河、缪斯河)和饮用水源水体污染监测预警的有力工具[3]。
阿特拉津(Atrazine),又名莠去津,是一种选择性内吸传导型苗前、苗后除草剂,在世界很多国家的农业生产中被广泛应用[4]。我国在20世纪80年代初开始使用阿特拉津,此后平均每年用量增加20%,生产与使用量已居世界前列[5]。但已有研究显示,阿特拉津具有干扰内分泌、影响机体抗氧化系统、损伤机体组织器官等方面的生物毒性作用[6、7]。阿特拉津具有较大的极性、水溶性及稳定性,通过降雨或农田灌溉等多种途径可从土壤迁移到水体,从而对水生生态环境和人类饮用水源构成潜在的威胁[8]。在美国、法国、瑞士等许多国家河流、湖泊、水库等水体中发现有阿特拉津残留[9-11]。例如,美国工程兵师团堪萨斯管区水库阿特拉津污染的监测结果显示,有10座水库坝前最高浓度超过了3 μg·L-1,乌龟溪水库来水阿特拉津最大浓度达到了41.2 μg·L-1[12]。我国太湖、淮河、辽河、北京官厅水库、中国香港地区水库和河水等地表水体中也有阿特拉津污染的研究报道[13-17],其中淮河信阳、阜阳、淮南、蚌埠4个监测断面检测到的阿特拉津最高质量浓度甚至达到81.3 μg·L-1[18]。
由于使用量大、残留期长、检出率高和具有干扰内分泌等作用,阿特拉津污染受到广泛的关注,因而对水体阿特拉津污染进行长期、连续的监测十分必要。目前,国内有关生物在线监测预警的应用研究较少。如何科学应用在线水体生物监测系统,更好地进行水体阿特拉津污染的在线监测预警,尚待研究探索。为此,本文利用一种国内外应用比较广泛的藻类在线监测系统A-TOX开展阿特拉津的在线监测预警方法的初步探索研究,选择绿藻中应用广泛的蛋白核小球藻、斜生栅藻、莱茵衣藻作为系统的测试藻类,通过研究比较阿特拉津对3种不同藻类光合作用的影响来筛选敏感测试藻类,进而摸索阿特拉津在线监测预警系统的设置。
1 材料与方法
1.1 测试藻种及培养基
选取蛋白核小球藻(Chlorellapyrenoidosa,FACHB9#)、斜生栅藻(Scenedesmusobliquus,FACHB416#)、莱茵衣藻(Chlamydomonas reinhardtii,FACHB 479#)作为测试藻类。藻种来自中国科学院水生生物研究所淡水藻种库。采用SE培养基,在温度25℃、光照4 000 Lx条件下通气培养。
1.2 测试农药
阿特拉津,纯度99.9%,购自美国百灵威(Accustandard.Inc)。用丙酮助溶,蒸馏水配制母液备用。分别加不同量的阿特拉津母液至2 L蒸馏水中配制为2.5、5、10、20、40 μg·L-1的溶液,供试验备用。
1.3 在线监测系统测试
分别以蛋白核小球藻(C.pyrenoidosa)、莱茵衣藻(C.reinhardtii)、斜生栅藻(S.obliquus)作为测试生物,采用藻类在线水体监测系统A-TOX研究阿特拉津对3种藻类的光合作用的抑制效应。
该在线水体监测系统的基本构造和测试原理详见李明等[19]的文献。藻类光合活性的计算公式为

式(1)中:Genty为藻类光合活性;F0为没有背景光时的荧光反应;Fm为有强背景光时的荧光反应。光合抑制率为样品水与参比水中藻类光合活性之差,计算公式为
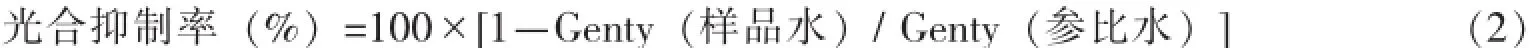
将对数期藻细胞悬液接种至A-TOX的培养罐中,温度设置为25℃,藻细胞浓度设置为2 000 μg·L-1。当A-TOX培养罐中藻细胞浓度达到设定值时,开始测试。
A-TOX在线监测阿特拉津的作用间隔时间分别设置为0.5 h、1 h、2 h,其监测总时间分别达3 h、6 h和12 h以上。系统采用蒸馏水为参比水,以10 μg·L-1的敌草隆溶液为标准毒物。
1.4 数据处理与分析
利用A-TOX自动记录的光合抑制率进行数据分析。基于Probit模型对阿特拉津浓度、藻类光合效率抑制率进行统计分析,得出不同反应间隔时间下阿特拉津对3种藻类光合影响的EC50值。利用Statistic软件对不同实验组间的差异进行多因素方差分析(显著差异水平为P<0.05)。
2 结果
2.1 阿特拉津对蛋白核小球藻(C.pyrenoidosa)的光合抑制作用
不同作用时间、不同浓度阿特拉津对蛋白核小球藻光合作用的抑制率见图1。2.5 μg·L-1阿特拉津作用0.5 h、1 h未对蛋白核小球藻光合作用产生抑制作用,作用时间延长到2 h时产生了轻微的抑制(平均抑制率为2.33%);随着浓度的增加,阿特拉津对蛋白核小球藻光合作用的抑制率逐渐增大。除2.5、10 μg·L-1浓度外,其他浓度组的蛋白核小球藻呈现出作用0.5 h时抑制率最高的现象。
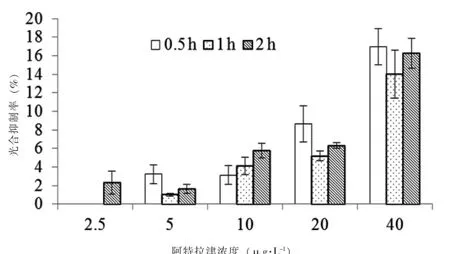
图1 阿特拉津对蛋白核小球藻的光合抑制作用Fig.1 Photosynthetic inhibition rate of Atrazine on C.pyrenoidosa
2.2 阿特拉津对莱茵衣藻(C.reinhardtii)的光合抑制作用
不同作用时间、不同浓度阿特拉津对莱茵衣藻光合抑制率如图2。当浓度为2.5 μg·L-1,阿特拉津在短时间(0.5 h)就对莱茵衣藻光合作用产生了抑制作用,平均抑制率达到2.59%,但光合抑制率并未随作用时间的延长而显著提高。随着浓度的增加,阿特拉津对莱茵衣藻光合作用抑制率显著提高。但同一浓度组中,抑制率并未随作用时间延长而显著增加,总体上作用1 h时的光合抑制率较作用0.5 h和2 h时低。
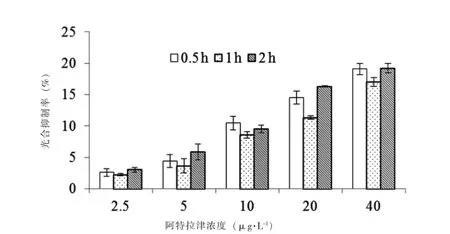
图2 阿特拉津对莱茵衣藻的光合抑制作用Fig.2 Photosynthetic inhibition rate of Atrazine on C.reinhardtii
2.3 阿特拉津对斜生栅藻(S.obliquus)的光合抑制作用
不同作用时间、不同浓度阿特拉津对斜生栅藻光合抑制率如图3所示。当浓度为2.5 μg·L-1,阿特拉津未对斜生栅藻光合作用产生抑制作用。作用时间为2 h时,光合抑制率总体随着浓度增加显著增大;作用时间为0.5 h时,阿特拉津对斜生栅藻光合作用抑制率在各浓度组总体无显著差异,除浓度为40 μg·L-1外,作用时间为1 h的各浓度组间也无显著差异。同一浓度组,总体上作用2 h时的光合抑制率显著高于作用0.5 h、1 h试验组,但作用0.5 h和2 h试验组间的光合抑制率差异不显著。
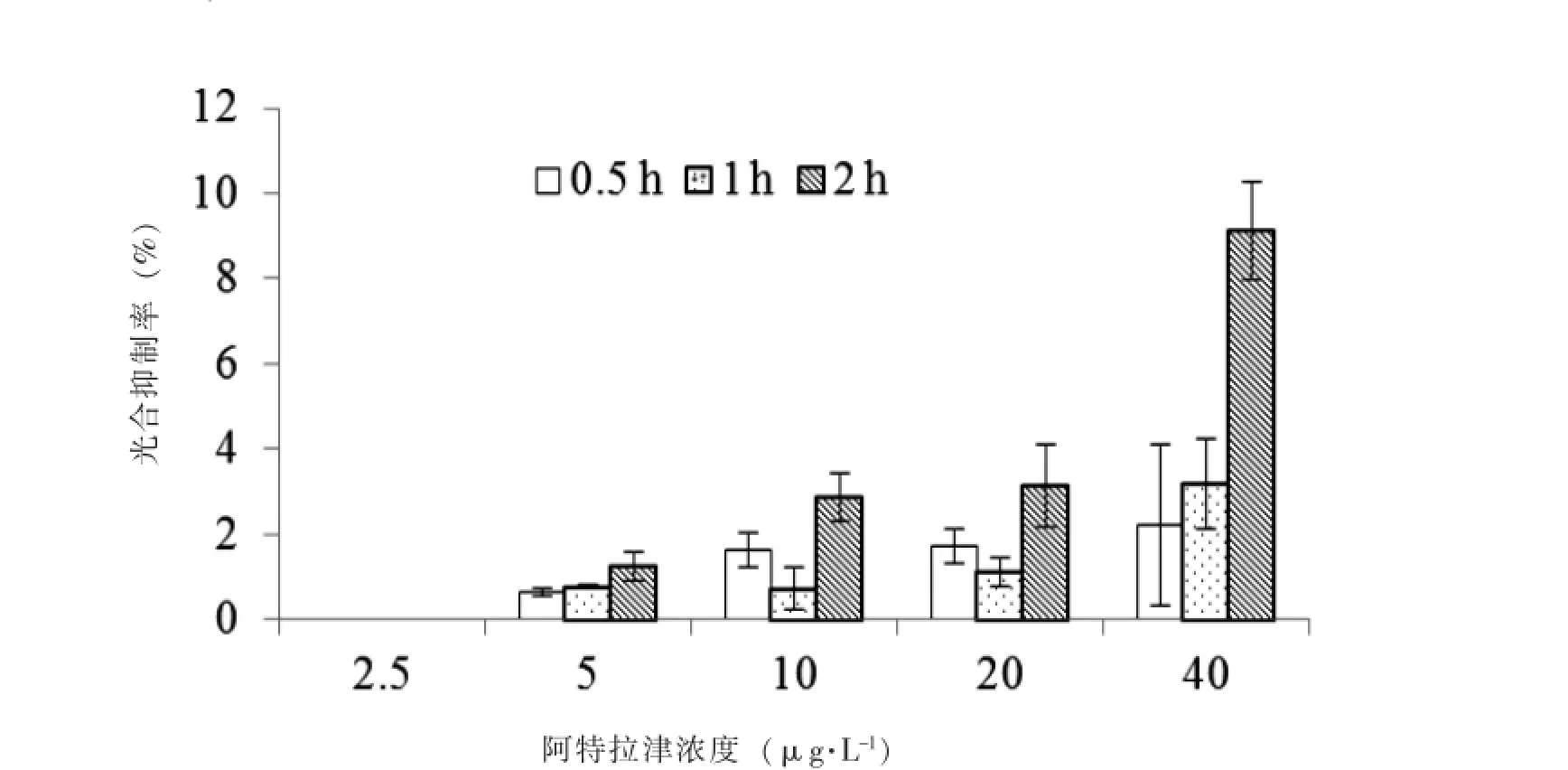
图3 阿特拉津对斜生栅藻的光合抑制作用Fig.3 Photosynthetic inhibition rate of Atrazine on S.obliquus
3 讨论
徐小花等在研究阿特拉津对铜绿微囊藻和四尾栅藻生长的影响时发现,在0.001~5 mg·L-1质量浓度范围内,阿特拉津对铜绿微囊藻和四尾栅藻的生长表现出低浓度刺激、高浓度抑制的效应,且阿特拉津对四尾栅藻的刺激效应明显大于铜绿微囊藻[20]。也有研究显示,在0.01 mg·L-1阿特拉津处理下,绿藻和蓝藻生长被抑制,硅藻生长却增加[21]。本文分别以3种绿藻为测试生物,利用在线毒性监测系统检测到了低浓度阿特拉津(2.5~40 μg·L-1)在短时间(0.5 h、1 h、2 h)作用下对3种藻类光合作用的抑制作用,但未出现促进作用。生长促进作用可能与低浓度、较长时间胁迫下一些藻类光合作用的适应性有关[22]。阿特拉津能够通过抑制藻类光合作用基因的表达,降低光合作用色素叶绿素a和藻胆蛋白的合成,切断电子传递链等影响光合作用[23、24]。因此,通过在线监测系统短时间内检测绿藻光合抑制率可以及时监测预警水体阿特拉津污染。
不同藻类对阿特拉津的敏感度有差异,敏感藻类往往因毒性评价方法不同而改变。Tang[22]等分别研究了阿特拉津作用7 d、14 d、21 d、28 d时对4种绿藻和4种硅藻生长和光合作用的影响,100 μg·L-1阿特拉津能显著抑制绿藻生长,而对硅藻生长的显著抑制作用则在250 μg·L-1处理下才显现,绿藻总体上比硅藻更为敏感;阿特拉津处理7天对4种绿藻Chlamydomonas sp.、Chlorella sp.、Pediastrum sp.、Scenedesmus quadricauda的叶绿素a含量影响的EC50分别为46.5、72.9、536.6、171 μg·L-1。吴颖慧等研究阿特拉津对7种藻类的96 h生长抑制效应表明,生长抑制效应由强到弱分别为斜生栅藻、柱孢鱼腥藻、莱哈衣藻、菱形藻、普通小球藻、羊角月牙藻和镰形纤维藻,其中普通小球藻、羊角月牙藻的96 h-EC50分别约为0.06 mg·L-1、0.09 mg·L-1[25]。Ma等研究了40种除草剂对羊角月牙藻(Raphidocelis subcapitata)、普通小球藻(Chlorella vulgaris)的96 h急性毒性效应,获得阿特拉津EC50分别为0.11 mg·L-1、0.43 mg·L-1[26、27]。本文利用A-TOX研究阿特拉津对3种藻类的光合抑制作用结果表明,在短时间(0.5 h)低浓度(2.5 μg·L-1)阿特拉津处理下,莱茵衣藻光合作用受到轻微影响,抑制率为2.6%,但未检测到对小球藻、栅藻的光合抑制作用;10 μg·L-1阿特拉津已经能够显著抑制莱茵衣藻的光合作用(平均抑制率为9.52%),而对小球藻光合作用的显著抑制在浓度达到20 μg·L-1时才显现(平均抑制率为6.71%),栅藻光合作用即使在40 μg·L-1处理下也不显著(平均抑制率为4.84%)。基于Probit模型对阿特拉津浓度、藻类光合作用抑制率进行统计分析得出,不同作用时间下,阿特拉津对3种藻类光合抑制作用的EC50值见表1。从表1结果可以看出,莱茵衣藻对阿特拉津最为敏感,其次是蛋白核小球藻,最后是斜生栅藻。因此,在线水体监测系统(A-TOX)对阿特拉津污染的测试生物应采用莱茵衣藻。

表1 基于光合抑制率的阿特拉津对3种藻类毒性作用的EC50值Table 1 The EC50of toxicity of Atrazine to three species of algae based on the photosynthetic inhibition rate
目前,美国、欧共体和我国均把阿特拉津列入内分泌干扰剂化合物名单。根据《中华人民共和国地表水环境质量标准(GB 3838-2002)》,集中式生活饮用水地表水源地阿特拉津的浓度限值为3.0 μg·L-1。3.0 μg·L-1阿特拉津胁迫下,不同作用时间对莱茵衣藻产生的光合抑制率见图4。图中结果显示,作用时间为0.5 h时,光合抑制率变动范围为2.37%~3.64%。作用间隔时间为0.5 h和1 h时,光合抑制率约为3%±0.5%和3.2%±1.5%,无显著性差异;作用间隔时间为2 h时,光合抑制率显著增加到6.7%±1.6%。因此,利用A-TOX进行水体阿特拉津污染在线监测预警时,可采用莱茵衣藻为测试生物,系统预警参数可设置为:作用间隔时间为0.5 h、报警值为3%光合抑制率。
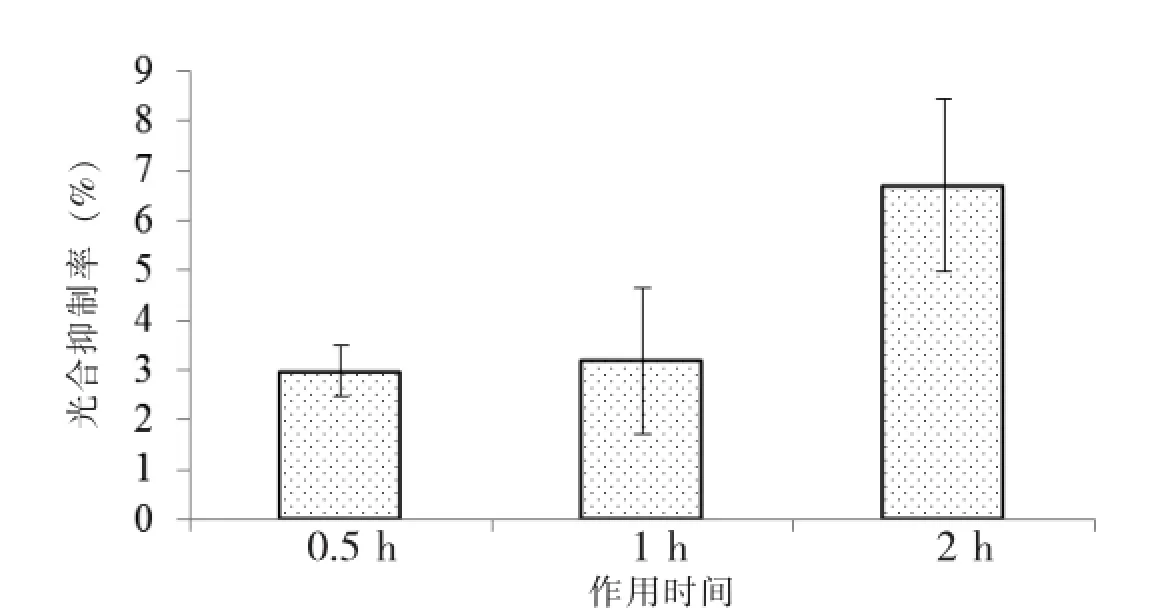
图43 .0 μg·L-1阿特拉津在不同作用时间下对莱茵衣藻的光合抑制作用Fig.4 Photosynthetic inhibition rate of 3.0 μg·L-1Atrazine to C.reinhard under the diffirent time
作用间隔时间0.5 h时,阿特拉津浓度与莱茵衣藻光合作用抑制率间的相关关系见图5。由于水环境中污染物往往是多来源、多种类的复合污染,它们之间可能存在拮抗、相加和协同作用;同时,由于每种生物的特性不同,其反应敏感的污染物也会有所不同。本文结果可为水体污染在线监测提供一种参考,但在应用时还需根据监测水体实际情况进行校正。
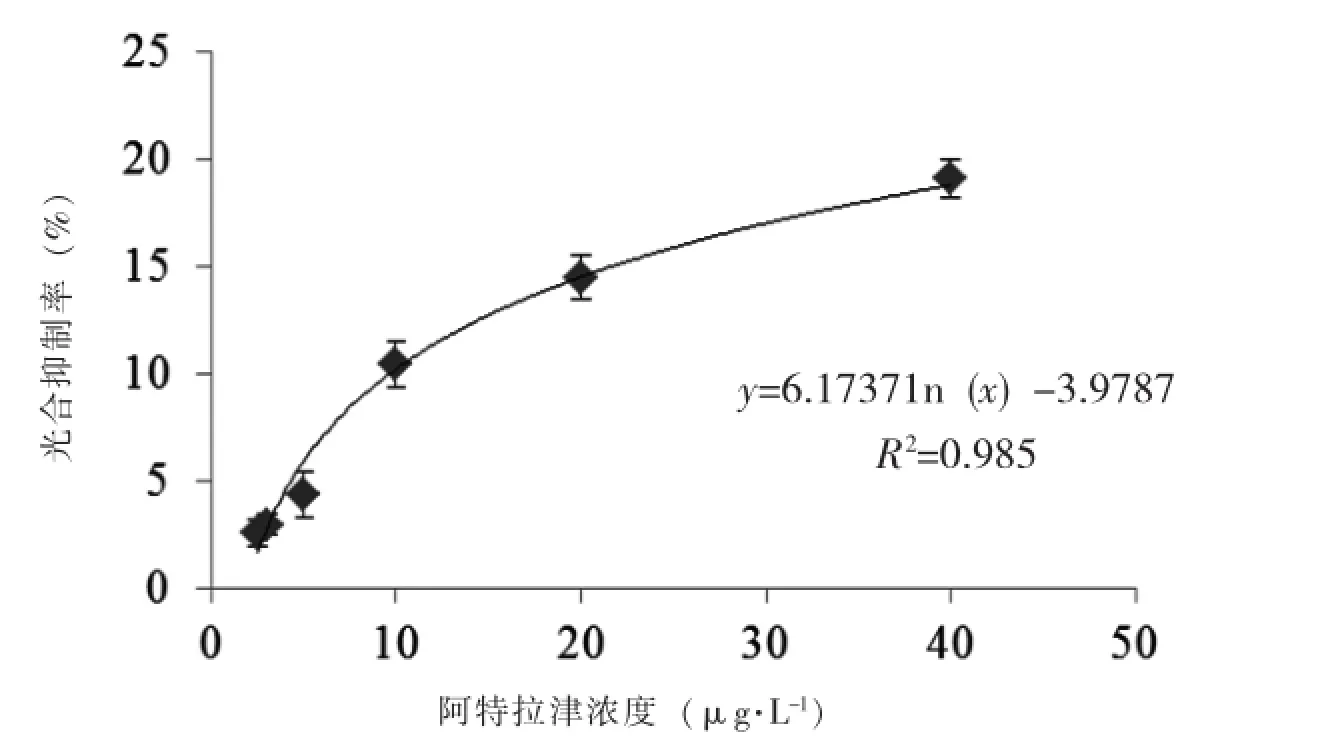
图5 作用时间0.5 h时阿特拉津浓度与莱茵衣藻光合抑制率间的相关关系Fig.5 The relationship between photosynthetic inhibition rate of C.reinhardtii and the concentration of Atrazine during 0.5 h
为全面地监测水体环境,做好水体各种污染在线监测与预警工作,可借鉴发达国家有关水体在线监测预警的先进技术、方法和运行管理经验,采取细菌、藻类、鱼类等多种在线生物监测系统同时进行监测,或者在水样前处理时设置水样自动浓缩装置,从而提高水体在线监测预警的敏感性[3]。在生物在线监测的同时,开展水体理化环境的在线监测与分析。当生物在线监测发出报警时,水体理化在线监测能及时提供水体污染物种类及其浓度的变化等方面的重要信息,可为管理部门制定相应应急处理措施提供全面的科学依据。
4 结论
利用藻类在线水体监测系统(A-TOX)能检测出低浓度阿特拉津(2.5~40 μg·L-1)在短时间(0.5 h、1 h、2 h)作用时对3种绿藻的光合抑制作用;随着浓度的增加,阿特拉津对3种藻类的光合抑制率显著上升。莱茵衣藻对阿特拉津最敏感,可以作为A-TOX的测试藻类进行水体阿特拉津污染的在线监测预警。以3 μg·L-1作为阿特拉津污染的预警浓度值时,作用间隔时间0.5 h、光合抑制率3%可以作为藻类在线水体监测系统预警设置的一种参考,但在应用时还需根据监测水体实际情况进行校正。
[1]ARND W,BIRGIT S K,JOAQUIN B F,et al.Acute Toxicity Data:A Comprehensive Comparison of Results of Fish,Daphnia,and Algae Tests with New Substances Notified in the European Union[J].Environmental Toxicology and Chemistry,2000,19(7):1931-1933.
[2]邹曦,万成炎,潘晓洁,等.水环境在线生物监测的研究与应用[J].环境科学与技术,2011,34(12H):155-159.
[3]PENGDERS E J M.Development of Aquatic Biomonitoring Models for Surface Waters Used for Drinking Water Supply[D].Thesis:Wageningen University,Wageningen,NL,2011.
[4]刘长令.世界农药大全·除草剂卷[M].北京:化学工业出版社,2002.
[5]万年升,顾继东,段舜山.阿特拉津生态毒性与生物降解的研究[J].环境科学学报,2006,26(4):552-560.
[6]李清波,黄国宏,王颜红,等.阿特拉津生态风险及其检测和修复技术研究进展[J].应用生态学报,2002,13(5):625-628.
[7]孟顺龙,胡庚东,瞿建宏,等.阿特拉津在水环境中的残留及其毒理效应研究进展[J].环境污染与防治,2009,31(6):64-68、83.
[8]叶新强,鲁岩,张恒.除草剂阿特拉津的使用与危害[J].环境科学与管理,2006,31(8):95-97.
[9]BUSTER H R.Atrazine and Other S-triazine Herbicide in Lakes and Rains in Switzerland[J].Environmental Science&Technology,1990,24(7):1049-1058.
[10]KOLPIN D W,SNECKFAHRER D,HALLBERG G R,et al.Temporal Trends of Selected Agricultural Chemicals in Lowa’s Groundwater,1982-1995:are Things Getting Better?[J].Journal of Environmental Quality,1997,26(4):1007-1017.
[11]TISSEAU M A,FAUCHON N,VANDEVELDE T.Pesticide Contamination of Water Resources:A Case Study-the Rivers in the Paris Region[J].Water Science&Technology,1996,34(7-8):147-152.
[12]孙小利.美国工程兵师团对堪萨斯管区内水库中阿特拉津的长期监测[J].水利技术监督,2011,19(4):9-12.
[13]塔娜,冯建芳,孙成,等.太湖梅梁湾水体中阿特拉津的毛细管气相色谱法测定[J].环境污染与防治,2005,27(8):634-636.
[14]任晋,蒋可,周怀东.官厅水库中阿特拉津残留的分析及污染来源[J].环境科学,2002,23(1):126-128.
[15]任晋,蒋可.官厅水库水中莠去津及其降解产物残留的分析[J].分析实验室,2004,23(12):17-20.
[16]严登华,何严,王浩.东辽河流域地表水体中Atrazine的环境特征[J].环境科学,2005,26(3):203-208.
[17]CAI Z W,WANG D L,MA W T.Gas Chromatography/Ion Trap Mass Spectrometry Applied for the Analysis of Triazine Herbicides in Environmental Waters by An Isotope Dilution Technique[J].Analytica Chimica Acta,2004,503(2):263-270.
[18]王子键,吕怡兵,王毅,等.淮河水体取代苯类污染及其生态风险[J].环境科学学报,2002,22(3):300-303.
[19]李明,潘晓洁,陈小娟,等.一种新型水体在线毒性监测系统——bbe Algae Toximeter的构造、功能及调试效果[J].三峡环境与生态,2011,33(6):46-50.
[20]徐小花,肖铭,潘慧云,等.阿特拉津对铜绿微囊藻和四尾栅藻生长的影响[J].生态与农村环境学报,2008,24(1):72-76.
[21]SHEHATA S A,ABOUWALY H F.Effect of Triazine Compounds on Freshwater Algae[J].Bulletin of Environmental Contamination and Toxicology,1993,50(3):369-376.
[22]TANG J X,HOAGLAND K D,SIEGFRIED B D.Differential Toxicity of Atrazine to Selected Freshwater Algae[J].Bulletin of Environmental Contamination and Toxicology,1997,59(4):631-637.
[23]QIAN H F,SHEGN G D,LIU W P,et al.Inhibitory Effects of Atrazine on Chlorella Vulgaris as Assessed by Real-time Polymerase Chain Reaction[J].Environmental Toxicology&Chemistry,2008,27(1):182-187.
[24]QIAN H F,PAN X J,ZHOU D M,et al.Analyses of Gene Expression and Physiological Changes in Microcystis Aeruginosa Reveal the Phytotoxicities of Three Environmental Pollutants[J].Ecotoxicology,2012,21(3):847-859.
[25]吴颖慧,蔡磊明,王捷,等.除草剂莠去津对7种藻类的生长抑制[J].农药,2007,46(1):48-51.
[26]MA J Y,WANG S F,WANG P W,et al.Toxicity Assessment of 40 Herbicides to the Green Algae Raphidocelis Subcapitata[J]. Ecotoxicology and Environmental Safety,2006,63(3):456-462.
[27]MA J Y,XU L G,WANG S F,et al.Toxicity of 40 Herbicides to the Green Algae Chlorella Vulgaris[J].Ecotoxicology and Environmental Safety,2002,51(2):128-132.
[责任编辑:和谐]
Study on the Online Monitoring and Early Warning Method for Atrazine
CHEN Xiao-juan,PAN Xiao-jie,ZOU Yi,WAN Cheng-yan
(Key Laboratory of Ecological Impacts of Hydraulic-projects and Restoration of Aquatic Ecosystem of Ministry of Water Resources, Institute of Hydroecology,Ministry of Water Resources and Chinese Academy of Sciences,Hubei Wuhan 430079,China)
In order to study the online monitoring and early warning method for atrazine pollution in water, the toxic effects of atrazine on three green algae species(Chlorella pyrenoidosa,Chlamydomonas reinhardtiiandScenedesmus obliquus)were respectively studied by using one kind of online algae water monitoring system (A-TOX).The results showed that the A-TOX could detect the acute toxicity effects of the low concentration atrazine on the green algae within 0.5 h,1 h and 2 h,respectively.With the increase of the atrazine concentration, photosynthetic inhibition rates of algae increased significantly.It was also found thatChlamydomonas reinhardtiiwas the most sensitive to atrazine.For the online detection of atrazine pollution in Chinese water environment,C.reinhardtiican be used as a test organism of A-TOX.And when a monitoring and early warning of atrazine contaminated concentration limit value is 3 μg·L-1,the early warning parameter values for A-TOX could be that inhibition rate is 3%and detecting time range is 0.5 h,but they also need to be corrected according to the monitored water environment.
Atrazine;sensitive algae;photosynthetic inhibition rate;online monitoring and early warning
X830.2
A
096-2347(2016)03-0001-07
10.19478/j.cnki.2096-2347.2016.03.01
2016-07-22
国家自然科学基金项目(51579159);水利部“948”项目(200902)。
陈小娟(1981—),女,河南许昌人,博士,研究员,主要从事水生态环境监测评价研究。E-mail:chenxiaojuan@mail.ihe.ac.cn

