高效液相色谱-离子阱质谱法测定海洋微藻藻粉中的8种脂溶性毒素
高莉媛, 王艳龙, 陈军辉, 王 帅, 史小星, 石洪华, 郑 立, 2
高效液相色谱-离子阱质谱法测定海洋微藻藻粉中的8种脂溶性毒素
高莉媛1, 王艳龙1, 陈军辉1, 王 帅1, 史小星1, 石洪华1, 郑 立1, 2
(1. 国家海洋局第一海洋研究所, 山东青岛266061; 2. 青岛海洋科学与技术国家实验室, 海洋生态与环境科学功能实验室, 山东青岛 266071)
建立了利用高效液相色谱-电喷雾离子阱质谱(HPLC-ESI-IT-MS)测定海洋微藻藻粉中8种典型脂溶性毒素的分析方法。藻粉样品经超声细胞破碎后, 采用超声波辅助提取法对藻毒素进行提取, 用HPLC-ESI-IT-MS多反应离子监测(MRM)模式对各种毒素(包括大田软海绵酸(OA)、鳍藻毒素1(DTX-1)、扇贝毒素2(PTX-2)、虾夷扇贝毒素(YTX)、原多甲藻酸1(AZA1)原多甲藻酸2(AZA2)、罗环内酯毒素(SPX), 米氏裸甲藻毒素(GYM))进行测定。8种脂溶性藻毒素均在线性范围内线性关系良好(2均在0.991以上), 检出限均介于0.085~1.315 pg之间, 加标回收率在88.5%~111.4%之间, 方法重复性相对标准偏差(RSD)在4.82%~10.17%范围。应用该方法对利玛原甲藻干藻粉中的毒素进行了测定, 分析结果良好, 说明本方法是海洋微藻藻粉中脂溶性藻毒素测定的有效方法。
高效液相色谱-离子阱质谱; 腹泻性贝毒; 海洋微藻
海洋微藻是海洋生态系统中的最主要初级生产者, 具有种类多、数量大、繁殖速度快等特点, 在海洋生态系统的物质循环和能量流动中起着极其重要的作用[1]。海洋微藻也是一类十分重要的海洋生物资源, 许多海洋微藻含有丰富的蛋白质、天然维生素、矿物质、不饱和脂肪酸、多糖以及其他结构独特的初级或次级代谢产物。近几十年来, 人们逐渐注重海洋微藻资源开发, 在生物质能源、食品保健品、医药和禽畜养殖业等方面得到了广泛的开发和利用[2-4]。然而, 在种类众多的海洋微藻中, 有些海洋微藻可以产生生物毒素, 这些生物毒素可以引起人类产生麻痹性、痢疾性、神经性和溶血性等中毒症状[5]。迄今为止, 已发现的海洋微藻生物毒素及其衍生物约有200多种[6], 按溶解性质可分为水溶性毒素和脂溶性毒素, 其中脂溶性毒素约占90%, 在全球范围内分布广泛, 影响巨大。在这些脂溶性毒素中, 特别是大田软海绵酸 (OA)及其衍生物(DTXs), 虾夷扇贝毒素(YTXs), 原多甲藻酸(AZAs), 扇贝毒素 (PTXs), 和罗环内酯毒素 (SPXs)等脂溶性毒素较为常见, 因此, 建立针对干藻粉中多种典型脂溶性藻毒素进行检测的高效方法, 并用于海洋微藻藻粉中常见脂溶性藻毒素的检测, 对保障以藻粉为原料开发的食品、保健品或饲料产品的食用安全性具有重要意义。
用于脂溶性藻毒素检测的分析方法有小白鼠生物分析法、高效液相色谱法、液相色谱-串联质谱法(LC-MS/MS)等[7]。其中LC-MS/MS法灵敏度高、选择性好, 是最理想的脂溶性藻毒素检测方法。目前, 该方法已用于海产品[8]、海洋赤潮藻[9-10]、海水[11]中多种脂溶性藻毒素的测定, 而针对海洋微藻干藻粉的检测研究鲜有报道。本研究以8种常见典型脂溶性藻毒素为目标化合物, 通过对样品前处理实验条件及 HPLC-ESI-IT-MS分析条件的优化, 建立了适用于海洋微藻干藻粉中8种典型脂溶性藻毒素同步测定的新方法。
1 实验部分
1.1 仪器及试剂
1200型高效液相色谱仪, 配有四元泵, 可变波长检测器(VWD), 自动进样器等(美国Agilent公司); 6320型离子阱质谱仪, 配有电喷雾(ESI)离子源(美国Agilent公司); KQ-400KDE型高功率数控超声波仪(昆山市超声仪器有限公司); R201型旋转蒸发仪(上海申生科技有限公司); Himac CR22GII 高速大容量冷冻离心机(日本HITACHI公司); BSA224S-CW型电子天平(德国Sartorius公司); Milli-Q(18.2 MΩ) 超纯水处理系统(美国Millipore 公司); JY92-IIDN型超声细胞粉碎机(宁波新芝生物科技股份有限公司)。
AZA1、AZA2、SPX1、DTX1、OA、YTX、PTX2和GYM标准备品(购于加拿大国家海洋研究中心), 质谱纯氨水(Fluka公司); 色谱纯乙腈和甲醇(美国ACS公司); 水为自制Milli-Q超纯水。实验所用含有毒素的利玛原甲藻(干藻粉)(含有OA和DTX-1两种毒素)和不含毒素的干藻粉(作为样品空白), 均为实验室内培养获得海洋微藻藻体, 然后通过冷冻干燥得到干藻粉。
1.2 对照品溶液的配置
取8种毒素(OA、YTX、DTX-1、AZA1、AZA2、GYM、SPX1、PTX2)标准品各1瓶(0.5 mL), 分别用甲醇稀释后转移至5 mL容量瓶中准确定容, 振荡摇匀, 得到8种典型脂溶性毒素标准储备液(单标)。按照一定的比例分别吸取相应的毒素OA、YTX、DTX-1、AZA1、AZA2、GYM、SPX1和 PTX2单标储备液, 置于10 mL容量瓶中并用甲醇稀释定容, 得8种典型毒素的混合标准储备液, 其中OA、YTX、DTX-1、AZA1、AZA2、GYM、SPX1、PTX2浓度分别为6.843、26.30、25.77、123.7、25.66、5.003、56.42、3.436 μg/L, 所有混标溶液置于–20℃条件下保存备用。
1.3 样品溶液制备
准确称取一定量的海洋微藻干藻粉, 置于10 mL离心管中, 加入6 mL甲醇, 首先采用超声破碎仪细胞破碎3 min, 再采用超声辅助提取30 min, 然后以5000 r/min的转速离心15 min, 将藻体与上清液分离, 再对藻体进行第二次超声辅助提取30 min, 合并两次提取液, 定容到25 mL的容量瓶中, 吸取1 mL 定容液经0.22 μm滤膜过滤并注入样品瓶中, 进样前根据藻粉中毒素的含量对样品溶液进行适当稀释, 确保样品浓度落在线性范围之内。
1.4 色谱质谱条件
液相色谱条件: 采用ZORBAX Extend-C18色谱柱(3 mm×150 mm, 3.5mm, 美国Agilent公司), 流动相A为纯水, B为90%的乙腈(均含有6.6 mmoL/L的氨水), 二元梯度淋洗: T: 0-15-20-45-48 min, 流动相B%: 20%-30%-47.5%-100%-20%, 流速: 0.4 mL/min, 进样体积为10 μL, 柱温: 室温(20℃±2℃)。
质谱条件: 电喷雾电离源, 雾化气压力(N2)40 psi, 干燥气(N2)流速11 L/min, 干燥气温度350℃, 毛细管电压4000V, 质量扫描范围100~1300。根据各组分的色谱保留时间和一级、二级质谱特征优化质谱参数, 按时间分段用多反应离子监测(MRM)模式对各组分进行质谱检测; OA、PTX-2、SPX1、AZA1、AZA2、GYM采用正离子模式(ESI+); DTX-1和YTX采用负离子模式(ESI-), 各化合物的保留时间、MRM选择离子以及目标离子、碰撞能量等参数见表1。
1.5 定性定量方法
通过比较藻粉样品与毒素标准溶液的提取离子色谱 (EIC)峰保留时间及二级质谱图的特征定性离子和定量离子进行目标化合物的定性。藻粉样品中目标化合物二级质谱分析特征离子与标准品二级质谱特征离子相吻合。采用基质标准曲线, 以外标法对藻粉样品中的毒素进行定量。在MRM模式下选择定量离子计算目标化合物EIC峰面积, 代入线性曲线计算样品浓度。试样溶液中待测物的响应值均应在本方法线性范围内。
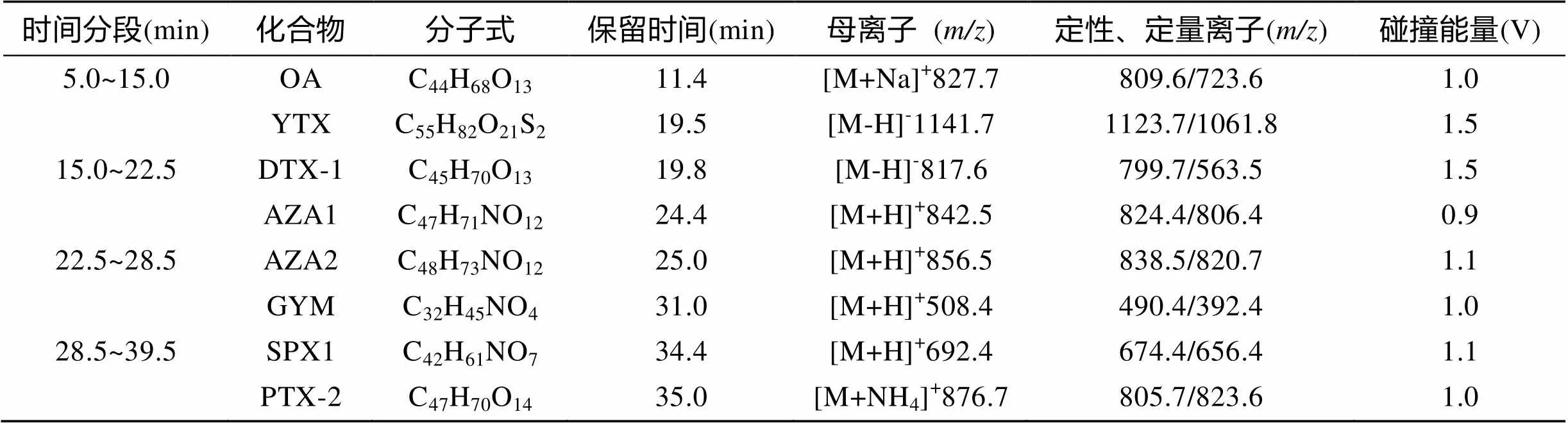
表1 8种脂溶性藻毒素离子阱质谱分析(MRM模式)参数
2 结果与讨论
2.1 色谱质谱条件优化
在前期研究中[11], 采用HPLC-ESI-IT-MS实现了对海水中3种典型脂溶性毒素的有效分离和检测, 该方法采用碱性流动相分离体系, 据文献[12]报道, 碱性流动相分离体系有利于提高不同系列脂溶性毒素的分离。在此基础之上, 选用碱性流动相(pH为11)分离体系, 通过对梯度洗脱程序的进一步优化, 获得了适用于海洋微藻藻粉中8种典型脂溶性藻毒素有效分离的色谱条件, 在最佳色谱分离条件下, 对8种典型脂溶性藻毒素混合标准品进行了一级质谱全扫描分析, 然后, 以MRM模式二级质谱分析定量离子的灵敏度为评价指标, 对二级质谱分析条件进行了进一步优化, 以确定各化合物定量分析的最佳仪器参数(表1), 各化合物MRM模式二级质谱分析EICs见图1, 可以看出各化合物分离良好。
2.2 样品处理方法优化
为了保证样品提取优化结果能反映微藻藻粉样品中毒素的真实提取效率, 本研究使用含有OA和DTX-1毒素的干藻粉样品, 以OA和DTX-1的提取效率为评价指标, 采用单因子实验法, 对提取条件进行优化。
在样品提取过程中选择合适的提取溶剂既能促进目标化合物的提取, 又能消除一些不必要的干扰基质的影响。根据脂溶性藻毒素的化学性质, 选取了6种提取剂(异丙醇、甲醇、乙酸乙酯、二氯甲烷、乙醇、丙酮)在室温(25℃±2℃)条件下超声波辅助提取30 min, 对微藻藻粉中的OA和DTX-1毒素进行了提取。提取结果(图2)显示, 甲醇对这2种脂溶性藻毒素的总体提取效果最好, 要明显高于其它提取溶剂, 所以选择甲醇作为提取剂。
在提取过程中为了降低藻细胞壁对目标化合物包裹的影响, 使目标毒素提取效果更充分, 考察了在提取之前增加超声细胞破碎处理对2种毒素提取效果的影响。实验结果表明, 当细胞破碎时间达到3 min时, 2种目标毒素能得到充分提取, 与不采用细胞破碎处理相比, 2种目标化合物的提取率分别增加了34.93%和30.19%, 说明微藻细胞壁的存在会影响细胞内毒素的溶出, 因此, 有必要在提取过程中增加细胞破碎处理。
在以上的提取条件下通过一次超声提取, 目标化合物并不能得到完全提取, 因此, 考察了不同提取次数对提取效果的影响, 结果如表2所示。可以看出当提取2次后, 两种毒素提取效率均达到98.0%以上, 为了节约提取时间和提取溶剂, 最后选择超声提取2次。
2.3 方法学考察
2.3.1 仪器精密度
取毒素的混合标准品溶液于进样小瓶中, 连续进样6次, 每次进样10 µL, 得到各化合物提取离子峰的峰面积及保留时间, 算出6次进样分析的峰面积及保留时间的相对标准偏差(RSD), 8个化合物峰面积RSD均小于等于9.57%, 保留时间的RSD均小于等于1.20%, 说明仪器方法具有较好的精密度。
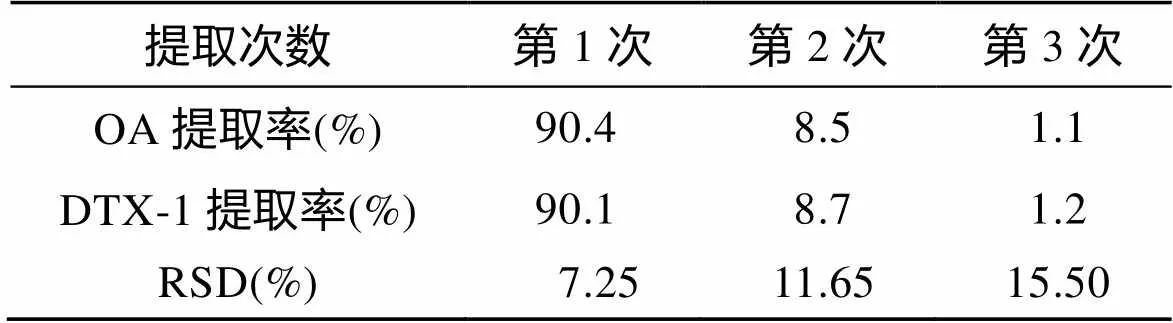
表2 提取次数对两种脂溶性藻毒素提取效率的影响(n=3)
2.3.2 专属性
在最佳的实验条件下, 测定甲醇, 空白藻粉, 以及加入毒素混合标准品溶液的空白藻粉, 结果只在添加了脂溶性藻毒素标准品的藻粉样品中检测出了8种脂溶性藻毒素, 说明该方法具有良好的专属性。
2.3.3 基质效应
海洋微藻粉成分复杂, 其中包含的杂质可能会影响目标分析物的离子化效率, 造成目标化合物质谱信号的抑制或增强, 影响方法检测的灵敏度和结果的准确性。为了评价粗提液中基质对目标化合物质谱分析的影响, 采用空白藻粉样品的提液配制8种脂溶性藻毒素混标, 以甲醇配制的同一浓度水平的混合标准溶液作为对比, 通过MS/MS分析测得各目标化合物的峰面积。基质效应(ME)按公式计算:
(%)=(s–x)/s×100 (1)
式中,x为空白藻粉提取液配制毒素混标中目标化合物的峰面积;s表示相同浓度水平甲醇配置标准溶液中毒素的峰面积。基质效应实验结果见表3, “–”表示信号增强, “+”表示信号抑制, 基质对YTX和GYM检测的影响较大, 对GYM 的信号抑制率为27.01%, 对YTX 的信号增强率为29.47%, 而对其他6种毒素的影响相对较小(均未超过7.19%)。说明藻粉提取液中的基质组分对各目标化合物有不同程度的抑制作用, 基质影响不可忽略。
2.3.4 检出限和标准曲线
由于基质效应不可忽视, 标准品在甲醇溶液中的质谱响应与其在实际样品基质中的响应不同, 因此, 采用基质标准曲线外标法对目标化合物进行定量, 以降低基质效应对测定结果准确度的影响。取8种脂溶性毒素混合标准溶液, 使用空白干藻粉提取液对其进行梯度稀释, 稀释倍数分别为1、2、5、10、20、50、100, 获得基质标准溶液。以所测毒素的峰面积为纵坐标, 所测毒素的质量为横坐标绘制定量标准曲线。将信噪比为3对应的质量作为方法的检出限(LOD), 信噪比为10对应的质量作为方法的定量限(LOQ)。
表3给出了8种毒素的线性范围、回归方程、相关系数、LOD、LOQ等。从表3结果可以看出, 各种毒素相关系数(²)均大于0.991, 表明各化合物在定量线性范围内线性关系良好, 能对目标化合物准确定量。整体而言方法的灵敏度能满足实际藻粉样品测定的灵敏度要求。
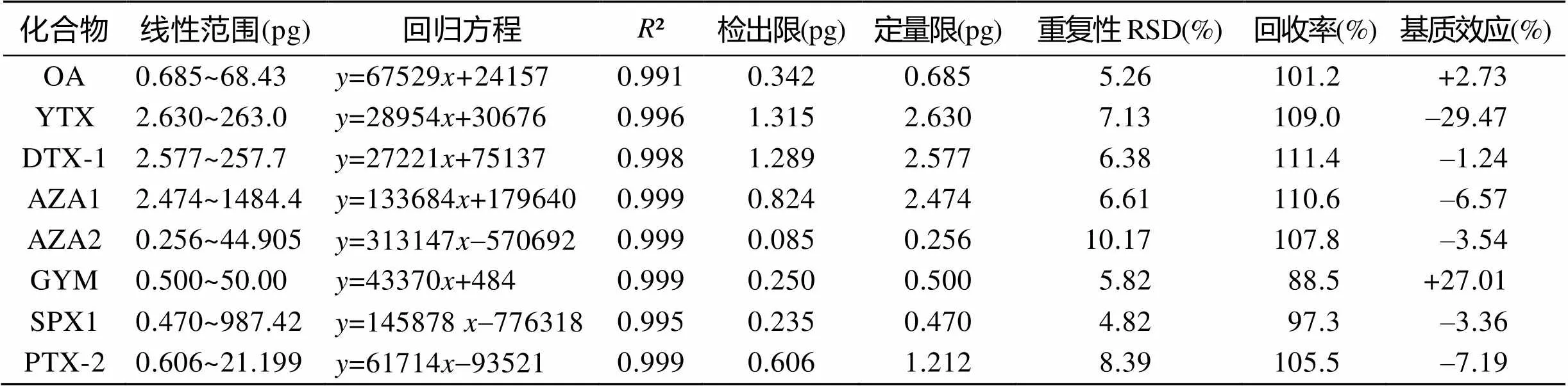
表3 线性范围、灵敏度、重复性、回收率和基质效应实验结果
2.3.5 回收率和重复性
方法回收率的测定采用标准加入法, 平行称取6份空白藻粉样品, 分别添加一定量的毒素标准品(OA: 1.0 μg, YTX: 4.0 μg, DTX-1: 4.0 μg, AZA1: 4.0 μg AZA2: 1.0 μg, GYM: 1.0 μg SPX1: 1.0 μg, PTX-2: 2.0 μg),然后按2.3节样品溶液的制备方法处理, 用2.4节色谱-质谱条件测定加标回收率和重复性, 测定结果见表3, 可以看出, 8种毒素的回收率在88.5%~111.4%之间, 重复性 RSD在4.82%~10.17%范围内, 表明该方法具有较好的回收率和重复性, 能满足实际干藻粉样品中各种脂溶性藻毒素的测定要求。
2.4 利玛原甲藻藻粉中毒素含量测定
采用已建立的分析方法, 对实验室内培养获得的利玛原甲藻干粉进行检测, 干藻粉中OA和DTX-1的HPLC-ESI-IT-MS分析提取离子流图见图3, 对应的二级质谱图见图4, 由图3和图4可以看出干藻粉提取液中OA和DTX-1的保留时间以及二级质谱图与标准对照品一致, 说明干藻粉中检测到的这两个化合物为OA和DTX-1。干藻粉中OA和DTX-1定量结果表明, 干藻粉中OA的含量为0.33 mg/g, DTX-1的含量为0.26 mg/g, 表明利玛原甲藻干粉中这两种脂溶性藻毒素含量较高。OA和DTX-1是典型的腹泻性藻毒素, 人类食用含有这两种毒素的食物后会引起腹泻、腹痛等肠胃疾病[8]。因此, 用于食品、保健品和医药产品开发的海洋微藻中即使含有少量有毒藻, 也会对人类健康造成威胁, 而针对干藻粉中多种脂溶性藻毒素进行检测, 对降低人类中毒风险具有重要意义。
A. OA标准品; B.藻粉提取液中OA; C. DTX-1标准品; D. 藻粉提取液中DTX-1
A. OA standard; B. OA in the crude extract of microalgae powder; C. DTX-1 standard; D. DTX-1 in the crude extract of microalgae powder
3 结论
建立了一种高效液相色谱-电喷雾离子阱质谱检测海洋微藻干藻粉中8种脂溶性毒素的方法, 该方法操作简单、回收率高、重复性好, 具有较强的适用性, 对于海洋微藻干藻粉中8种脂溶性毒素检测能提供可行的方法。
[1] 高亚辉, 荆红梅, 黄德强, 等. 海洋微藻胞外产物研究进展[J]. 海洋科学, 2002, 26(3): 35-38. Gao Yahui, Jin Hongmei, Hong Deqiang, et al. Advances in studies on extracellular products of marine microalgae[J]. Marine Sciences, 2002, 26 (3): 35-38
[2] 张建民, 刘新宁. 海洋微藻的利用现状和开发前景[J]. 齐鲁渔业, 2006, 23(4): 6-8. Zhang Jianmin, Liu Xinning. Utilization status and development prospects of marine microalgae[J]. Shandong Fisheries, 2006, 23(4): 6-8.
[3] 彭文岚, 王广建, 孙宗彬. 微藻在能源、环保及食品保健中的应用[J]. 化工科技市场, 2010, 33(2): 18-21.Peng Wenlan, Wang Guangjian, Sun Zongbin. Application of micro-alage in energy, environmental protection, and health food[J]. Chemical Technology Market, 2010, 33(2): 18-21.
[4] 马吉锋, 杨淼, 黎玉琼, 等. 盐藻粉及其在动物生产中的应用研究进展[J]. 畜牧与饲料科学, 2012, 33(9): 52-54. Ma Jifeng, Yang Miao, Li Yuqiong, et al. Research progress onpowder and its appliaction in animal production[j]. Animal husbandry and Feed Science, 2012, 33(9): 52-54.
[5] 江红霞, 郑怡. 微藻的药用、保健价值及研究开发现状[J]. 亚热带植物科学, 2003, 32(1): 68-72. Jiang Hongxia, Zheng Yi. A review of pharmaceutical and health care value of microalgae and their current status of research and development[J]. Subtropical Plant Science, 2003, 32(1): 68-72.
[6] Arjen Gerssen, Patrick PJ. Mulder, Jacob de Boer. Screening of lipophilic marine toxins in shellfish and algae: Development of a library using liquid chromatography coupled to orbitrap mass spectrometry[J]. Analytica Chimica Acta, 2011, 685(2): 176-185.
[7] 谭志军, 吴海燕, 郭萌萌, 等. 脂溶性贝类毒素安全评价与检测技术研究进展[J]. 中国水产科学, 2013, 20(2): 467-479.Tan Zhijun, Wu Haiyan, Guo Mengmeng, et al. Progress in risk assessment and detection method of lipophilic phycotoxins[J]. Journal of Fishery Sciences of China, 2013, 20(2): 467-469.
[8] 姚建华, 谭志军, 周德庆. 液相色谱-串联质谱检测贝类组织中5种脂溶性贝毒素[J]. 分析化学, 2010, 38(12): 1714-1720. Yao Jianhua, Tan Zhijun, Zhou Deqing. Determination of five lipophilic marine toxins in shellfish by liquid chromatography with tandem mass spectrometry[J]. Chinese Jounal of Analytical Chemistry, 2010, 38(12): 1714-1720.
[9] Toshiyuki Suzuki , Akira Miyazono, Katsuhisa Baba, et al. LC–MS/MS analysis of okadaic acid analogues and other lipophilic toxins in single-cell isolates of several Dinophysis species collected in Hokkaido, Japan[J]. Harmful Algae, 2009, 8(2): 233-238.
[10] 罗璇, 于仁成, 周明江.应用LC-MS联用方法分析青岛近海渐尖鳍藻(Dinophysis acuminata)细胞中的毒素成分[J]. 海洋环境科学, 2014, 33(5): 781-787. Luo Xuan, Yu Rencheng, Zhou Mingjiang. Analysis of toxins in cells ofcollected from coastal waters of Qingdao LC-MS method[J]. Marine Environmental Science, 2014, 33(5): 781-787.
[11] Li Xin, Li Zhaoyong, Chen Junhui, et al. Detection, occurrence and monthly variations of typical lipophilic marine toxins associated with diarrhetic shellfish poisoning in the coastal seawater of Qingdao City, China[J]. Chemosphere, 2014, 111: 560-567.
[12] Gerssen A, Mulder P PJ., McElhinney M A, et al. Liquid chromatography-tandem mass spectrometry method for the detection of marine lipophilic toxins under alkaline conditions[J]. Journal of Chromatography A, 2009, 1216(9): 1421-1430.
Determination of eight typical lipophilic algae toxins in marine microalgae powder using high-performance liquid chromatography-ion trap mass spectrometry
GAO Li-yuan1, WANG Yan-long1, CHEN Jun-hui1, WANG Shuai1, SHI Xiao-xing1, SHI Hong-hua1, ZHENG Li1, 2
(1. The First Institute of Oceanography, State Oceanic Administration, Qingdao 266061, China; 2. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China)
A method involving high-performance liquid chromatography coupled with electrospray ionization–ion trap mass spectrometry (HPLC–ESI–IT–MS) was developed to determine eight typical lipophilic algae toxins (okadaic acid (OA), dinophysistoxin-1 (DTX-1), pectenotoxin-2 (PTX-2), yessotoxin (YTX), azaspiracid1, 2 (AZA1, AZA2), spirolidel1 (SPX1), gymnodimine (GYM)) in marine microalgae powder. The powder was extracted using ultrasound-assisted extraction after the algae cell-breaking process was performed using ultrasonication. The crude extracts were then analyzed using HPLC–ESI–IT–MS in the multiple reaction monitoring mode. The results showed that the calibration curve for each lipophilic algae toxin was obtained with a good correlation coefficient (2>0.991) in its linear concentration. The detection limits of the eight target toxins ranged from 0.85 to 1.315 pg. The average recoveries of these toxins ranged from 88.5% to 111.4% with relative standard deviations in the range of 4.82%–10.17%. The proposed method was applied to determine typical lipophilic algae toxins inmarine microalgae powder, and good results were obtained. The results also indicated that this method is a useful tool for determining lipophilic algae toxins in marine microalgae powder.
High-performance liquid chromatography-ion trap mass spectrometry; Diarrhetic shellfish poisoning; Marine microalgae
(本文编辑: 康亦兼)
Dec. 25, 2015
[Shandong Provincial Natural Science Foundation, No.ZR2015PD003; National Natural Science Foundation of China-Shandong Joint Funded Project, No.U1406403; National Science & Technology Pillar Program of China, No.2013BAK12B00]
Q503 ; O657.7+2
A
1000-3096(2016)10-0113-07
10.11759/hykx20151225002
2015-12-25;
2016-05-16
山东省自然科学基金(ZR2015PD003); 国家基金委-山东省联合基金项目(U1406403); 国家科技支撑计划项目(2013BAK12B00)
高莉媛(1991), 女, 山东海阳人, 硕士研究生, 主要从事海洋环境化学相关研究, E-mail: gaoliyuan316@foxmail.com; 陈军辉, 通信作者, 博士, 副研究员; 电话: 0532-88966705, E-mail: jhchen@ fio.org.cn

