北大西洋大青鲨渔业生物学初步研究
高春霞, 戴小杰, 田思泉, 吴 峰
北大西洋大青鲨渔业生物学初步研究
高春霞1, 2, 3, 4, 戴小杰1, 2, 3, 4, 田思泉1, 2, 3, 4, 吴 峰1, 2, 4
(1. 上海海洋大学海洋科学学院, 上海 201306; 2. 中国远洋渔业数据中心, 上海201306; 3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306; 4. 国家远洋渔业工程技术研究中心, 上海 201306)
大青鲨()是金枪鱼延绳钓渔业中最主要的兼捕鱼种之一, 作为海洋生物链的顶端物种对海洋生态系统的稳定性和多样性起到了重要作用。作者根据中国金枪鱼渔业科学观察员在北大西洋海域(3°~55°N, 15°~40°W)采集的2 112尾大青鲨数据, 按不同性别对其渔业生物学特征进行初步研究。结果表明: 雌、雄大青鲨的优势叉长组分别为180~220 cm、190~230 cm, 雄性叉长均值显著大于雌性, 雌、雄性比符合1︰1; 大青鲨叉长-全长、尾凹长-全长的线性关系分别为F= 0.8008T+ 7.3361,P= 0.7576T–1.8479; 北大西洋热带海域(3°~13°N)兼捕的大青鲨群体组成以大个体为主(180~240 cm), 冰岛附近海域(48°~51°N)兼捕的大青鲨群体组成以小个体为主(100~210 cm); 大青鲨叉长和质量关系式为R=7×10–6F2.9994; 大青鲨肝脏为性腺的发育提供能量, 成熟个体的肝质量指数显著小于未成熟个体; 热带海域兼捕的大青鲨以性成熟个体为主(96.9%), 冰岛海域兼捕的大青鲨以未成熟个体居多(77.1%); 50%雌性性成熟个体对应的叉长为178.7 cm, 50%雄性性成熟个体对应叉长为173.6 cm; 雌性怀仔大青鲨的叉长与其怀仔数量线性关系为S=0.419×F–49.7(2=0.3905), 幼仔雌雄性比符合1︰1; 胃含物中以沙丁鱼和鱿鱼出现频率最高。作者的研究有助于更好地了解北大西洋大青鲨的生物学特征, 为区域性渔业管理组织评估大青鲨种群资源状态提供数据参考。
大青鲨(); 热带海域; 冰岛海域; 生物学特性
大青鲨()隶属于真鲨目(Carcharhiniformes)大青鲨属(), 是远洋性中上层软骨鱼类, 具有生长缓慢、生活周期长、性成熟晚、繁殖率高和繁殖周期长等生物学特征[1]。种群广泛分布于太平洋、大西洋和印度洋的热带、亚热带或温带海域, 近海海域也有分布, 见于南海、黄海、渤海和东海[2]; 大西洋海域呈南北分布, 标记数据和渔获记录证明南、北大西洋的大青鲨分属不同的独立种群, 而线粒体DNA非编码序列和分子微卫星分析显示北大西洋东、西部的大青鲨种群无差异[3-5]。作为延绳钓渔业的主要兼捕种之一, 联合国粮农组织(Food and Agriculture Organization of United Nations, FAO)2000~2012年大西洋的渔业统计数据[6]表明, 大青鲨在兼捕渔业中捕捞量最大, 2012年捕捞量达到117 441 t。Baum等[7]分析西北大西洋大青鲨的捕捞率认为该水域大青鲨资源已出现过度捕捞现象, 资源量自20世纪80年代中期开始出现显著的下降趋势, 世界自然保护联盟(IUCN, International Union for Conservation of Nature)于2009年将其确定为近危物种[8]。目前, 各区域性渔业管理组织纷纷出台相关政策开展鲨鱼类的保护, 各国也在积极制订鲨鱼国家行动计划对濒危的鲨鱼种质资源进行保护, 鲨鱼的基础生物学研究对资源的保护和政策的制定具有十分重要的参考意义。
大洋性鱼类的生物学数据收集存在较大的困难性, 目前国内主要对太平洋的大青鲨生长和繁殖特性进行了研究[9-10], 对大西洋的大青鲨种群研究较少; 国外方面, 主要侧重于大青鲨的年龄、生长以及种群洄游方面的研究[11-13], 反而缺乏特定水域种群基础生物学方面的信息。本研究通过科学观察员在北大西洋金枪鱼延绳钓船上收集到的数据和样本, 对该水域的大青鲨渔业生物学特征进行较为全面的研究, 为中国参与国际鲨鱼养护和管理及区域渔业组织进行大青鲨资源评估提供基础生物学数据参考。
1 材料和方法
1.1 采样时间和区域
采样时间为2010年10月~2011年3月和2011年10月~2012年3月, 4个航次的超低温金枪鱼延绳钓渔船在北大西洋海域作业(图1), 航次1区域: 4°~55°N, 15°~ 38°W, 航次2区域: 3°~15°N, 24°~ 36°W, 航次3区域: 3°~53°N, 15°~40°W, 航次4区域: 4°~55°N, 12° ~39°W, 调查区域主要集中在北大西洋的热带和冰岛海域附近(表1)。随船的科学观察员记录和整理兼捕大青鲨数据, 体质量用磅秤称量, 精确度为1 kg, 体长用卷尺测量, 精确度为1cm。由于海上作业环境的限制, 难以对体重和体长做进一步精确测量。
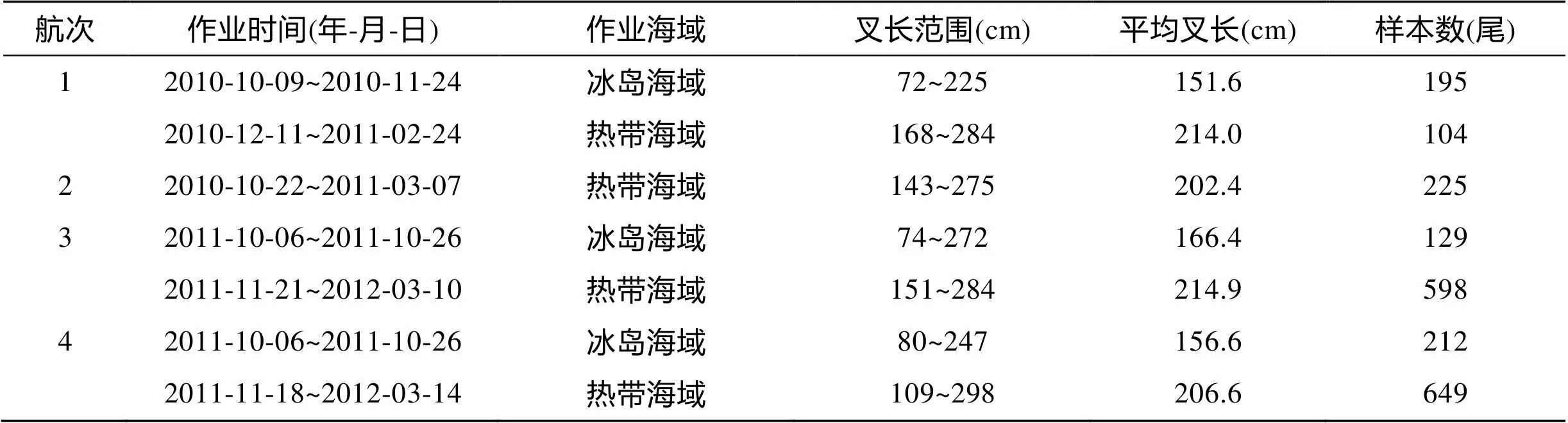
表1 热带大西洋和冰岛海域不同纬度的大青鲨群体组成
1.2 生物学观测和数据分析
观察大青鲨的性别、性成熟度和胃含物等, 并测量其全长(Total length,T): 自吻端到尾鳍末端的长度(cm)、叉长(Fork length,F): 自吻端到尾鳍中央分叉处的长度(cm)、尾凹长(Precaudal length,P): 自吻端到尾上凹洼处的长度(cm)、全质量(Round weight,R)、肝质量(Liver weight,L)、鳍脚长度(Clasper length,C)等数据。主要分析方法如下:
(1) 叉长分布以10 cm为组距, 绘制雌雄样本频率分布图, 确定优势叉长组; 并采用Kolmogorov- Smirnov检验方法检验雌雄样本长度分布有无显著差异性,检验雌雄样本的叉长均值有无显著性差异。
(2) 采用线性回归拟合全长与叉长的关系, 叉长与质量关系采用幂函数关系进行拟合:=aFb,为全质量(g),F为叉长(cm), a, b为参数, 并利用协方差分析(Analysis of covariance, ANCOVA)检验雌、雄样本叉长和质量的关系是否存在显著性差异。
(3) 性比[14]=雌性个体尾数/雄性个体尾数×100%, 并采用χ2检验判断性比是否符合1︰1。
(4) 肝质量指数=肝质量/全质量, 个体的肝质量对应的全重数据若未被记录, 可通过叉长与全质量的关系进行换算以计算全重值。
(5) 通过鳍脚钙化程度来判断雄性大青鲨是否达到性成熟, 当鳍脚呈完全钙化状态, 则雄性达到成熟, 反之为未成熟; 通过观察生殖系统(卵巢发育情况)来判别雌性大青鲨的性成熟程度, 雌性性成熟的特征为卵壳腺出现膨大或卵巢内可见黄色卵粒或子宫膨大(子宫内有胎儿), 子宫内壁有大量血丝(内壁非发白)等[15-16]。对各叉长组成熟个体的比率和叉长组组中值数据采用非线性Logistic模型[17]拟合, 建立成熟比例-叉长关系模型:, 式中,F为各叉长组组中值,为各叉长组的成熟个体比率,为曲线斜率,50为50%成熟个体的叉长。
(6) 摄食等级采用5级标准[18], 分别为0级(空胃)、1级(胃内有少量食物, 体积不超过胃腔的1/2)、2级(胃内食物较多, 体积超过胃腔的1/2)、3级(胃内食物充满, 但胃壁不膨胀)、4级(胃内食物饱满, 胃壁膨胀凸出)。
数据分析工具为Microsoft Excel 2007和SPSS17.0。
2 结果
2.1 叉长分布和性别比
航次1区域共收集大青鲨样品299尾 (雄性155尾, 雌性144尾), 航次2区域共收集大青鲨样品225尾(雄性127尾, 雌性98尾), 航次3区域共收集大青鲨样品727尾(雄性359尾, 雌性368尾), 航次4区域共收集大青鲨样品861尾(雄性420尾, 雌性441尾), 雌雄性比分别为0.93、0.77、1.0和1.05, 经χ2检验, 各航次区域采集的大青鲨雌雄样本均符合1︰1比例 (>0.05)。由于北大西洋大青鲨为同一种群, 将4个航次的调查数据合并 (雄性1061尾, 雌性1051尾), 雄性叉长范围为72~284 cm, 平均值为198.0 cm±38.7cm, 优势叉长组为 190~230 cm, 占总样本的52.5%; 雌性叉长范围为89~298 cm, 平均值为194.8 cm±31.1 cm, 优势叉长组为180~220 cm, 占总渔获物的63.7% (图2)。雌、雄性比为1.1, 符合1︰1比例(>0.05); 雌、雄的叉长分布具显著性差异(<0.01); 经检验, 雌、雄的叉长均值呈显著性差异, 雄性叉长均值显著大于雌性叉长均值 (<0.05)。
2.2 体长关系
根据193尾雄性和148尾雌性大青鲨叉长和全长数据以及104尾雄性和90尾雌性大青鲨尾凹长和全长数据, 拟合雌雄大青鲨全长和叉长、尾凹长的线性关系, 经ANCOVA检验, 雌雄样本全长-叉长, 全长-尾凹长关系未呈现显著性差异(=0.612,= 0.435> 0.05;=1.019,=0.314>0.05), 故将雌雄数据合并且拟合出关系式为:
F= 0.8008T+ 7.336 1 (= 0.9527,=341)
P= 0.7576T–1.847 9(= 0.9701,=194)
2.3 群体组成与纬度关系
北大西洋4个航次的调查范围按经纬度差异可分为热带海域和冰岛附近海域(图3), 冰岛附近海域的采样纬度范围为48°~51°N, 热带海域的采样纬度范围为3°~13°N。分析大青鲨叉长与纬度的关系, 各航次在冰岛区域的作业时间是10月~11月, 冰岛区域捕获的大青鲨样本共536尾, 叉长范围为72~272 cm, 平均值为157.3 cm±38.85 cm, 群体组成主要以小个体为主, 优势叉长组为100~210 cm, 占总数的86.8%;热带海域的作业时间为当年的11月至翌年的3月, 捕获大青鲨样本共1576尾, 叉长范围为109~298 cm, 平均值为209.7 cm±20.7 cm, 群体组成主要以大个体为主, 优势叉长组为180~240 cm, 占总数的86.7%。经检验, 热带海域和冰岛海域捕获的大青鲨叉长均值呈极显著性差异(<0.01)。
2.4 叉长-体质量的关系
大青鲨为大型鱼类, 其质量数据的采集存在较大困难性, 4个航次观察员共记录81尾雄性和94尾雌性大青鲨叉长、全质量数据,由此数据拟合出雌雄大青鲨叉长和全质量的幂函数关系, 雄性:R=6×10–6F3.0293(=81,2=0.9297); 雌性:R=1× 10–5F2.9274(=94,2=0.9029)。经ANCOVA检验, 雌雄样本体长-体质量关系没有显著性差异(ANCOVA,=0.419>0.05), 因此将雌雄数据合并且拟合出叉长和体质量的关系为:R=7×10–6F2.9994(=175,2= 0.9215), 由于参数值约等于3, 故大青鲨的生长呈匀速生长。
2.5 性成熟度与肝质量指数的关系
记录的845尾样本中, 雄性为483尾, 肝质量范围为0.16~12.0 kg, 平均值为2.58 kg; 雌性为362尾, 肝质量范围为0.25 ~10.86 kg, 平均值为3.21 kg。经检验, 雌性的平均肝质量大于雄性(<0.01)。
肝质量指数是鱼类肝脏质量占总质量的比例, 雄性肝质量指数范围为0.64~14.55, 平均值为5.07, 其中未成熟个体的肝质量指数范围为1.44~14.55, 平均值为7.65; 成熟个体肝质量指数范围为0.64~ 10.87, 平均值为4.34; 经单因素方差分析显示雄性大青鲨成熟个体和未成熟个体的肝质量指数呈显著性差异, 成熟个体的肝质量指数均值显著小于未成熟个体(<0.01)。雌性大青鲨肝质量指数范围为2.06~19.27, 平均肝质量指数为6.47, 其未成熟个体的肝质量指数范围为3.16~19.27, 平均值为8.42; 成熟个体的肝质量指数范围为2.06~13.64, 平均值为6.02; 经检验显示雌性成熟个体的肝质量指数均值明显小于未成熟个体(<0.01)(表2)。

表2 雌、雄大青鲨肝质量及肝质量指数
2.6 性成熟期与性成熟长度
通过观察雄性大青鲨的鳍脚钙化程度, 热带海域有记录的雄性未达到性成熟个体有19尾, 叉长范围为119~183 cm(=162.6 cm), 对应的鳍脚长度范围为11~18.5 cm(=15.8 cm); 性成熟个体有641尾, 叉长范围为162~284 cm(=214.6 cm), 对应的鳍脚长度范围为16 ~30.5 cm(=22.6 cm)。冰岛附近海域有记录的雄性未达到性成熟的个体有139尾, 叉长范围为72~185 cm(=132.2 cm), 鳍脚长度范围为4~17.8 cm(=9.76 cm); 性成熟个体有86尾, 叉长范围为130~272 cm(=206.2 cm), 鳍脚长度范围为13.2~27.8 cm(=21.0 cm)。
根据记录的全部雄性大青鲨繁殖生物学数据, 计算雄性大青鲨性成熟率的Logistic曲线方程为, 对应的50%雄性大青鲨性成熟叉长为173.6 cm(图4)。
通过观察雌性大青鲨的性腺发育状况, 热带海域记录的大青鲨性成熟期有Ⅱ、Ⅲ和Ⅳ期, 其中达到性成熟(Ⅲ期以上)的个体有379尾, 占总尾数的96.4%, 对应叉长范围为174~285 cm(=207.3 cm); 冰岛海域记录的大青鲨性成熟期有Ⅰ、Ⅱ和Ⅲ, 其中未成熟(Ⅰ和Ⅱ期)个体达到185尾, 占全部的94.9%, 对应叉长范围为89~203 cm(=148.8 cm)。根据记录的全部雌性大青鲨繁殖生物学数据, 雌性大青鲨性成熟率的Logistic曲线方程为,对应的50%雌性大青鲨性成熟叉长为178.7 cm(图5)。
2.7 怀仔数量及怀仔性比
观察员共观测139尾雌性大青鲨的怀仔情况, 怀仔大青鲨的叉长范围为174~285 cm, 怀仔数量为8~73尾, 平均怀仔数为37尾; 其中有8尾大青鲨的怀仔数不多于20尾, 123尾大青鲨怀22~53尾仔不等, 占总数的88.5%, 8尾大青鲨怀56~73尾仔不等(表3)。经Pearson相关分析, 雌性怀仔大青鲨的叉长(F)与其怀仔数量(litter size,S)呈相关性(=0.625,<0.05), 但两者的相关系数较低, 关系式如下:
S=0.419×F–49.7(=139,2=0.3905)
观察116尾雌性大青鲨的子宫内雌雄胚胎情况, 共观察到雌性幼仔数目为2 269尾, 雄性幼仔数为2 158尾, 雌雄性比为1.05︰1, 符合1︰1的比例(χ2检验,>0.05); 测量子宫内胚胎的叉长范围为5.7~ 34.5 cm,平均叉长为15.8 cm。
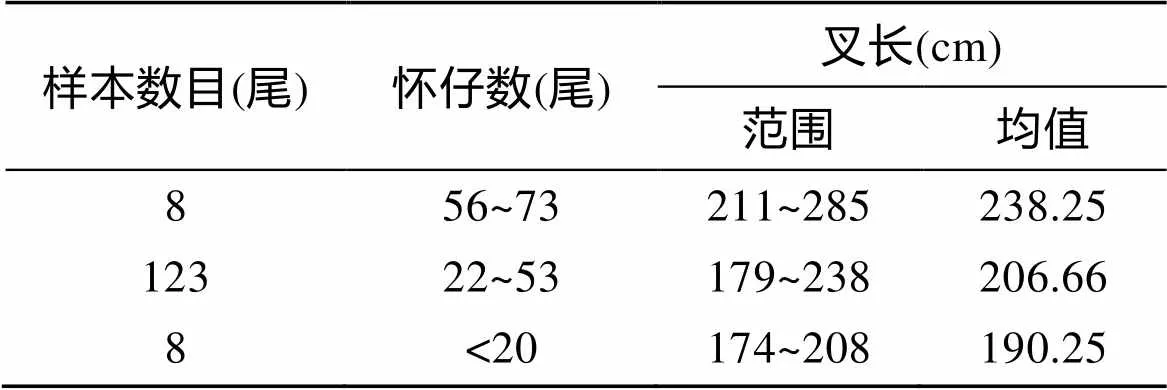
表3 大青鲨的怀仔数
2.8 摄食等级和摄食种类
观察样本的胃饱满度, 主要摄食等级为0~4级, 其中以0级为主, 其次为1级, 共占总数的95%; 2~4级所占比例较小(表4)。经Pearson相关分析显示, 大青鲨的叉长与摄食等级相关性不显著(>0.05), 性腺成熟度与摄食等级也不存在显著相关性(>0.05)。通过对样本的胃含物观察, 发现大青鲨的胃含物中主要以沙丁鱼()和鱿鱼()为主, 另有一些杂鱼如飞鱼()、帆蜥鱼()和异鳞蛇鲭()。
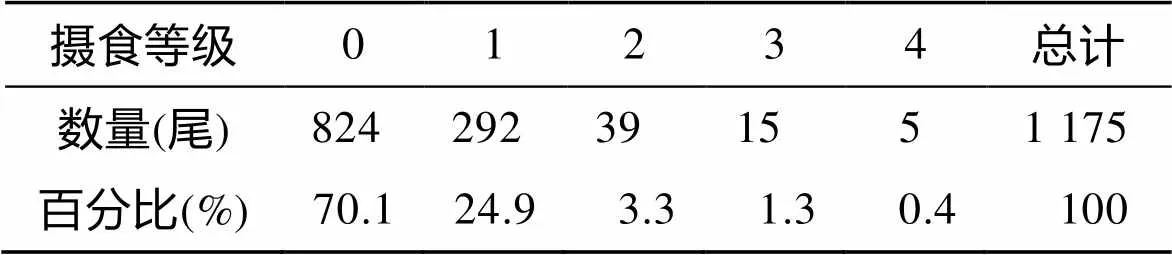
表4 大青鲨摄食等级组成比例
3 讨论
3.1 大青鲨种群长度分布及空间分布特征
本研究中调查采集到的大青鲨样本长度分布范围较广, 雌雄样本的叉长分布呈显著性差异, 雄性大青鲨的叉长均值明显大于雌性, 这与Henderson等[19]调查的结果相反, 究其原因, 可能是Henderson等研究的大青鲨样本量偏少的缘故, 现实性低不具有参考性; Megalofonou等[12]研究地中海大青鲨时, 取样样本分布广泛, 研究显示雌雄大青鲨的长度分布也呈显著性差异; Zhu等[20]发现东太平洋的雌雄大青鲨分布同样呈显著性差异, 且雌性叉长均值同样显著小于雄性, 因此可确定本研究中的北大西洋雌、雄大青鲨样本长度分布存在差异性。
4个延绳钓航次在北大西洋的兼捕区域包括温度较低的冰岛中纬度区域和温度较高的热带低纬度区域, 通过长度分布及繁殖生物学研究发现热带海域捕获的大青鲨以大个体、性成熟个体为主, 冰岛区域捕获的大青鲨多为小个体, 且多为未成熟个体, 这显示冰岛海域极有可能属于大青鲨的产卵场区域, 这种群体组成分布特征也间接反映出北大西洋大青鲨具洄游性, Hazin等[13]发现大青鲨的洄游模式为有规律的顺时针跨大西洋方式, 随着北半球的环流系统, 顺着墨西哥湾到欧洲, 在欧洲和非洲沿岸顺着不同的环流, 再沿着大西洋北赤道逆流回到北美。由于延绳钓渔业为商业性捕捞活动, 兼捕数据难以解释大青鲨的洄游模式, 因此关于大青鲨的洄游模式尚需进一步研究。
3.2 大青鲨种群性比
研究发现北大西洋雌雄大青鲨成体的性比符合1︰1, 此结果与Pratt[21]在该海域的报道一致, 也与Stevens[22]和Henderson等[19]关于北大西洋东部大青鲨雌雄性比研究结果保持一致, 但在某些海域也报道过性比不符合1︰1的情况, 如在地中海兼捕的大青鲨主要以雄性为主[12], 而爱尔兰沿岸海域捕获的大青鲨以雌性为主[23]。不同海域雌雄性比的差异性, 可能与栖息地的环境以及大青鲨的繁殖行为有关[24]。
Pratt[21]对北大西洋大青鲨的子宫进行观察, 发现雌雄胚胎性比符合1︰1比例; Castro等[25]认为几内亚湾大青鲨雌雄幼仔性比符合1︰1比例; 本研究通过观察员观察北大西洋大青鲨的左右子宫的幼仔数, 性比结果与上述研究者一致, 而太平洋海域[26-27]和印度洋海域[28]的大青鲨怀仔性比也呈1︰1的比例。
3.3 大青鲨不同长度间关系
在大青鲨的研究文献中, 不同的作者使用不同的长度参数, Stevens[22]、Henderson等[19]和Lessa等[5]使用全长作为长度参数, Pratt[21]、Skomal等[11]和Zhu等[20]使用叉长, Nakano[26]和Suda[27]使用吻-尾柄长。兼捕大青鲨时, 因网具的影响而易导致鱼体尾部的残缺, 因此使用叉长作为鱼体的长度参数较佳。针对不同的长度参数间的转换, Kohler[29]拟合了大青鲨的叉长和全长关系, 美国国家海洋渔业局(National Marine Fisheries Service, NMFS)拟合了大青鲨叉长与尾凹长的关系[11], Lessa等[5]对南大西洋采样大青鲨的叉长和全长进行了拟合, 本研究主要对北大西洋的大青鲨各长度参数间的关系进行了拟合, 由于采样样本量较大, 数据信息齐全, 因此可信性和精确性较高(表5)。
3.4 肝质量指数与性腺发育的关系
肝脏是软骨鱼类重要的能量储存、供应器官, 本研究中雌性大青鲨成熟个体的肝质量指数小于未成熟个体的肝质量指数, 究其原因是由于肝脏供应了个体发育、生长所需的能量, 随着性腺的发育成熟, 肝脏的质量也逐渐减小, 这种现象在拟锥齿鲨中同样发现过[15]。

表5 各海域不同长度参数间的转换关系
3.5 大青鲨长度与怀仔数的关系
雌性怀仔大青鲨的叉长(F)和怀仔数(S)呈一定的线性关系, Castro等[25]认为几内亚湾大青鲨的胎儿数随叉长的增加而增加, 呈正比关系; Mejuto等[30]发现大西洋海域大青鲨幼仔数和叉长呈显著相关性,且两者拟合的相关系数可以解释部分幼仔数量的波动; Zhu等[20]认为东太平洋大青鲨产仔数与叉长存显著相关性, 但两者的相关系数较低, 本研究拟合了北大西洋大青鲨叉长和幼仔数的关系, 相关系数同样较低(表6)。

表6 不同海域怀仔大青鲨叉长和幼仔数的关系
由于渔业生产的局限性, 本次调查区域未能完全覆盖北大西洋海域, 但大青鲨的大、小个体均有记录,获取的样本长度数据均匀, 数据分析的可信度高, 作者的研究可为后续大青鲨的生长、繁殖、死亡和资源评估等更深入研究提供有效的基础信息参考。
[1] Castro J I, Woodley C M, Brudek R L. A preliminary evaluation of the status of shark species[R]. Rome: Food and Agriculture Organization of the United Nations, 1999: 72.
[2] 戴小杰.东太平洋主要几种中上层鲨鱼生物学和生态学研究[D]. 上海: 华东师范大学, 2004. Dai Xiaojie. Research on the biology and ecology of several pelagic sharks in the Eastern Pacific Ocean[D]. Shanghai: East China Normal University, 2004.
[3] Kohler N E, Turner P A, Hoey J J, et al. Tag and recapture data for three pelagic shark species, blue shark (), shortfin mako () and porbeagle () in the North Atlantic Ocean[C]//Collective volume of scientific papers. Madrid: International Commission for the Conservation of Atlantic Tunas, 2002: 1231-1260.
[4] Shivji M, Clarke S, Pank M, et al. Genetic identification of pelagic shark body parts for conservation and trade monitoring[J]. Conservation Biology, 2002, 16(4): 1036-1047.
高校制度文化主要包含四个层面——规章制度层、运行机制层、价值理念层和执行文化层。由高校师生及行政管理人员共同参与的、科学设计的各类大学规章制度、组织纪律、行为准则、实施条例及其内涵组成大学制度文化第一个层面——规章制度层,该层面具有明显的权威性、强制性和导向性,内容明确而具体。
[5] Lessa R, Santana F M, Hazin F H. Age and growth of the blue shark(Linnaeus, 1758) off northeastern Brazil[J]. Fisheries Research, 2004, 66(1): 19-30.
[6] Food and agriculture organization of the United Nations: Blue shark [DB/OL]. [2000-2012]. Http: //www. fao.org/economic/est/statistical-data/en/.
[7] Baum J K, Myers R A, Kehler D G, et al. Collapse and conservation of shark populations in the Northwest Atlantic[J]. Science, 2003, 299: 389-392.
[8] The IUCN Red List of Threatened Species:[EB/OL]. [2015-02]. Http: //www.iucnredlist. org/details/39381/0
[9] 刘一淳, 朱国平, 戴小杰. 东太平洋大青鲨年龄和生长的研究[J]. 海洋渔业, 2006, 28(2): 124-128. Liu Yichun, Zhu Guoping, Dai Xiaojie. Age and growth ofin the East Pacific Ocean[J]. Marine Fisheries, 2006, 28(2): 124-128.
[10] 戴小杰, 许柳雄. 东太平洋热带海域大青鲨繁殖生物学特征[J]. 水产学报, 2005, 29(4): 565-569. Dai Xiaojie, Xu Liuxiong. Reproductive biology characteristics ofin the tropical Eastern Pacific Ocean[J]. Journal of Fisheries of China, 2005, 29(4): 565-569.
[11] Skomal G B, Natanson L J.Age and growth of the blue shark () in the North Atlantic Ocean[J]. Fishery Bulletin, 2003, 101(3): 627-639.
[12] Megalofonou P, Damalas D, Metrio D G. Biological characteristics of blue shark,, in the Mediterranean Sea[J]. Journal of the Marine Biological Association of the United Kingdom, 2009, 89(6): 1233-1242.
[13] Hazin F H V. Fisheries-oceanographically study on tunas, billfishes and sharks in the south western Equatorial Atlantic Ocean[D]. Tokyo: Tokyo University of Fisheries, Graduate School of Fisheries, 1993: 286.
[14] 林龙山, 郑元甲, 程家骅, 等. 东海区底拖网渔业主要经济鱼类渔业生物学的初步研究[J]. 海洋科学, 2006, 30(2): 21-25. Lin Longshan, Zheng Yuanjia, Cheng Jiahua, et al. A preliminary study on fishery biology of main commercial fishes surveyed from the bottom trawl fisheries in the East China Sea[J]. Marine Sciences, 2006, 30(2): 21-25.
[15] 吴峰, 戴小杰, 姜润林. 热带中东大西洋海域大青鲨繁殖生物学研究[J]. 海洋湖沼通报, 2012, 3: 29-36. Wu Feng, Dai Xiaojie, Jiang Runlin. Reproductive biology of blue shark in the tropical eastern central Atlantic Ocean[J]. Transaction of Oceanology and Limnology, 2012, 3: 29-36.
[16] 高春霞, 田思泉, 戴小杰, 等. 热带中东大西洋拟锥齿鲨生物学的初步研究[J]. 上海海洋大学学报, 2013, 22(2): 289-294. Gao Chunxia, Tian Siquan, Dai Xiaojie, et al. Preliminary analysis of the biology of the crocodile shark,in the tropical Eastern-central Atlantic Ocean[J]. Journal of Shanghai Ocean University, 2013, 22(2): 289-294.
[17] Oliveira P, Hazin F H V, Carvalho F, et al. Reproductive biology of the crocodile shark,[J]. Journal of Fish Biology, 2010, 76(7): 1655-1670.
[18] Mejuto J, Garca B. An overview o f the sex-ratio at size of the swordfish (L.)around the world: Similarity between different strata[J]. ICCAT Collective Volume of Scientific Papers, 1995, 6 (3): 197-205.
[19] Henderson A C, Flanery K, Dunne J. Observations on the biology and ecology of the blue shark in the North-east Atlantic[J]. Journal of Fish Biology, 2001, 58(5): 1347-1358.
[20] Zhu J F, Dai X J, Xu L X, et al. Reproductive biology of female blue sharkin the southeastern Pacific Ocean[J]. Environmental Biology of Fishes, 2011, 91: 95-102.
[21] Pratt H L. Reproduction in the blue shark,[J]. Fishery Bulletin, 1979, 77: 445-470.
[22] Stevens J D. Vertebral rings as a means of age determination in the blue shark (L.)[J]. Journal of the Marine Biological Association of the United Kingdom, 1975, 55 (3): 657-665.
[23] Whelan K. The sea angler in Ireland [M]. Dublin: Country House, 1991.
[24] 王红勇, 吴洪流, 王子武, 等. 远海梭子蟹渔业生物学的初步调查[J]. 海洋科学, 2001, 25(1): 36-39. Wang Hongyong, Wu Hongliu, Wang Ziwu, et al. Fisheries biology oflinneis initialing investigatgtion[J]. Marine Sciences, 2001, 25(1): 36-39.
[25] Castro J A, Mejuto J. Reproductive parameters of blue shark,, and other sharks in the Gulf of Guinea[J]. Marine and Freshwater Research, 1995, 46: 967-973.
[26] Nakano H. Age, reproduction and migration of the blue shark in the North Pacific Ocean[J]. Bulletin of the National Research Institute of Far Seas Fisheries, 1994, 31: 141-190.
[27] Suda A. Ecological study on the blue shark,[J]. South Seas Area Fisheries Research Laboratory, 1953, 26: 1-11.
[28] Gubanov Y P, Grigor'yev V N. Observations on the distribution and biology of the blue shark(Carcharhinidae) of the Indian Ocean[J]. Journal of Icthyology, 1975, 15: 37-43.
[29] Kohler N E, Casey J G, Turner P A. Length-weight relationships for 13 species of sharks from the western North Atlantic[J]. Fishery Bulletin, 1987, 93: 412-418.
[30] Mejuto J, García-cortés B, Ramos-cartelle A. Tagging- recapture activities of large pelagic sharks carried out by Spain or in collaboration with the tagging programs of other countries[C]//Madrid: International Commission for the Conservation of Atlantic Tunas, 2005, 53(3): 974-1000.
Preliminary analysis of fisheries biology of the blue shark,, in the North Atlantic Ocean
GAO Chun-xia1, 2, 3, 4, DAI Xiao-jie1, 2, 3, 4, TIAN Si-quan1, 2, 3, 4, WU Feng1, 2, 4
(1.College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China; 2. National Data Centre for Distant-water Fisheries of China, Shanghai 201306, China; 3. The key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Shanghai 201306, China; 4. National Distant-water Fisheries Engineering Research Center, Shanghai 201306, China)
The blue shark,, is usually one of the key by-catch species in tuna longline fishery. As a top species of the oceanic food chain, it plays a vital role in maintaining the stability and diversity of the marine ecosystem. However, the biological information of this shark is limited for the availability of its samples. In this study, we described and analyzed the fisheries biology of the blue shark based on a total of 2 112 samples collected by China’s national tuna fisheries observers in the North Atlantic Ocean (3°~55°N, 15°~40°W). The results indicated that the dominant fork lengths of males and females were 180–220 cm and 190–230 cm, respectively, and the mean fork length of the male was significantly larger than that of the female. The female–male ratio of the captured sharks was almost 1︰1. The relationships between fork length and total length and pre-caudal length and total length could be described asF= 0.8008T+ 7.3361 andP= 0.7576T−1.8479, respectively. The larger individuals (180–240 cm) were primarily distributed in the tropical waters (3°~13°N), while the smaller individuals (100–210 cm) were primarily captured around the Iceland waters. The relationship between fork length and round weight was described asR=7×10–6F2.9994. The hepatosomatic index (HSI) of mature individuals was obviously smaller than that of immature individuals because of the energy expenditure for gonad development. Among the by-catch blue shark, mature individuals were dominant comprising 96.9% in the tropical waters, while immature individuals were dominant in the Iceland waters, comprising 77.1%. Fork length at 50% maturity was 178.7 cm for females and 173.6 cm for males. The relationship ofS−FwasS= 0.419×F−49.7 (2= 0.3905), and the female–male ratio of juveniles was also almost 1︰1. Sardines and squids were predominantly found in the stomach of the blue shark. This study contributed to a better understanding of fisheries biology of the blue shark and could be useful for evaluating the shark’s resources.
; tropical waters; iceland waters; biological parameters
(本文编辑: 谭雪静)
Sept. 28, 2015
[Training Program and Scientific Research of New College Teacher in Shanghai, No. 2014S10; Scientific Observer Program of Chinese Distant-water Fishery, No. 08-25]
S931.9
A
1000-3096(2016)10-0055-08
10.11759//hykx20150928003
2015-09-28;
2016-01-04
上海教委高校新进教师培训及科研启动费项目(2014S10); 农业部远洋渔业观察员项目(08-25)
高春霞(1988-), 女, 安徽人, 初级工程师, 主要从事渔业资源评估研究, 电话: 021-61900482, E-mail: cxgao@shou.edu.cn; 田思泉, 通信作者, 电话: 021-61900221, E-mail: sqtian@shou.edu.cn

