干旱胁迫对甘蔗4个生理指标遗传变异的影响
赵培方,赵俊,刘家勇,昝逢刚,夏红明,P.A. Jackson, J. Basnayake, N.G. Inman-Bamber,杨昆,赵丽萍,覃伟,陈学宽,赵兴东,范源洪
干旱胁迫对甘蔗4个生理指标遗传变异的影响
赵培方1,赵俊1,刘家勇1,昝逢刚1,夏红明1,P.A. Jackson2, J. Basnayake3, N.G. Inman-Bamber4,杨昆1,赵丽萍1,覃伟1,陈学宽1,赵兴东5,范源洪1
(1云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,中国云南开远 661699;2CSIRO Plant Industry,ATSIP,Private Mail Bag PO,Aitkenvale,QLD,4814,Australia;3Sugar Research Australia,PO Box 117,Ayr,QLD,4807,Australia;4Crop Science Consulting,Townsville,Australia;5云南省玉溪市元江县经济作物工作站,中国云南元江653300)
【目的】研究干旱胁迫对气孔导度(s)、PSⅡ原初光能转化效率(Fv/Fm)、叶片伸长速率(leaf elongation,LE)和叶片相对含水量(relative water content,RWC)4个甘蔗生理指标遗传变异的影响,为其在甘蔗育种程序早期阶段的应用提供参考。【方法】采用裂区设计,以自然干旱和人工灌溉为主区,不同甘蔗基因型为副区,在云南省红河州开远市和玉溪市元江县2个试验点先后对22个和18个甘蔗基因型同时开展田间试验,主要在2个生长季甘蔗拔节前期先后13次、18次、15次和10次分别对4个生理指标s、Fv/Fm、LE、RWC进行测量。采用软件GenStat计算各指标各次测量的遗传方差分量(sg2)和环境方差分量(se2),并计算广义遗传力(b2),采用SAS9.1对每次测量干旱和灌溉处理下获得遗传方法分量和广义遗传力进行成对测验。【结果】四项生理指标受干旱影响极显著,13次s、18次Fv/Fm、15次LE和10次RWC处理间差异均为极显著。在干旱和灌溉处理下,13次s基因型间分别10次和11次差异显著,广义遗传力范围分别为0.19—0.68和0.19—0.82,13次平均分别为0.49和0.53,灌溉条件下的遗传方差显著高于干旱胁迫下的遗传方差;18次Fv/Fm基因型间分别17次和16次差异显著,广义遗传力范围分别为0.26—0.83和0.16—0.85,平均值分别为0.64和0.58,干旱条件下的遗传方差极显著高于灌溉条件下的遗传方差;15次LE基因型间分别14次和10次差异显著,广义遗传力范围分别为0.09—0.89和0.09—0.81,平均值分别为0.58和0.50,干旱处理下平均遗传方差和遗传力较高;10次RWC基因型间分别8次和6次差异显著,广义遗传力范围分别为0.10—0.76和0.16—0.77,平均值分别为0.57和0.47,干旱条件下平均遗传方差和广义遗传力较高。总之,除s,其他3个指标在干旱条件下获得广义遗传力均高于灌溉条件下的广义遗传力。【结论】干旱胁迫影响s、Fv/Fm、LE和RWC的遗传变异和广义遗传力,在灌溉条件下测量s和在干旱条件下测量其他3个指标更易获得较高的遗传变异和广义遗传力,但所有4个生理指标均能在灌溉条件下获得较高的广义遗传力。
甘蔗;干旱胁迫;生理指标;遗传变异
0 引言
【研究意义】甘蔗是中国种植面积最大的糖料作物,约92%的食糖为蔗糖。中国甘蔗主要种植于旱坡地,广西蔗区90%的甘蔗种植于雨养型旱坡地[1],云南甘蔗旱地面积高达80%以上[2]。提高抗旱甘蔗品种选育效率,有利于干旱蔗区蔗糖产业的可持续发展。研究干旱胁迫和灌溉条件下甘蔗生理指标的遗传变异,为其在甘蔗抗旱育种中的应用提供参考。【前人研究进展】甘蔗受旱后,可表现出一系列的避旱性特征如叶片蜷曲、脱落、叶面积降低和早期气孔关闭等[3],且表现出生理上的差异。受旱后气孔导度(stomatal conductance,s)[1,4-5]、PSⅡ原初光能转化效率(Fv/Fm)[4,6]和叶片相对含水量(relative water content,RWC)显著降低[4,7-8]。与灌溉处理相比较,干旱胁迫显著降低甘蔗产量,Basnayake等[9]研究了89个甘蔗品系灌溉和干旱胁迫下的甘蔗产量与总干物质含量,两者因旱减产幅度分别为17%—52%和20%— 56%。Silva等[10]的研究表明78个甘蔗基因型总体产量因中度干旱显著减产,且不同基因型差异显著。采用干旱胁迫与灌溉的方式可对甘蔗不同基因型的抗旱性进行评价[1,11-13],亦有研究者采用类似的方法对甘蔗家系的抗旱性进行评价[14]。但在甘蔗育种程序的早期阶段,受品系数量多且单个品系芽量少的限制,难于通过灌溉和干旱胁迫对大量品系进行抗旱性评价。虽然Basnayake等[9]的研究认为在灌溉条件下高产的品系能在适度干旱条件下维持相应较高的产量水平。是否可能仅通过干旱处理或灌溉处理对大量品系进行抗旱性筛选仍需进一步研究。作物产量受基因与环境互作的影响大,植物育种程序需考虑采用与抗旱密切相关的生理指标[15]。Silva等[10]研究发现干旱胁迫下Fv/Fm和RWC与蔗茎产量存在极显著的正相关。Basnayake等[16]对131个品系不同水分处理下的51次测量结果表明s具有较高的遗传力且可获得与甘蔗产量较高的遗传相关性。有研究表明活体测量s[5]、Fv/Fm[6-7,17]可为选育抗旱品种提供参考;干旱胁迫后叶片伸长速率(leaf elongation,LE)基因型间差异显著[8],可作为描述甘蔗受旱胁迫程度指标[18]。【本研究切入点】在甘蔗品种选育过程中,早期品系筛选阶段因无重复难以有效避免品系间竞争,依据产量选择效率较低[19-21]。在甘蔗生长前期使用生理指标进行筛选,有望提高甘蔗抗旱育种效率。关于甘蔗生理指标大田干旱和灌溉条件下的遗传变异报道较少,仅Basnayake等[16]研究了不同水分处理大田条件下s的遗传变异,而关于Fv/Fm、LE和RWC遗传变异的研究还未见报道。【拟解决的关键问题】本研究在2个不同生态点分2次先后对22个和18个甘蔗基因型在自然干旱和完全灌溉条件下对s、Fv/Fm、LE和RWC进行多次测定,旨在明确干旱胁迫对该四项生理指标遗传变异的影响,为这些生理指标在甘蔗抗旱育种中的应用提供参考。
1 材料与方法
1.1 参试材料
本研究含二轮田间试验,共包含30个甘蔗基因型,其中,第一轮试验含22个基因型,第二轮试验含18个基因型,10个基因型在两轮试验中共用(表1)。30个基因型含商业品种19个,其中,澳大利亚品种3个,古巴和菲律宾品种各1个,云南6个,广东2个,台湾4个,福建和广西各1个;含云蔗型品系11份。

表1 参试基因型类型和来源
1.2 试验设计
田间试验在云南省红河州开远市(E103.27°,N23.72°)和玉溪市元江县(E101.87°,N23.67°)2个试验点同时开展。开远试验点为红壤,第一轮试验于2012年2月下旬种植,新植试验生育期305 d,第一年宿根生育期392 d,第二年宿根生育期376 d;第二轮试验于2013年11月种植,新植生育期442 d。元江试验点为砂壤土,第一轮试验于2012年2月下旬种植,新植生育期302 d,第一年宿根生育期321 d;第二轮试验于2013年11月种植,新植生育期443 d。试验采用裂区设计,以自然干旱和灌溉处理为主区,自然干旱处理仅种植时灌水以保障正常萌苗,灌溉处理在田间持水量低于80%时进行灌溉,以不同甘蔗基因型为副区,3次重复,随机区组排列。各小区4行,行长10 m,行距1 m,小区面积40 m2,15万芽/公顷。为降低甘蔗宿根矮化病对试验造成的误差,种苗采用50℃温水处理2 h,并在试验种植前2个月将土地犁耙后闲置。试验地周围设置保护行1—2行,主区之间设置2 m宽隔离带以避免灌溉处理对自然干旱处理的影响。
1.3 试验数据收集
采用田间气象站记录试验期间降雨量数据、日最高气温和最低气温。采用便携式土壤水分廓线仪(Diviner,澳大利亚)检测土壤含水量用于指导灌溉处理。因2012年新植试验种植后苗期阶段进入雨季,因此未对2012年试验进行生理指标测量,主要对第一轮试验的第一年宿根试验和第二轮试验的新植试验进行s、Fv/Fm、LE和RWC 4个生理指标测定。选择无降雨7 d以上,无云或少云的上午9:00至11:00进行测定或取样。
采用动态气孔计(AP4,英国)测量s,根据田间环境设定动态气孔计相对空气湿度,每次改变测量环境时(2个试验点间)对仪器进行校正,各小区随机选择有代表性的3棵植株第一完全叶中部位置进行测量,共计测量13次。采用植物效率分析仪(Handy Pea,英国)测定Fv/Fm,在测量前对叶片进行30 min以上暗适应,各小区随机选择有代表性的3株植株测量第一完全叶中部位置,共计测量18次。LE为最新叶在一定时间内的伸长长度,以+1叶为参照,测量剥开时和一定时间后最新叶的生长长度,折算为最新叶一小时内的生长长度,各小区随机测量3株,共计测量15次。RWC采用公式:RWC =(叶片鲜重-干重)/(吸胀后饱和重-干重)×100%计算获得,叶片鲜重取自+1叶中部,各小区随机取3株,苗期共计测量10次。
1.4 试验数据分析
采用Microsoft Excel 2010进行试验数据整理,采用软件GenStat(v7.1.0.198)进行方差分析,计算遗传方差分量(sg2)及环境方差分量(se2),采用以下公式计算广义遗传力(b2):
b2=sg2/ [sg2+se2/(n×r)]
式中,n为重复数,即3,r为各重复测量株数,即为3。
采用SAS 9.1对4个生理指标在干旱和灌溉条件下的遗传方差分量和广义遗传力进行成对测验。
2 结果
2.1 苗期的降雨量及气温
根据田间气象站数据,开远点和元江点2013年(第一轮试验第一次宿根)降雨量分别为589.80和416.40 mm,2014年(第二轮试验新植)分别为664.20和740.20 mm,均低于800.00 mm。如图1所示,在3至6月各生理指标测定时期内,仅在元江点第二轮试验新植6月份出现少量40℃以上高温,仅在开远点第一轮试验第一次宿根试验中偶尔出现10℃以下低温。开远点二次试验3至6月期降雨量分别为278.80和264.00 mm,元江点分别为208.60和262.80 mm,试验苗期干旱处理处于干旱胁迫条件,而灌溉处理依据土壤含水量情况进行灌溉消除干旱胁迫。

A:2013年开远;B:2014年开远;C:2013年元江;D:2014年元江A: Kaiyuan 2013; B: Kaiyuan 2014; C: Yuanjiang 2013; D: Yuanjiang 2014
2.2 干旱胁迫对4个生理指标的影响
13次s、18次Fv/Fm、15次LE和10次RWC处理间差异均为极显著(表2—表5)。各生理指标测量间表现出较大的差异,干旱和灌溉处理下,13次s各次均值范围分别为53.30—309.40 mmol·m-2·s-1和156.20—615.00 mmol·m-2·s-1(表2),总均值分别为130.12和328.90 mmol·m-2·s-1;15次Fv/Fm测量各次均值范围分别为0.59—0.78和0.72—0.79(表3),总均值分别为0.70和0.76;15次LE各次均值范围分别为0.67—8.48 cm·h-1和3.16—13.70 cm·h-1(表4),总体均值分别为3.02和5.80 cm·h-1;10次RWC各次均值范围分别为83.53%—95.20%和95.37%—97.49%(表5),总体均值分别为90.90%和96.29%。
2.3 干旱胁迫对4个生理指标遗传变异的影响
在干旱和灌溉处理下,s的13次测量基因型间分别10次和11次差异显著,遗传方差范围分别为92—2 136和 412—2 4838(表2),在灌溉条件下获得遗传方差显著高于干旱条件获得遗传方差(表6);广义遗传力范围分别为0.19—0.68和0.19—0.82(表2),13次平均值分别为0.49和0.53,灌溉条件下的广义遗传力较高,但与干旱处理相比较无显著差异(表7)。
干旱和灌溉处理下,Fv/Fm的18次测量基因型间分别17次和16次差异显著,遗传方差范围分别为0.20×10-4—1.97×10-3和0.20×10-4—1.00×10-3(表3),在干旱条件下获得的遗传方差极显著地高于灌溉条件下获得遗传方差(表6);广义遗传力范围分别为0.26—0.83和0.16—0.85(表3),18次平均值分别为0.64和0.58,总体而言,干旱条件下获得更高的广义遗传力,但与灌溉条件下相比较无显著差异(表7)。
在干旱和灌溉处理下,LE的15次测量基因型间分别14次和10次差异显著,遗传方差范围分别为0.91×10-2—4.79和0.02—1.80(表4),尽管干旱处理下遗传方差更大,但两处理间无显著差异(表6);广义遗传力范围分别为0.09—0.89和0.09—0.81(表4),15次平均值分别为0.58和0.50,干旱条件下较高,但无显著差异(表7)。
在干旱和灌溉处理下,RWC的10次测量基因型间分别8次和6次差异显著,遗传方差范围分别为0.13—7.62和0.12—2.41(表5),干旱处理下遗传方差更大,但处理间无显著差异(表6);广义遗传力范围分别为0.10—0.76和0.16—0.77(表5),10次平均值分别为0.57和0.47,干旱处理下更高,但和灌溉处理相比较无显著差异(表7)。
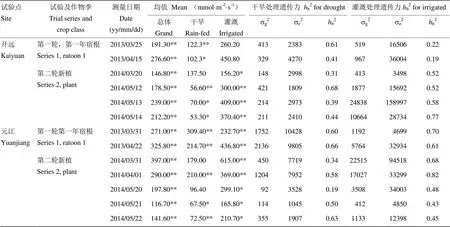
表2 气孔导度(Gs)的方差分析,遗传方差分量(sg2),环境方差分量(se2)和广义遗传力 (hb2)
*和**在“总体”列中分别表示处理间在0.05和0.01水平差异显著,在“干旱”和“灌溉”列中分别表示基因型间在0.05和0.01水平差异显著。下同
* and ** represents the difference is significant at level of 0.05 and 0.01, respectively, for treatments in column grand, for genotypes in column drought or irrigated. The same as below
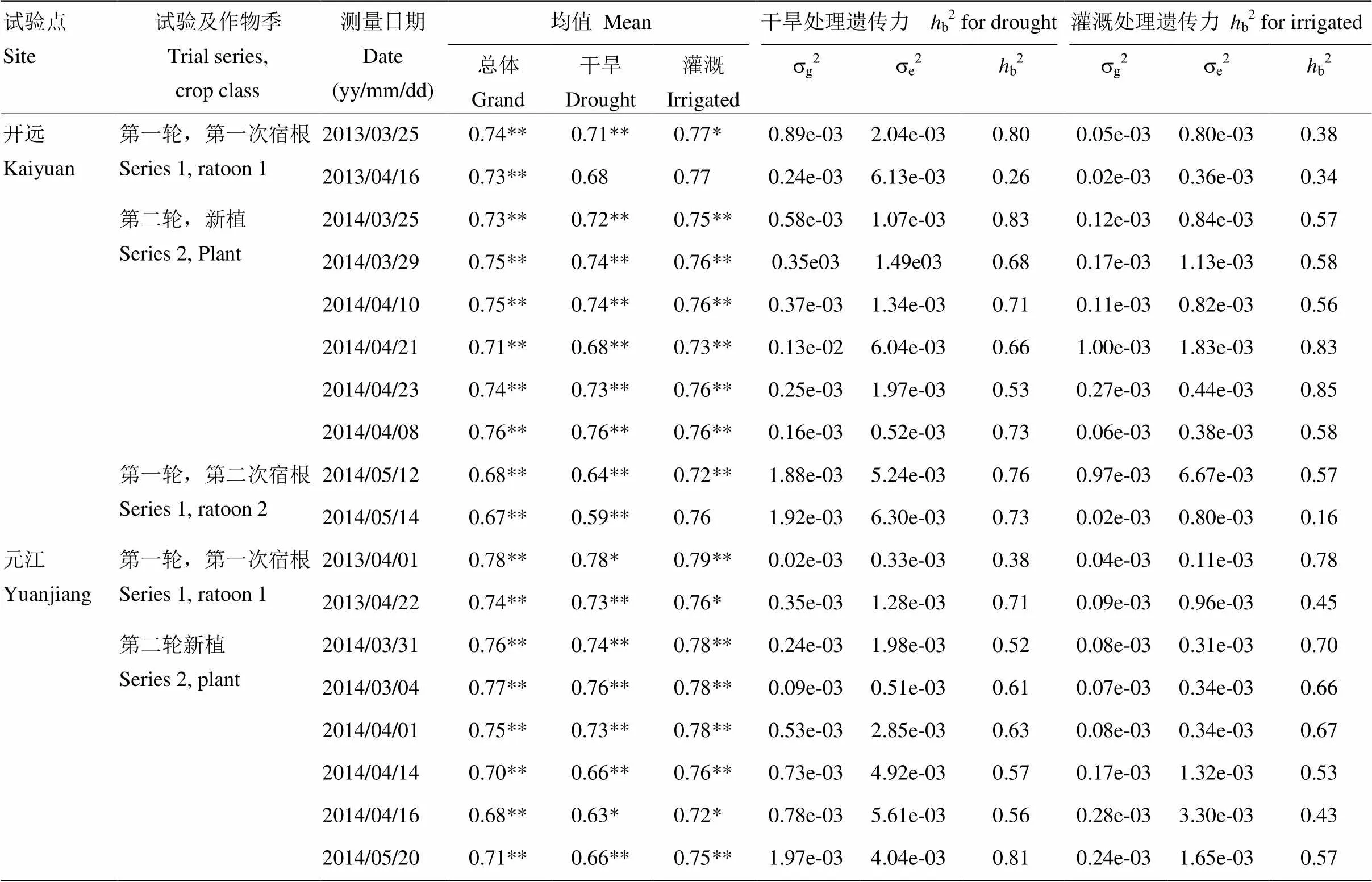
表3 Fv/Fm的方差分析,遗传方差分量(sg2),环境方差分量(se2)和广义遗传力(hb2)
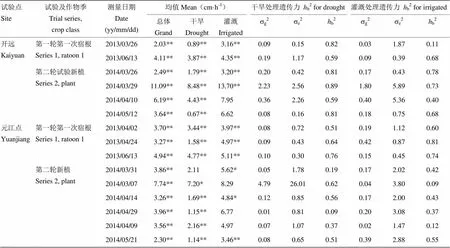
表4 LE的方差分析,遗传方差分量(sg2),环境方差分量(se2)和广义遗传力(hb2)

表5 RWC的方差分析,遗传方差分量(sg2),环境方差分量(se2)和广义遗传力(hb2)

表6 干旱和灌溉条件下4个生理指标的遗传方差差异
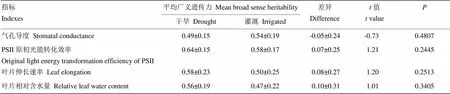
表7 干旱和灌溉条件下4个生理指标的广义遗传力差异
3 讨论
3.1 干旱胁迫对s遗传变异的影响
提高蒸腾效率是旱地作物遗传改良中应重点考虑的策略,但难于用于育种程序中,可考虑一些与蒸腾效率密切相关的生理指标[23]。植物气孔对蒸腾具有调节作用,s与不同环境下作物生长和产量有关[24],且受环境影响极大。尽管如此,小麦[25-27]、水稻[28]和马铃薯[29]育种间接地筛选高s的基因型。在甘蔗育种中,Basnayake等[16]的研究表明s遗传变异高,且与甘蔗产量间存在极高的遗传相关性,认为在甘蔗育种程序的早期阶段,s是一个有潜力的生理指标。本研究中,各次测量间的遗传方差差异较大,且各次测量环境方差均大于遗传方差,这与Basnayake等[16]的研究结果类似。甘蔗不同基因型间的s差异显著[30],一些研究建议[5,16]s作为甘蔗抗旱育种指标。本研究13次测量结果表明该性状在灌溉条件下的遗传方差显著高于干旱条件下的遗传方差,灌溉条件下的遗传力较干旱条件下高。
3.2 干旱胁迫对Fv/Fm遗传变异的影响
叶绿素荧光作为测量植物逆境如干旱胁迫下光合功能的一种替代手段,暗适应后测量的指标Fv/Fm为逆境相关研究中最容易测量,使用最广泛的荧光参数[31]。Fv/Fm在甘蔗受旱研究中主要集中于处理间和基因型间差异的比较,如在受旱13 d后,抗旱甘蔗品种SP83-2847和 CTC15维持约0.60的Fv/Fm,而不抗旱甘蔗品种SP86-155已降至0.36[4]。Luo等[6]研究表明Fv/Fm随水分胁迫强度增强而下降,变幅因品种抗旱性而异。亦有研究表明Fv/Fm可作为评价甘蔗品种抗旱性的指标[4-5,7,32]。然而,关于甘蔗受旱和灌溉条件下Fv/Fm遗传变异的研究较为缺乏。本研究18次测量结果表明该性状在干旱条件下的遗传变异显著高于灌溉条件下的遗传变异,总体而言,干旱条件下的广义遗传力更高。Silva等[7]的研究表明在干旱处理下4个甘蔗基因型间Fv/Fm差异显著,而灌溉处理下差异不显著。在干旱胁迫条件下Fv/Fm更易表现出基因型间的差异。
3.3 干旱胁迫对LE遗传变异的影响
最幼嫩新叶的伸长速率受基因型、水分等因素影响。LE可有效反映植物受旱胁迫程度[18]。对水分胁迫不敏感的基因型在干旱条件下仍能保持生长,研究LE在干旱和灌溉条件下的遗传变异,可为该指标在抗旱育种中的应用提供参考。本研究的15次测量结果表明干旱条件下LE的遗传方差和广义遗传力相对灌溉条件下较高。在干旱条件下,仅一次测量基因型间差异不显著,而灌溉条件下5次基因型间差异不显著。15次测量获得广义遗传力中,干旱条件下12次高于0.50,最高可达0.89;灌溉条件下8次高于0.50,但也可获得高达0.81的广义遗传力。
3.4 干旱胁迫对RWC遗传变异的影响
干旱可显著降低RWC,在干旱条件下,抗旱基因型较不抗旱基因型的RWC高,RWC越高的基因型抗旱性越强[32]。Silva等[7]研究了4个抗旱品种和4个不抗旱品种在干旱胁迫45 d后的RWC,品种间RWC差异显著,抗旱品种的RWC较不抗旱品种高16%。Begum等[8]研究表明基因型间RWC差异显著。本研究中,10次测量处理间均达极显著水平,在干旱条件下基因型间8次差异显著,灌溉条件下6次基因型间差异显著。总体而言,干旱处理获得的遗传变异和广义遗传力高于灌溉处理,但在干旱和灌溉条件下均可获得较高的广义遗传力,干旱和灌溉条件下的最高遗传力可分别达0.72和0.77。
4 结论
干旱胁迫影响s、Fv/Fm、LE和RWC的遗传变异和广义遗传力,在灌溉条件下测量s和在干旱条件下测量其他3个指标更易获得较高的遗传变异,但4个生理指标均能在灌溉条件下获得较高的广义遗传力。
References
[1] 张风娟, 李健, 杜成忠, 杨丽涛, 李杨瑞, 邢永秀. 不同甘蔗品种叶片气孔对水分胁迫的响应. 广西植物, 2014(6): 821-827.
Zhang F J, Li J, Du C Z, Yang L T, Li Y R, Xing Y X. Stomatal response to water stress in leaves of different sugarcane cultivars., 2014(6): 821-827. (in Chinese)
[2] 吴才文, 范源洪, 陈学宽, 刘家勇, 赵俊, 赵培方, 夏红明, 杨昆. 云南抗旱甘蔗品种的选育及效果. 中国糖料, 2012(4): 37-39.
Wu C W, Fan Y H, Chen X K, Liu J Y, Zhao J, Zhao P F, Xia H M, Yang K. Breeding of drought-resistant sugarcane varieties in Yunnan., 2012(4): 37-39. (in Chinese)
[3] Inman-Bamber N G, Smith D M. Water relations in sugarcane and response to water deficits., 2005, 92: 185-202.
[4] Graça J P D, Rodrigues F A, Farias J R B, de Oliveira M C N, Zingaretti C B H, Sonia M Z. Physiological parameters in sugarcane cultivars submitted to water deficit., 2010, 22(3): 187-197.
[5] Zhao D, Glaz B, Jack C. Sugarcane response to water-deficit stress during early growth on organic and sand soils., 2010, 5(3): 403-414.
[6] 罗俊, 张木清, 林彦铨, 张华, 陈如凯. 甘蔗苗期叶绿素荧光参数与抗旱性关系研究. 中国农业科学, 2004, 37(11): 1718-1721.
Luo J, Zhang M Q, Lin Y Q, Zhang H, Chen R K. Studies on the relationship of chlorophyll fluorescence characters and drought tolerance in seedling of sugarcane under water stress., 2004, 37(11): 1718-1721. (in Chinese)
[7] Silva de A M, John L J, Silva J A G D, Sharma V. Use of physiological parameters as fast tools to screen for drought tolerance in sugarcane., 2007, 19(3): 193-201.
[8] Begum M K, Alam M R, Islam M S, Arefin M S. Effect of water stress on physiological characters and juice quality of sugarcane., 2012, 14(2): 161-167.
[9] Basnayake J, Jackson P A, Inman-Bamber N G, Lakshmanan P. Sugarcane for water-limited environments. Genetic variation in cane yield and sugar content in response to water stress., 2012, 63(16): 6023-6033.
[10] Silva M d A, Jifon J L, Silva J A G d, Dos Santos C M, Sharma V. Relationships between physiological traits and productivity of sugarcane in response to water deficit., 2012, 152(1): 104-118.
[11] 金伟, 杨丽涛, 英潘, 杨建波, 罗超有, 李杨瑞. 不同甘蔗品种对干旱和复水的生态生理响应. 南方农业学报, 2012, 43(12): 1945-1951.
Jin W, Yang L T, Ying P, Yang J B, Luo C Y, Li Y R. Eco-physiological responses of different sugarcane varieties to drought and re-watering., 2012, 43(12): 1945-1951. (in Chinese)
[12] 潘方胤, 杨俊贤, 吴文龙, 刘福业, 吴建涛, 彭冬永, 陈勇生. 甘蔗育种中抗旱品系筛选及简易鉴定. 广东农业科学, 2012(16): 10-12.
Pan F Y, Yang J X, Wu W L, Liu F Y, Wu J T, Peng D Y, Chen Y S. Breeding and simple identification of drought-tolerant sugarcane line., 2012(16): 10-12. (in Chinese)
[13] 陈义强, 邓祖湖, 郭春芳, 陈如凯, 张木清. 甘蔗常用亲本及其衍生品种的抗旱性评价. 中国农业科学, 2007, 40(6): 1108-1117.
Chen Y Q, Deng Z H, Guo C F, Chen R K, Zhang M Q. Drought resistant evaluations of commonly used parents and their derived varieties., 2007, 40(6): 1108-1117. (in Chinese)
[14] Silva M D A, Soares R A B, Landell M G D A, Campana M P. Agronomic performance of sugarcane families in response to water stress., 2008, 67(3): 655-661.
[15] Tardieu F. Virtual plants: modelling as a tool for the genomics of tolerance to water deficit., 2003, 8(1): 9-14.
[16] Basnayake J, Jackson P A, Inman-Bamber N G, Lakshmanan P. Sugarcane for water-limited environments. Variation in stomatal conductance and its genetic correlation with crop productivity., 2015, 66(13): 3945-3958.
[17] Sliva M A, Silva J A G, Da Jifon J L, Sharma V. Use of physiological parameters to detect differences in drought tolerance among sugarcane genotypes., 2007, 26: 541-547.
[18] Inman-Bamber N G. Sugarcane water stress criteria for irrigation and drying off., 2004, 89(1): 107-122.
[19] Jackson P A, McRae T A. Gains from selection of broadly adapted and specifically adapted sugarcane families., 1998, 59(3): 151-162.
[20] Jackson P A, McRae T A. Selection of sugarcane clones in small plots: Effects of plot size and selection criteria., 2001, 41(2): 315-322.
[21] Stringer J K, Cullis B R, Thompson R. Joint modeling of spatial variability and within-row interplot competition to increase the efficiency of plant improvement., 2011, 16(2): 269-281.
[22] Zhao P F, Liu J Y, Yang K, Xia H M, Wu C W, Chen X K, Zhao J, Yang H C, Li J, Zan F G, Wu Z D, Yao L, Li F Q, Zhao L P. Registration of ‘YZ05-51’ sugarcane., 2015, 9(2): 172-178.
[23] Sinclair T R. Is transpiration efficiency a viable plant trait in breeding for crop improvement?, 2012, 39(5): 359-365.
[24] Condon A G, Richards R A, Rebetzke G J, Farquhar G D. Breeding for high water-use efficiency., 2004, 55(407): 2447-2460.
[25] Fischer R A, Rees D, Sayre K D, Lu Z M, Condon A G, Saavedra A L. Wheat yield progress associated with higher stomatal conductance and photosynthetic rate, and cooler canopies., 1998, 38(6): 1467-1475.
[26] Jiang G M, Sun J Z, Liu H Q, Qu C M, Wang K J, Guo R J, Bai K Z, Gao L M, Kuang T Y. Changes in the rate of photosynthesis accompanying the yield increase in wheat cultivars released in the past 50 years., 2003, 116(5): 347-354.
[27] Zheng T C, Zhang X K, Yin G H, Wang L N, Han Y L, Chen L, Huang F, Tang J W, Xia X C, He Z H. Genetic gains in grain yield, net photosynthesis and stomatal conductance achieved in Henan Province of China between 1981 and 2008., 2011, 122(3): 225-233.
[28] Horie T, Matsuura S, Takai T, Kuwasaki K, Ohsumi A, Shiraiwa T. Genotypic difference in canopy diffusive conductance measured by a new remote-sensing method and its association with the difference in rice yield potential., 2006, 29(4): 653-660.
[29] Prashar A, Yildiz J, McNicol J W, Bryan G J, Jones H G. Infra-red thermography for high throughput field phenotyping in., 2013, 8: e658166.
[30] Luo J, Pan Y B, XU L P, Zhang Y Y, Zhang H, Chen R K, Que Y X. Photosynthetic and canopy characteristics of different varieties at the early elongation stage and their relationships with the cane yield in sugarcane., 2014(2014): 707095.
[31] Furbank R T, Tester M. Phenomics-technologies to relieve the phenotyping bottleneck., 2011, 16(12): 635-644.
[32] Silva M D A, Jifon J L, Sharma V, Da Silva J A G, Caputo M M, Damaj M B, Guimaraes E R, Ferro M I T. Use of physiological parameters in screening drought tolerance in sugarcane genotypes., 2011, 13(3): 191-197.
(责任编辑 李莉)
Genetic Variation of Four Physiological Indexes as Impacted by Water Stress in Sugarcane
ZHAO Peifang1, ZHAO Jun1, LIU Jiayong1, ZAN Fenggang1, XIA Hongming1, P.A. Jackson2,J. Basnayake3,N.G. Inman-Bamber4, YANG Kun1, ZHAO Liping1, QIN Wei1, CHEN Xuekuan1, Zhao Xingdong5, FAN Yuanhong1
(1Sugarcane Research Institute, Yunnan Academy of Agricultural Sciences / Yunnan Province Key Laboratory of Sugarcane Genetic Improvement, Kaiyuan 661699, Yunnan, China;2CSIRO Plant Industry, ATSIP, Private Mail Bag PO, Aitkenvale, QLD, 4814, Australia;3Sugar Research Australia, PO Box 117, Ayr, QLD, 4807, Australia;4Crop Science Consulting, Townsville, Australia;5Cash Crop Research Station of Yuanjiang County of Yuxi Prefectural, Yuanjiang 653300, Yunnan, China)
【Objective】Understanding of the genetic variations in response to drought conditions of four physiological indexes, namely stomatal conductance (s), original light energy transformation efficiency of PSII (Fv/Fm), leaf elongation (LE) and leaf relative water content (RWC) could help their adaption to the current breeding program.【Method】The genetic variation (sg2), broad sense heritability (b2) under rainfed and irrigated conditions for four physiological indexes, namelys, Fv/Fm, LE and RWC were measured for 13, 18, 15 and 10 times, respectively, from two sets of field trials in 22 and 18 genotypes which were consistently conducted at two locations in Kaiyuan and Yuanjiang counties of Yunnan province in the crop growing periods of 2013 and 2014. In the trials, rainfed and irrigated treatments were set as the main plot, and genotype was used as the sub-plot. Thesg2and error variation (se2) for each index at each measurement was determined using software GenStat, andb2was calculated. Pairedtests for the differences ofsg2andb2between drought and irrigated treatments were processed using software SAS9.1.【Result】The mean differences between drought and irrigated treatments were all significant (<0.01) in 13, 18, 15 and 10 measurements ofs Fv/Fm, LE and RWC, respectively. Under drought and irrigated treatments, the differences ins among the genotypes was significant in 10 and 11 out of 13 measurements with the ranges ofb2at 0.19-0.68 and 0.19-0.82, and grand means of 0.49 and 0.53, respectively, overall significantly highersg2andb2were found under the irrigated treatment. The differences in Fv/Fm, among the genotypes were significant in 17 and 16 out of 18 measurements with the ranges ofb2at 0.26-0.83 and 0.16-0.85, and grand means of 0.64 and 0.58, respectively, overall highersg2andb2were found under the drought treatment. The differences in LE among the genotypes were significant in 14 and 10 out of 15 measurements with the ranges ofb2at 0.09-0.89 and 0.09-0.81, and grand means of 0.58 and 0.50, respectively, overall highersg2andb2were found under the drought treatment. The differences in RWC among the genotypes were significant in 8 and 6 out of 10 measurements with the ranges ofb2at 0.10-0.76 and 0.16-0.77, and grand means of 0.57 and 0.47, respectively, overall highersg2andb2were found under the drought treatment. 【Conclusion】Thesg2andb2ofs, Fv/Fm, LE and RWC were impacted by water stress, in general, much highersg2andb2ofs could be obtained under irrigated conditions and that of Fv/Fm, LE and RWC under drought conditions. However, higherb2could be obtained under irrigated conditions for all the four physiological indexes.
sugarcane; water stress; physiological index; genetic variation
2016-06-27;接受日期:2016-09-05
云南省高端科技人才引进计划(2012HA001)、云南省委组织部海外高层次人才引进计划
赵培方,Tel:0873-3166326;E-mail:hnzpf@163.com。赵俊,E-mail:junzhao_ky@126.com。赵培方和赵俊为同等贡献作者。通信作者范源洪,Tel:0871-65195022;E-mail:fyhysri@vip.sohu.com

