AntagomiR-103协同阿霉素对TGF-β1诱导的HepG2细胞转化及生长的影响*
王金利, 张 敏
(1.无锡市惠山区人民医院, 江苏 无锡 214187; 2.贵州医科大学, 贵州 贵阳 550004)
AntagomiR-103协同阿霉素对TGF-β1诱导的HepG2细胞转化及生长的影响*
王金利1, 张 敏2**
(1.无锡市惠山区人民医院, 江苏 无锡 214187; 2.贵州医科大学, 贵州 贵阳 550004)
目的: 探讨antagomiR-103协同阿霉素(ADM)对TGF-β1诱导肝癌细胞(Hep G2)发生上皮-间质细胞转化(EMT)及Hep G2细胞存活率的影响。方法: Hep G2细胞体外培养,设为control组、TGF-β1组、TGF-β1+ADM组、TGF-β1+microRNA inhibitor N.C组、TGF-β1+ADM+microRNA inhibitor N.C组、TGF-β1+antagomiR-103组、TGF-β1+ADM+antagomiR-103组及使用western-blot检测EMT标志蛋白N-Cadherin、E-Cadherin、vimentin的表达水平;设control组、TGF-β1组、antagomiR-103组、TGF-β1+antagomiR-103组,用不同浓度的ADM作用于各组细胞24 h,使用MTT法检测细胞存活率,并计算IC50。结果: 与control组相比,antagomiR-103+ADM组E-Cadherin表达上调,N-Cadherin、Vimentin表达下调;细胞存活率随ADM浓度的增高而逐渐降低;在ADM浓度相同的条件下,不同药物预处理组之间进行比较,当ADM浓度为25 mg/L时,antagomiR-103+ADM组的细胞存活率明显低于其他组。结论: antagomiR-103联合ADM可抑制TGF-β1诱导发生EMT的Hep G2细胞存活。
药物疗法,联合; 肝肿瘤; 细胞; antagomiR-103; 阿霉素; 上皮细胞-间充质细胞转换; TGFβ-1
目前临床上治疗肝癌一般采取手术为主,辅以化疗的综合治疗方案[1],化疗药物是通过诱导肿瘤细胞凋亡而达到治疗效果,但肿瘤细胞容易对化疗药物产生多药耐药性导致化疗失败[2]。临床常用于治疗肝癌的化疗药物阿霉素(doxorubicin,ADM)是一种周期非特异性抗癌化疗药,对各期细胞均有很强的细胞毒性作用,其作用机制是通过插入并解开DNA的双螺旋链,改变DNA的模板性质,抑制DNA聚合酶,从而抑制细胞DNA和RNA合成[3-4]。邓立力等[5]发现,ADM可以促进细胞表面死亡受体的表达,诱导肝癌细胞凋亡,肝癌患者在长期使用ADM后很容易产生耐药性。有研究发现,在肿瘤发生上皮-间质细胞转化(epithelial-mesenchymal transitions,EMT)过程中,miRNA作为具有调控功能的小分子RNA与肿瘤对化疗药物的反应有密切联系[6]。本实验通过微小RNA(microRNA,miRNA)干扰技术,设计合成miRNA-103的阻断试剂antagomiR-103,对肝癌细胞(Hep G2)进行干预,将antagomiR-103与ADM共同作用于Hep G2细胞,观察两者对肿瘤细胞存活率的影响,检测EMT标志蛋白N-Cadherin、E-Cadherin、vimentin的表达变化。
1 材料与方法
1.1 材料与设备
人肝癌细胞系Hep G2购自中国科学院上海生命科学研究院细胞库,胎牛血清为HyClone公司产品,DMEM培养基为Gibco公司产品,胰蛋白酶为美国Ameresco公司产品,antagomiR-103、antagomiRNA-MUT、has-miR-103、microRNA mimics N.C、microRNA inhibitor N.C由上海吉玛制药技术有限公司设计合成,阿霉素为深圳万乐药业有限公司产品,E-Cadherin、N-CadherinBioworld和Vimentin抗体均购自Bioworld生物科技有限公司,其他试剂均为国产或进口分析纯试剂。超净工作台(SW-CJ-2FD,苏州净化设备有限公司),倒置显微镜(CKX41,日本Olympus公司),超低温冰箱(MDF-382E,日本SANYO公司),恒温CO2 培养箱(Model 310,美国Thermo公司),全自动雪花制冰机(IMS-40,常熟市雪科电器有限公司)。
1.2 方法
1.2.1 细胞培养 人肝癌细胞株HepG2 使用10%胎牛血清(FBS)+DMEM培养基混合液,置于37 ℃、CO2体积分数为5% 孵箱中培养,将2×107/mL的Hep G2细胞接种于6 cm培养皿中,加入含10%胎牛血清的DMEM置于5% CO2孵箱中培养24 h后,更换无酚红无血清的DMEM培养2 h,加入含10%胎牛血清的DMEM,继续培养24、48 h后收集细胞,完成后续试验。
1.2.2 EMT标志蛋白E-Cadherin、N-Cadherin、Vimentin检测 将体外培养的Hep G2细胞分为control组、TGF-β1组、TGF-β1+ADM组、TGF-β1+microRNA inhibitor N.C组、TGF-β1+ADM+microRNA inhibitor N.C组、TGF-β1 + antagomiR-103组及TGF-β1+ ADM+antagomiR-103组;收集培养细胞,加入全细胞裂解液每皿80 μL,-20 ℃、14 000 r/min离心20 min;收集上清,BCA法测定蛋白浓度,取30 μg总蛋白行SDS-PAGE电泳,在300 mA、1 h的条件下将蛋白转移至PVDF膜,用5 g/L脱脂奶粉TBST稀释液封闭1 h后用E-Cadherin、N-Cadherin、Vimentin和GAPDH抗体4 ℃孵育过夜,用TBST洗涤后加入相应二抗孵育2 h后ECL法进行显影,检测E-Cadherin、N-Cadherin、Vimentin蛋白的表达。
1.2.3 细胞增殖能力 对数生长期的Hep G2细胞用0.25%的胰酶消化后,以细胞浓度为 8×103/mL接种于96孔板内,每张板设空白调零组、阴性对照组、ADM组、ADM+TGF-β1组、ADM+antagomiR-103组及ADM+TGF-β1+antagomiR-103组;ADM设8个药物浓度(C1~C8)分别为100、50、25、12.5、6.25、3.125、1.56、0.78 mg/L;ADM+TGF-β1组为加入上述C1~C8的ADM和5 μg/L TGF-β1,ADM+antagomiR-103组为加入上述C1~C8的ADM和100 nmol/L antagomiR-103,ADM+TGF-β1+antagomiR-103组为加入上述C1~C8的ADM和100 nmol/L antagomiR-103及5 μg/L TGF-β1;每组均设6个复孔。细胞加药后继续培养48 h,弃去培养液,向各孔加入MTT液,使细胞与0.25% MMT在37 ℃、5% CO2孵箱中继续培养4 h,弃去上清液,加入DMSO 200 μL低速振荡10 min,结晶震荡溶解后,通过酶标仪于490 nm波长处测定各孔光密度,计算IC50值。
1.3 统计学分析

2 结果
2.1N-Cadherin、E-Cadherin、vimentin表达
western-blot结果显示,与control组细胞相比,TGF-β1组中N-Cadherin、Vimentin表达上调、E-Cadherin表达下调;与TGF-β1组细胞相比,TGF-β1+antagomiR-103组中N-Cadherin、Vimentin表达下调、E-Cadherin表达上调;TGF-β1+ADM+antagomiR-103组中N-Cadherin、Vimentin表达下调、E-Cadherin表达上调;差异有统计学意义(P<0.05)。这些结果说明antagomiR-103与ADM共同作用于TGF-β1诱导的HepG2细胞,可以明显抑制细胞发生EMT。
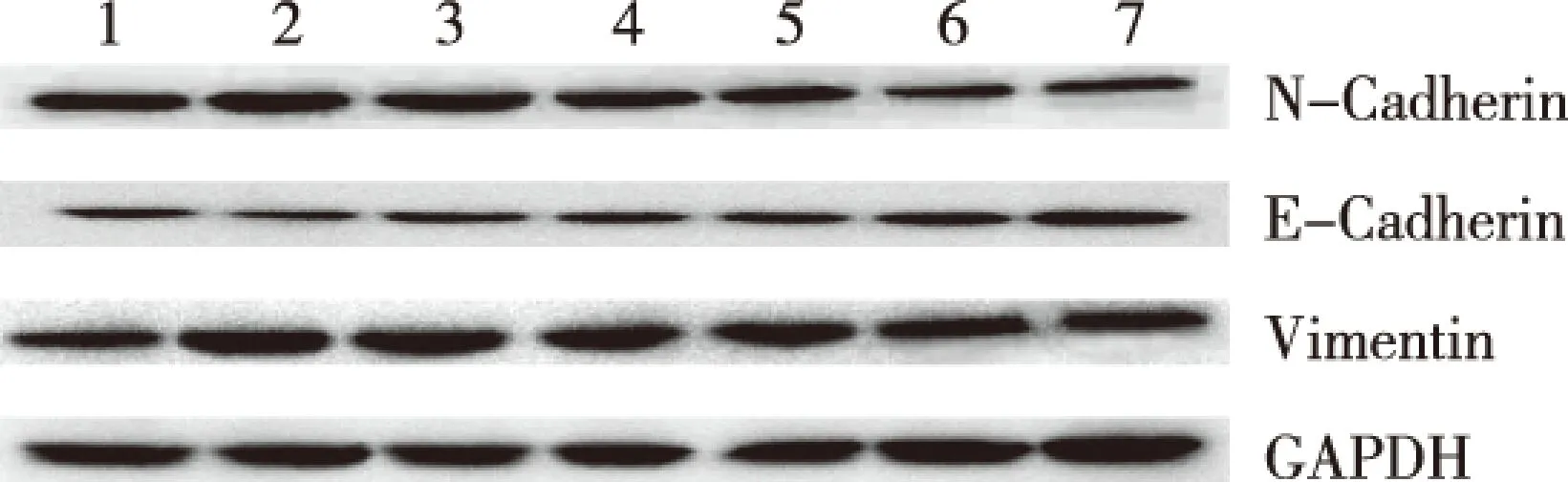
注:1为control组,2为TGF-β1组,3为TGF-β1+ADM组,4为TGF-β1+microRNA inhibitor N.C组,5为TGF-β1+ADM+microRNA inhibitor N.C组,6为TGF-β1 + antagomiR-103组,7为TGF-β1+ ADM+antagomiR-103组图1 各实验组EMT相关蛋白的表达(western blot)Fig.1 Expression of EMT related protein in each experimental group
2.2 ADM对Hep G2细胞存活率的影响
将Hep G2细胞分为control组、8个不同浓度ADM组,体外培养24 h后,使用MTT法检测不同浓度ADM对Hep G2细胞存活率的影响。结果显示,与control组细胞相比,随着ADM浓度的增高,细胞存活率随之显著减少,差异有统计学意义(P<0.01),见表1。当ADM浓度增高至50、100 mg/L时,HepG2细胞存活率与其他剂量组相比略有增高,原因不明。经统计学分析计算得出ADM的半数抑制浓度(IC50)为6.699 mg/L,见图2。
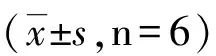
表1 ADM对Hep G2细胞存活率 的影响Tab.1 The negative effect of ADM onHep G2 cell survival
(1)与control组比较,P<0.01
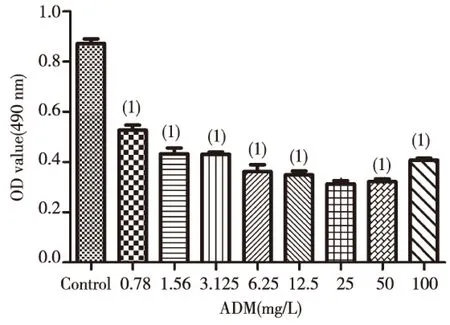
注:(1)与control组比较,P<0.01图2 ADM对Hep G2细胞存活率的影响Fig.2 The negative effect of ADM on Hep G2 cell survival
2.3 ADM对TGF-β1诱导发生EMT的Hep G2细胞存活率的影响
用TGF-β1(5 μg/L)诱导Hep G2细胞发生EMT,同时给予不同浓度ADM处理细胞24 h,MTT法检测ADM对细胞存活率的影响。结果显示,与TGF-β1组相比,细胞存活率明显下降, 差异有统计学意义(P<0.01),见表2。经统计学分析计算,ADM的IC50为8.698 mg/L,是ADM作用于未发生EMT的Hep G2细胞的IC50的1.3倍,提示ADM对TGF-β1诱导发生EMT的Hep G2细胞的作用减弱,促进细胞凋亡的能力降低,当ADM浓度增高至50、100 mg/L时,细胞存活率与其他剂量组相比略有增高,见图3。
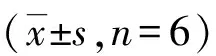
表2 ADM对TGF-β1诱导发生EMT的Hep G2细胞存活率的影响Tab.2 The negative effect of ADM on TGF-β1 induced EMT's Hep G2 cell survival
注:(1)与control组比较,P<0.01

注:(1)与control组比较,P<0.01图3 ADM对TGF-β1诱导发生EMT的Hep G2细胞存活率的影响Fig.3 The negative effect of ADM on TGF-β1 induced EMT's Hep G2 cell survival
2.4 antagomiRNA-103与ADM共同作用对Hep G2细胞存活率的影响
用antagomiR-103(100 nmol/L)和8个不同浓度的ADM共同作用于Hep G2细胞24 h,MTT法检测ADM对Hep G2细胞存活率的影响。结果显示,与antagomiR-103组相比,ADM+antagomiR-103组的细胞存活率明显下降(P<0.01),见表3。经统计学分析计算,ADM和antagomiR-103共同作用于Hep G2细胞,其IC50为3.826 mg/L,与ADM单独作用于Hep G2细胞的IC50相比明显降低, ADM组中ADM的IC50是ADM+antagomiR-103组中ADM的IC50的1.75倍,ADM+TGF-β1组中ADM的IC50是ADM+antagomiR-103组中ADM的IC50的2.27倍,见图4。提示antagomiR-103可以促进ADM诱导的细胞凋亡,两者有协同作用。当ADM浓度增高至50、100 mg/L时,细胞存活率与其他剂量组相比略有增高。
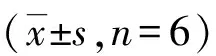
表3 antagomiR-103与ADM共同作用对Hep G2细胞存活率的影响Tab.3 The negative effect of antagomiR-103 and ADM on Hep G2 cell survival
(1)与antagomiR-103组相比,P<0.01
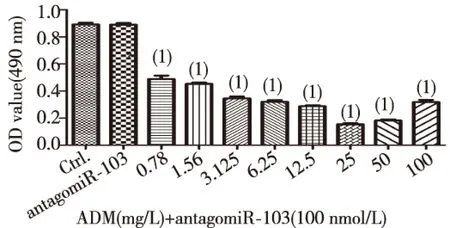
(1)与antagomiR-103组相比,P<0.01图4 antagomiR-103与ADM共同作用对Hep G2细胞存活率的影响Fig.4 The negative effect of antagomiR-103 and ADM on Hep G2 cell survival
2.5 antagomiR-103与ADM共同作用对TGF-β1诱导发生EMT的Hep G2细胞存活率的影响
用antagomiR-103(100 nmol/L)和8个不同浓度的ADM共同作用于TGF-β1诱导发生EMT的Hep G2细胞24 h,MTT法检测antagomiR-103与ADM对TGF-β1诱导发生EMT的Hep G2细胞存活率的影响。结果显示,与control组、antagomiR-103+TGF-β1组相比,ADM+antagomiR-103+TGF-β1组的细胞存活率明显下降(P<0.01),见表4。经统计学分析计算,ADM和antagomiR-103共同作用于TGF-β1诱导发生EMT的Hep G2细胞,ADM的IC50为3.913 mg/L,与ADM单独作用于Hep G2细胞时ADM的IC50相比明显降低, ADM组中ADM的IC50是ADM+antagomiR-103+TGF-β1组中ADM的IC50的1.71倍;ADM+TGF-β1组中ADM的IC50是ADM+antagomiR-103+TGF-β1组中ADM的IC50的2.22倍,见图5。提示antagomiR-103与ADM共同作用于TGF-β1诱导发生EMT的Hep G2细胞,可以促进细胞凋亡,两者有协同作用。当ADM浓度增高至50、100 mg/L时,细胞存活率与其他剂量组相比略有增高。
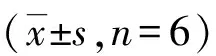
表4 antagomiR-103与ADM共同作用对TGF-β1 诱导发生EMT的Hep G2细胞 存活率的影响Tab.4 The negative effect of antagomiR-103 and ADM on TGF-β1 induced EMT's Hep G2 cell survival
(1)与antagomiR-103+ TGF-β1组相比,P<0.01
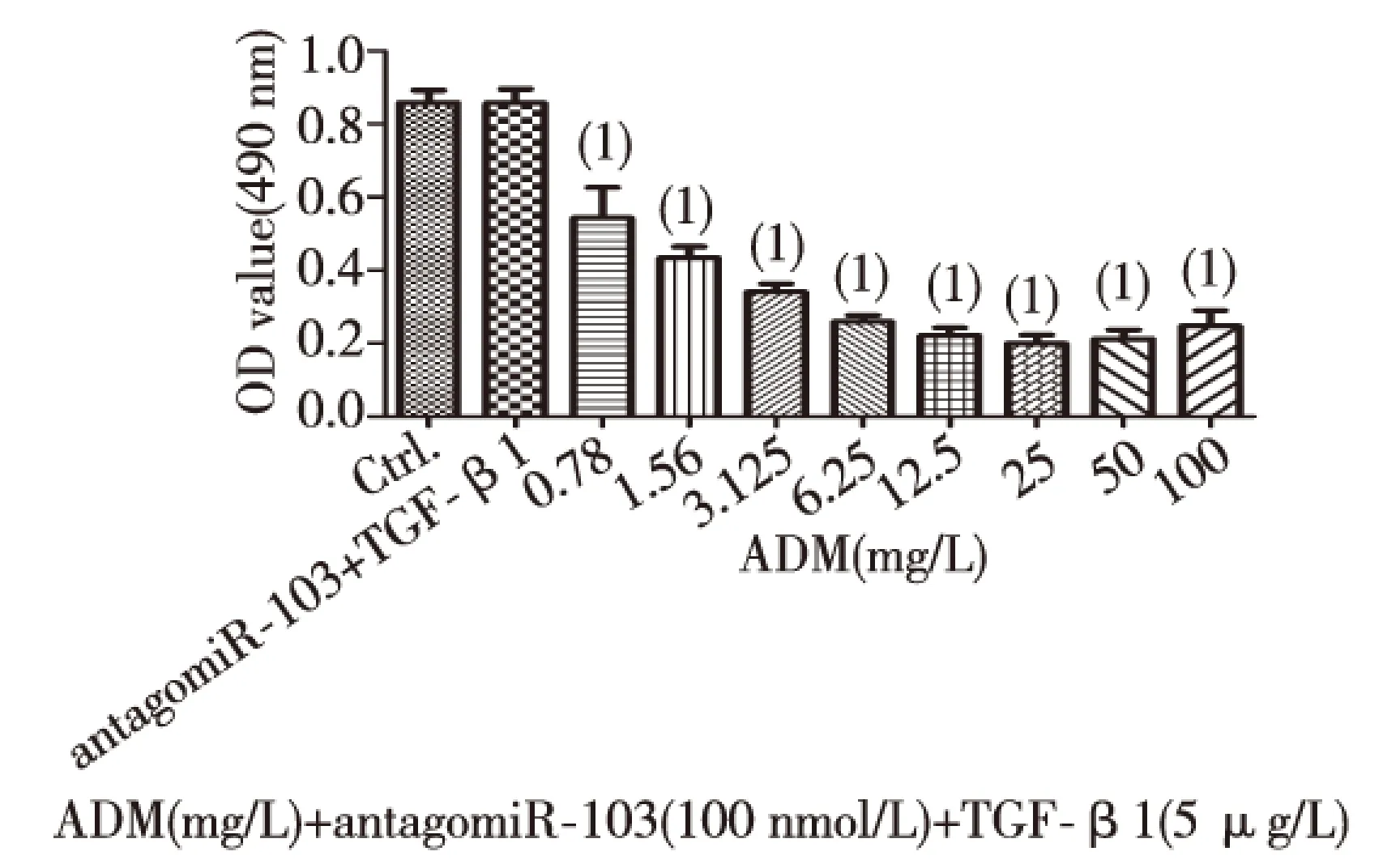
(1)与antagomiR-103+ TGF-β1组相比,P<0.01图5 antagomiR-103与ADM共同作用对TGF-β1诱导发生EMT的Hep G2细胞存活率的影响Fig.5 The negative effect of antagomiR-103 and ADM on TGF-β1 induced EMT's Hep G2 cell survival
3 讨论
EMT的发生与多种因素有关,受到多种细胞调控因子的调控,如TGF-β[7]、FGF[8]、EGF[9]等,可以诱导EMT的发生,也可以引起肿瘤细胞的增殖。Akhurst RJ[10]研究发现,肿瘤细胞系被转入外源性TGF-β1后都出现不同程度的上皮表型缺失,获得侵袭特征,阻碍TGF-β受体可以阻止EMT的发生和肿瘤细胞侵袭。ADM是一种广谱、高效抗肿瘤的蒽环类化合物,对各期细胞有很强的细胞毒性作用,可破坏细胞膜的结构和功能,可以通过p53依赖或p53非依赖的途径来诱导细胞凋亡[11],这可能是ADM引起细胞存活率下降的原因之一。
在本实验中,TGF-β1诱导发生了EMT的Hep G2细胞存活率与对照组相比无明显差异,原因可能是EMT的抗凋亡作用,推测发生EMT的细胞激活了抗凋亡的信号通路或抗凋亡的因子生成,如Wnt/β-连环素信号通路下游靶基因survivin、eyelinDI,可促进细胞周期进程、引起细胞增殖和抑制细胞凋亡[12]。但是细胞由上皮细胞表型转化为间质细胞表型,可能也是抗凋亡的一个关键因素。TGF-β1可诱导肝脏实质细胞发生凋亡,存活下来的细胞发生EMT,获得一定的抗凋亡活性[13]。
在本实验中,ADM单独作用于TGF-β1诱导的Hep G2细胞,与control组、TGF-β1组相比,EMT的标志性蛋白E-Cadherin、N-Cadherin及Vimentin表达变化不明显,差异无统计学意义;antagomiR-103与ADM共同作用于TGF-β1诱导的Hep G2细胞,与TGF-β1组相比,N-Cadherin表达下调、E-Cadherin表达上调、Vimentin表达下调,差异有统计学意义(P<0.05),这些结果表明,ADM对TGF-β1诱导的Hep G2细胞发生EMT未表现出抑制作用,antagomiR-103与ADM共同作用于TGF-β1诱导的Hep G2细胞,对细胞发生EMT有抑制作用。antagomiR-103联合化疗药物ADM共同作用于TGF-β1诱导发生EMT的Hep G2细胞,使用MTT法检测ADM对Hep G2细胞存活率的影响, 结果显示,细胞存活率随着ADM浓度的增高而降低,ADM对TGF-β1诱导发生EMT的Hep G2细胞存活率的影响;细胞存活率随着ADM浓度的增高而降低,但与单独使用ADM组相比,在相同浓度ADM作用下,细胞存活率变化并无明显差异,可能与TGF-β1的增殖和诱导EMT的作用有关,antagomiR-103与化疗药物ADM共同作用于Hep G2细胞对其存活率的影响。结果显示,细胞存活率随着ADM浓度的增高而明显降低,在ADM浓度为25 mg/L时,与单独使用ADM组、单独使用antagomiR-103组细胞存活率相比明显降低(P<0.01),有统计学意义;antagomiR-103与ADM共同作用于TGF-β1诱导发生EMT 的Hep G2细胞,MTT检测细胞存活率,结果还显示,与control组、antagomiR-103+TGF-β1组相比,ADM+antagomiR-103+TGF-β1组的细胞存活率明显下降(P<0.01)。
综上所述,antagomiR-103对TGF-β1诱导的Hep G2细胞EMT的发生有抑制作用,与ADM共同作用于Hep G2细胞也明显引起细胞存活率降低,使ADM半数抑制浓度明显降低,这些结果的发现考虑可能与其它信号通路或miRNA协同、拮抗作用相关,但是具体的作用机制本实验尚未深入探讨,将在今后的实验中继续深入研究。利用miRNA的基因干预调控阻断肝癌细胞的EMT,同时辅以化疗药物治疗肝癌具有很高的可行性,将对临床肝癌转移、复发的防治具有重大意义。这可能为揭秘肿瘤侵袭和转移的机制提供更为可靠的理论依据,为肿瘤患者的治疗带来新的希望。
[1] 原发性肝癌诊疗规范(2011年版)[J]. 临床肝胆病杂志, 2011(11):1141-1159.
[2] Philip J,Johnson.Systemic chemotherapy of liver tumors[J].Semin Surg Oncol, 2000(2):116-124.
[3] Tomris O.Mechanisms and strategies to overcome multilple drug resistance in cancer[J].FEBS Lett, 2006(12):2903-2909.
[4] Perez EA.Impact,mechanisms,and novel chemotherapy strategies for overcoming resistance to anthracyclines and taxanes in metastatic breast cancer[J].Breast Cancer Res Treat, 2009(2):195-201.
[5] 邓立力,吕慧芳,王文秀,等.阿霉素对肝癌细胞增殖及TRAIL受体表达影响的实验研究[J].中国肿瘤, 2011(7):515-520.
[6] 薛逸荃,曹雪涛. RNA异常与肿瘤调控研究进展[J]. 中国肿瘤生物治疗杂志, 2013(1):1-12.
[7] Tanahashi T,Osada S,Yamada A,et al.Extracellular signal-regulated kinase and Akt activation play a critical role in the process of hepatocyte growth factor-induced epithelial-mesenchymal transition.[J].Int J Oncol, 2013(2): 556-564.
[8] Nguyen L,Fifis T,Malcontenti-Wilson C,et al.Spatial morphological and molecular differences within solid tumors may contribute to the failure of vascular disruptive agent treatments.[J].BMC Cancer, 2012(12):522.
[9] Alipio ZA, Jones N, Liao W, et al. Epithelial to mesenchymal transition (EMT) induced by bleomycin or TFG-β1/EGF in murine induced pluripotent stem cell-derived alveolar Type II-like cells[J]. Differentiation, 2011(2): 89-98.
[10]Akhurst RJ,Derynck R.TGF-beta signaling in cancer-a double-edged sword[J].Trends Cell Biol, 2001(11):44-51.
[11]Fornari F,Gramantieri L,Giovannini C,et al.MiR-122/cydinG1 interaction modulates p53 activity and afects doxorubicin sensitivity of human hepatocarcinoma cells[J].Cancer Res, 2009(14):5761-5767.
[12]Robson EJ,Khaled WT,Abell K,et al.Epithelial-to-mesenchymal transition confers resistance to apoptosis in three murine mammary epithelial cell lines[J].Differentiation, 2006(5):254-264.
[13]Del Castillo G,Murillo MM,Alvarez-Barrientos A,et al.Autocrine production of TGF-beta confers resistance to apoptosis after an epithelial-mesenchymal transition process in hepatocytes: Role of EGF receptor ligands[J].Exp Cell Res, 2006(15):2860-2871.
(2016-08-29收稿,2016-11-06修回)
中文编辑: 刘 平; 英文编辑: 刘 华
Effects of AntagomiR-103 and ADM on TGF-β1 Induced EMT and Growth of Hep G2 Cell
WANG Jinli1, ZHANG Min2
(1.thePeople'sHospitalofHuishanDistrict,Wuxi214187,Jiangsu,China; 2.DepartmentofPharmacology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
Objective: To investigate the effect of antagomir-103 synergized by ADM on epithelial mesenchymal transition (EMT) in Hep G2 induced by TGF-β1 and on the cell survival rate of and Hep G2 cells. Methods: Hep G2 cells were cultivated in DMEM with 10% fetal calf serum and divided into the control group, the TGF-β1 group, TGF-β1+ADM group, TGF-β1+microRNA inhibitor N.C group, TGF-β1+ADM+microRNA inhibitor N.C group, the TGF-β1+antagomiR-103 group, and the TGF-β1+ ADM+antagomiR-103 group. Western-blot was adopted to detect the expression level of EMT, E-cadherin, vimentin and N-cadherin in all these groups. On the other hand, the Hep G2 cells were also divided into the control group, TGF-β1group, antagomiR-103 group, TGF-β1+antagomiR-103. With different concentrations of ADM on each above group for 24 h, MTT method was used to detect cell survival rate, and IC 50 was calculated. Results: Compared with control group, the expression of E-cadherin was up-regulated in antagomiR-103+ADM group, while N-cadherin, vimentin expression was down regulated. The cell survival rate decreased with the increase of ADM concentration. The cell survival rate of antagomiR-103+ADM group was significantly lower than that of the other groups at the same ADM concentration and when the ADM concentration was 25 mg/L. Conclusion: antagomiR-103 combined with ADM can inhibit transformation of TGF-β1 induced EMT and growth of Hep G2 cell.
drug therapy,combination; liver neoplasms; cells; antagomiR-103; adriamycin; epithelial-mesenchymal transitions; TGFβ-1
贵阳市科技局基金项目[(2011103)17号]
时间:2016-12-15
http://www.cnki.net/kcms/detail/52.1164.R.20161215.1534.010.html
R329.25; R575.2
A
1000-2707(2016)12-1424-06
10.19367/j.cnki.1000-2707.2016.12.013
**通信作者 E-mail:1071632869@qq.com

