AβOs对大鼠原代海马神经细胞丝裂原活化蛋白激酶信号转导通路的影响*
赵 亮, 官志忠
(1.贵州医科大学 微生物学教研室, 贵州 贵阳 550025; 2.贵州医科大学附院 病理科, 贵州 贵阳 550004; 3.贵州医科大学 地方病与少数民族性疾病教育部重点实验室, 贵州 贵阳 550004; 4.贵州省医学分子生物学重点实验室 贵州医科大学, 贵州 贵阳 550004)
·专题研究1·
AβOs对大鼠原代海马神经细胞丝裂原活化蛋白激酶信号转导通路的影响*
赵 亮1,2, 官志忠2,3,4**
(1.贵州医科大学 微生物学教研室, 贵州 贵阳 550025; 2.贵州医科大学附院 病理科, 贵州 贵阳 550004; 3.贵州医科大学 地方病与少数民族性疾病教育部重点实验室, 贵州 贵阳 550004; 4.贵州省医学分子生物学重点实验室 贵州医科大学, 贵州 贵阳 550004)
目的: 观察β-淀粉样蛋白寡聚体(AβOs)对原代培养大鼠海马神经细胞丝裂原活化蛋白激酶(MAPK)信号转导通路的影响。方法: 原代培养大鼠海马神经细胞,用免疫荧光染色鉴定纯度,制备并鉴定AβOs,用不同浓度AβOs(0.25、0.5、1及10 μmol/L)处理细胞48 h,采用CCK-8试验检测细胞的存活率,蛋白印迹法(Western blotting)检测细胞中细胞外信号调节蛋白激酶(ERK)、c-Jun氨基末端激酶(JNK)及p38磷酸化及总蛋白表达水平。结果: 免疫荧光染色结果显示原代大鼠海马神经细胞的体外培养纯度达85%以上;低于0.5 μmol/L AβOs对原代神经细胞无明显毒性作用,但可见phospho-ERK1/2 和phospho-JNK 蛋白表达升高;1 μmol/L及更高浓度的AβOs对原代神经细胞有细胞毒性作用,同时可引起phospho-ERK1/2和phospho-JNK蛋白表达水平均降低,但总ERK1/2及总JNK蛋白表达水平未受明显影响,而phospho-p38 及总p38蛋白表达水平与AβOs作用浓度呈负相关。结论: AβOs与MAPK信号通路之间的作用可因AβOs的作用浓度不同而出现差异。
阿尔兹海默病; β-淀粉样蛋白寡聚体; 线粒体活化蛋白激酶通路; 原代培养神经细胞
阿尔兹海默病(alzheimer’s disease,AD)是老年性痴呆中最常见类型之一[1-2],其组织病理学特征包括细胞内过度磷酸化的Tau蛋白组成的神经纤维缠结(neurofibrillary tangles,NFTs)、细胞外β淀粉样蛋白(β-amyloid peptide,Aβ)组成的老年斑(senile plaques,NPs)和神经元选择性丢失等[1]。越来越多的研究提示,在AD的致病因素中,大脑内异常增多的可溶性β-淀粉样蛋白寡聚体(β-Amyloid peptide oligomers,AβOs)较细胞外形成老年斑的Aβ更为重要[3-4],并认为其在AD早期的突触丢失和认知损害中扮演着重要的角色,其机制可能与氧化应激和凋亡有关[5],并发现多条信号转导通路参与AD的病理过程。研究显示,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)可通过多种机制参与AD的发病过程,三种激酶主要为细胞外信号调节蛋白激酶(extracellular signal regulated protein kinase,ERKs或p42/44MAPK)、原癌基因c-Jun N末端蛋白激酶(JNKs/SAPK MAPK)和p38丝裂原活化蛋白激酶(p38 MAPK),MAPK/ERK信号转导通路可通过调节蛋白激酶活性,在淀粉样前体蛋白(amyloid precursor protein,APP)加工过程中发挥重要作用[6-7];给小鼠海马注射AβO(1-42),可持续改变ERK/MAPK通路的活性,产生AD早期认知损害[8]。研究显示,Aβ能诱导p38 MAPK活化,通过Ca2+外流和非G蛋白相关机制,导致树突棘丢失[9]。本实验以不同浓度AβOs作用于大鼠原代培养海马神经细胞,以期了解AβOs对MAPK各信号转导通路的影响。
1 材料与方法
1.1 材料
24 h内新生SD乳鼠14只,体质量5~10 g由贵州医科大学动物实验中心提供(合格证号SCXK,黔2012-0004),研究获得贵州医科大学伦理委员会批准(NO 1311018)。多聚赖氨酸、Aβ1-42、六氟异丙醇等(美国Sigma);细胞计数试剂盒(日本Dojindo); SDS-PAGE 凝胶配制试剂盒(碧云天);免疫组化检测试剂盒(上海基因),山羊血清(中杉金桥);Cruz Marker分子量标准、抗小鼠IgG(美国Santa Cruz公司)。兔抗phospho-p44/42和抗p44/42 MAPK单克隆抗体、U0126、兔抗phospho-SAPK/JNK MAPK和抗SAPK/JNK MAPK单克隆抗体、兔抗phospho-p38 MAPK和抗p38 MAPK单克隆抗体、抗兔IgG、蛋白酶/磷酸酶抑制剂(美国Cell Signaling公司);BCA蛋白定量试剂盒、CY-3标记的羊抗小鼠IgG抗体和488标记的羊抗兔IgG抗体(美国Thermo公司);Neurobasal-A 培养基、DMEM-F12高糖培养基、Hibernate-E培养基、GlutaMAX添加剂、Novex 4-12% Bis-Tris预制胶、MES SDS电泳液(美国Life Technologies公司);PVDF膜、ECL试剂盒(德国Merck Millipore公司);兔抗GFAP单克隆抗体(丹麦Dako公司);小鼠抗Aβ多克隆抗体6E10(美国Covance公司),兔抗β-actin抗体(Abmart)。
1.2 方法
1.2.1 大鼠海马原代神经细胞的培养与鉴定 (1)原代神经细胞的培养,参考文献[10-11],将新生SD乳鼠用75%酒精浸泡消毒,无菌操作取大脑于预冷的Hibernate A培养基中。在解剖镜下分离海马,并去除脑膜及血管, 0.25% 胰蛋白酶37 ℃水浴消化15 min,用含10%胎牛血清的DMEM-F12种植培养基终止消化,用Neurobasal A/B27完全培养基(含有Neurobasal A培养基、2% B27、1% GlutaMAX添加剂、100 U/mL青霉素及100 g/L链霉素)吹散细胞,静置后取上层细胞悬液,台盼蓝染色后进行细胞计数,以5×107个/L密度接种在经左旋赖氨酸(PLL)包被过的6孔板或96孔板内,于37 ℃,相对体积分数为0.05的CO2培养箱中进行培养。每隔3 d以Neurobasal-A/B27完全培养基半量换液。(2)原代神经细胞鉴定,神经细胞培养至第7天时,用小鼠抗NeuN抗体(1∶50)及兔抗GFAP抗体(1∶200),对原代神经细胞进行标记,以含有Cy3(红光)标记的抗小鼠IgG和488(绿光)标记的抗兔IgG进行染色,置于荧光倒置显微镜下观察,采集图片,计数10个视野内NeuN阳性及GFAP阳性细胞个数,计算原代神经细胞的纯度。
1.2.2 AβOs的制备与鉴定 (1)AβOs的制备,按文献[12]中方法进行制备。固体Aβ1-42多肽溶于六氟异丙醇(1,1,1,3,3,3-hexafluoro-2-propanol)中,风干后于-80 ℃保存。用前以DMSO和不含酚红的DMEM-F12培养基稀释,5 ℃孵育24 h,14 000 g冷冻离心10 min,取上清备用。(2)AβOs的鉴定,采用蛋白印迹法,将制备好的AβOs与含还原剂的上样缓冲液混合后,70 ℃加热10 min,以4%~12%的Bis-Tris预制胶电泳,孔径0.22 μm的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜转膜,封闭2 h,小鼠抗Aβ 6E10抗体(1∶1 000)4 ℃孵育过夜,辣根过氧化酶标记的抗小鼠IgG二抗孵育1 h,ECL发光试剂观察表达情况。
1.2.3 细胞处理与指标检测 原代培养神经细胞接种至培养板培养10 d后,去B27培养2 h,加入不同浓度的AβOs(0.25、0.5、1及10 μmol/L)处理48 h后,进行如下检测。(1)细胞毒性试验,采用CCK-8法检测细胞毒性。原代培养神经细胞以1×104个/孔浓度接种于96孔板中,不同浓度AβOs处理细胞,每个浓度设5个复孔,培养至计划时间后,将每孔原始培养基取出,置换为不含血清及AβOs的纯培养基100 μL,空白对照组加入100 μL无细胞纯培养基,于每孔中加入10 μL CCK-8试剂,37 ℃孵育2 h,450 nm波长测定吸光度[13]。(2)ERK1/2(p44/42)、JNK及p38 MAPK信号通路蛋白磷酸化水平的检测蛋白印迹方法同前,用含有蛋白酶及磷酸酶抑制剂的裂解液冰上裂解细胞,提取细胞总蛋白,并测定蛋白浓度,电泳后,转至0.45 μm孔径的PVDF膜。封闭2 h,兔抗phospho-p44/42 MAPK(1∶1 000)、抗phospho-JNK MAPK(1∶1 000)、抗phospho-p38 MAPK(1∶1 000)抗体及兔抗p44/42 MAPK(1∶2 000)、抗JNK MAPK(1∶1 000)、抗p38 MAPK(1∶1 000)抗体4 ℃孵育过夜,辣根过氧化酶标记的抗兔IgG(1∶5 000)孵育1 h,曝光方法同前,结果以β-actin蛋白条带灰度值分别对phospho-p44/42、phospho-JNK、phospho-p38及总p44/42、总JNK、总p38进行校准,得到的phospho-p44/42、phospho-JNK、phospho-p38校准值再与总p44/42、总JNK、总p38的校准值相比,以所得比值统计比较实验组与对照组蛋白磷酸化水平差异。
1.3 统计学处理
2 结果
2.1 原代培养大鼠海马神经细胞纯度鉴定
原代培养新生大鼠海马神经细胞相差显微镜下图像如图1A所示,经NeuN和GFAP免疫荧光染色后,可见NeuN阳性细胞,即神经细胞;激发后,细胞核显红色荧光(图1B);GFAP阳性细胞,即星形胶质细胞,激发后,胞质显绿色荧光,胞核无色透明(图1C);未加抗体的阴性对照未观察到荧光(图1D)。计数统计后,神经细胞纯度达到85%左右(图1E)。
2.2 蛋白印迹方法鉴定Aβ1-42寡聚体
如图2所示,Aβ1-42经上述方法制备出多种寡聚体(二聚体、三聚体、四聚体、九聚体、十二聚体等),同时,亦可见部分未聚合单体(4 kDa)存在。
2.3 AβOs细胞毒性试验
CCK-8试验结果显示(图3),0.25、0.5、1及10 μmol/L AβOs分别作用于原代培养神经细胞48 h后,可见在1和10 μmol/L浓度作用下,神经细胞存活率分别下降70%和50%,与未加AβOs组(Con组)相比,均具有统计学意义(P<0.05和P<0.01)。
2.4 AβOs对ERK1/2、JNK及p38 MAPK信号通路蛋白活化水平的影响
不同浓度AβOs(0.25、0.5、1和10 μmol/L)处理原代培养神经细胞48 h后,发现在0.25和0.5 μmol/L AβOs作用下,phospho-ERK1/2(图4A)和phospho-JNK(图4B)蛋白表达水平均有升高趋势,并分别在0.5 μmol/L和0.25 μmol/L时,
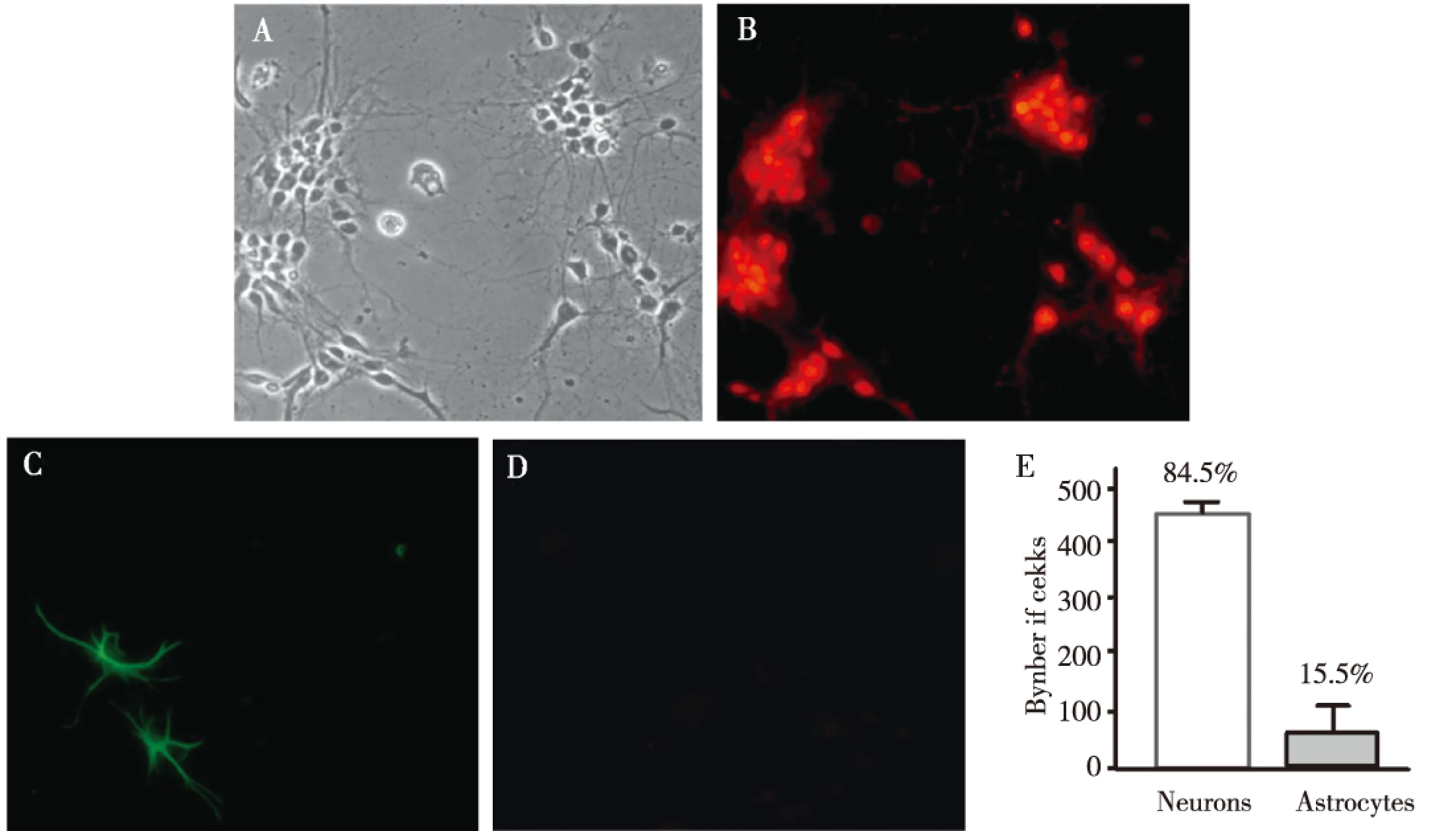
注:A为相差显微镜结果,B为NeuN染色,C为GFAP染色,D为只加二抗的对照结果,E为神经细胞与星型胶质细胞比例结果图1 原代培养大鼠海马神经元免疫荧光染色(×200)Fig.1 Immunostaining of primary cultured neurons from the hippocampus of rat brains

图2 Aβ1-42寡聚体蛋白水平Fig.2 The protein level of Oligomers of Aβ1-42
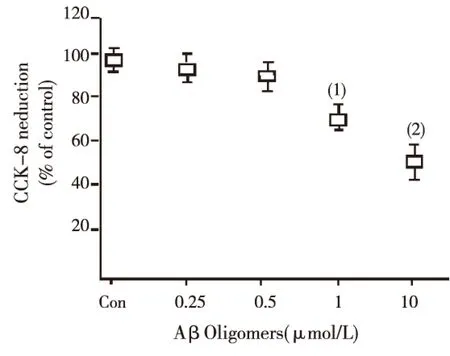
与Con组比较,(1)P<0.05;(2)P<0.01图3 AβOs对原代神经细胞存活率的影响Fig.3 Effect of AβOs on the survival rate of primary neurons
出现明显差异,与对照组(Con)相比,有统计学意义(P<0.05或P<0.01),而在1和10 μmol/L时,phospho-ERK1/2和phospho-JNK蛋白表达水平均明显降低(P<0.05或P<0.01),总ERK1/2及总JNK蛋白表达水平无明显变化;而phospho-p38(图4C)蛋白表达水平与AβOs作用浓度呈负相关,从0.5 μmol/L开始出现明显差异(P<0.05),同时,总p38蛋白表达水平也有下降趋势。

与Con组比较,(1)P<0.05,(2)P<0.01图4 原代培养神经细胞phospho-ERK1/2、phospho-JNK和phospho-p38蛋白表达Fig.4 The protein level of phospho-ERK1/2, phospho-JNK and phospho-p38 in primary cultured neurons
3 讨论
在AD的致病机制中,“淀粉样级联”假说认为APP的异常代谢是引起Aβ堆积,老年斑形成等毒性作用的主要原因[1],最初普遍认为老年斑中仅仅是不可溶的纤维状Aβ有神经毒性作用,然而随后的研究发现APP转基因小鼠的认知功能异常、神经元及突触功能和结构改变出现在淀粉样斑块形成之前[14-15]。并且大量研究结果均提示,多种Aβ1-42寡聚体与非神经元及神经元细胞膜上的多种成分,包括脂类、离子通道、受体等相结合引起一系列复杂的突触、神经元和神经元网络功能及结构的异常,导致学习、记忆等行为异常[16-18]。所以,目前普遍认为,Aβ单体以及构成老年斑的Aβ纤丝体并不是造成神经毒性的主要Aβ形式,而可溶性寡聚Aβ才是产生神经毒性的主要Aβ形式。越来越多的研究证实人和转基因小鼠的大脑组织中至少可以产生4种可以改变神经元和认知功能的可溶性Aβ寡聚体分子:二聚体、三聚体、Aβ*56和环状原纤维,综合目前的研究结果推测,这些寡聚体可能激活特定的信号通路,对神经元突触产生不同的毒性作用[19]。多项研究显示,MAPK可通过多种机制参与AD的发病过程。已知Aβ42的聚合可诱导小胶质细胞活化,产生活性氧和前炎症因子,如肿瘤坏死因子-α和白介素-1β等,二者均可刺激MAPK通路。同时,ERK信号通路与记忆功能有关,并可被Aβ活化[20]。有海马薄片培养结果显示,AβO(1-42)短时间作用不会活化JNK MAPK通路,而长时间作用可以活化JNK MAPK通路,同时,下调ERK MAPK通路[21]。 还有研究认为,p38 MAPK和ERK1/2有介导神经细胞内吞Aβ1-42的作用,提示MAPK信号通路抑制剂可能通过降低大脑Aβ水平,成为AD的潜在治疗靶标[22]。不少实验结果为Aβ与MAPK信号通路之间的相互作用提供了证据,有趣的是,这些实验得到的结果却并不一致,例如,Aβ对ERK MAPK信号通路的作用有时是活化,有时却是抑制的。
为了进一步明确二者之间的关系,本实验以不同浓度AβOs作用于大鼠原代培养海马神经细胞,发现无细胞毒性作用浓度的AβOs,可活化ERK1/2和JNK(P<0.05和P<0.01),而在有细胞毒性作用浓度时,可抑制ERK1/2和JNK的活化(P<0.05和P<0.01),同时,各浓度AβOs对总ERK1/2及总JNK蛋白表达水平无明显改变;另外,还发现p38的活化水平与AβOs作用浓度呈负相关,同时,总p38蛋白表达水平在AβOs作用下也有下降趋势。以上结果提示,AβOs与MAPK信号通路各种激酶之间的作用可因AβOs的作用浓度不同而出现差异,为我们以后选择该通路作为治疗靶标提供了参考。
[1] Reichman WE, Rose NS. History and experience: the direction of Alzheimer’s disease[J]. Menopause, 2012 (7): 724-734.
[2] Haass C, Selkoe DJ. Cellular processing of beta-amyloid precursor protein and the genesis of amyloid beta-peptide[J]. Cell, 1993(6): 1039-1042.
[3] Haass C, Selkoe DJ. Soluble protein oligomers in neurodegeneration: lessons from the Alzheimers amyloid beta-peptide[J] . Nat Rev Mol Cell Biol, 2007(1):101-112.
[4] Barthet G, Georgakopoulos A, Robakis NK. Cellular mechanisms of gamma-secretase substrate selection, processing and toxicity[J]. Prog Neurobiol, 2012(3): 166-175.
[5] Morroni F, Sita G, Tarozzi A, et al. Early effects of Aβ1-42 oligomers injection in mice: Involvement of PI3K/Akt/GSK3 and MAPK/ERK1/2 pathways[J]. Behav Brain Res, 2016(314):106-115.
[6] Cimino M, Gelosap, Gianella A, et al. Statins: multiple mechanisms of action in the is chemic brain[J]. Neuro scietist, 2007 (3): 208-213.
[7] Hoozemans JJ , Veerhui SR, Rozemuller, et al. Neuro inflammation and regeneration in the early stages of Alzheimer's disease pathology[J]. Int J Dev Neurosci, 2006(23): 157-165.
[8] Faucher P, Mons N, Micheau J, et al. Hippocampal Injections of Oligomeric Amyloid β-peptide (1-42) Induce Selective Working Memory Deficits and Long-lasting Alterations of ERK Signaling Pathway[J]. Front Aging Neurosci, 2016(7): 245.
[9] Birnbaum JH, Bali J, Rajendran L, et al. Calcium flux-independent NMDA receptor activity is required for Aβ oligomer-induced synaptic loss[J]. Cell Death Dis, 2015(6): e1791.
[10]Won JS, Im YB, Khan M, et al. Lovastatin inhibits amyloid precursor protein (APP) beta cleavage through reduction of APP distribution in Lub rol WX extractable low density lipid rafts [J]. J Neurochem. 2008(4): 1536-1549.
[11]Hosaka A, Araki W, Oda A, et al. Statins reduce amyloid β-peptide production by modulating amyloid precursor protein maturation and phosphorylation through a cholesterol-independent mechanism in cultured neurons[J]. Neurochem Res, 2013(3):589-600.
[12]Caccamo A, Oddo S , Billings LM, et al. M1 receptors play a central role in modulating AD like pathology in transgenic mice [J]. Neuron, 2006(5): 671-682.
[13]Fukuda T, Takeda S, Xu R, et al. Sema3A regulates bone-mass accrual through sensory innervations[J]. Nature, 2013(4): 490-493.
[14]Kemppainen S, Hämäläinen E, Miettinen PO, et al. Behavioral and neuropathological consequences of transient global ischemia in APP/PS1 Alzheimer model mice[J]. Behav Brain Res, 2014(1):15-26.
[15]Mucke L, Masliah E, Yu Q, et al. High-level neuronal expression of Aβ1-42 in wild-type human amyloid protein precursor transgenic mice: synaptotoxicity without plaque formation[J]. Neuroscience, 2000(11): 4050-4058.
[16]Selkoe DJ. Soluble oligomers of the amyloid β-protein mpair synaptic plasticity and behavior[J]. Behav Brain Res, 2008(1): 106-113.
[17]Yankner BA, Lu T. Amyloid β-protein toxicity and the pathogenesis of Alzheimer disease[J]. Biol Chem, 2009(8): 4755-4759.
[18]Mucke L, Selkoe DJ. Neurotoxicity of amyloid β-protein: synaptic and network dysfunction[J]. Cold Spring Harb Perspect Med, 2012(7):338.
[19]Megan E, Larson, Sylvain E, et al. Soluble Aβ oligomer production and toxicity[J]. J Neuchem, 2012 (1): 125-139.
[20]Nagai T, Kamei H, Dohniwa M, et al. Involvement of hippocampal extracellular signal-regulated kinase1/2 in spatial working memory in rats[J]. Neuro report, 2006(8): 1453-1457.
[21]Bell KA, O'Riordan KJ, Sweatt JD, et al. MAPK recruitment by beta-amyloid in organotypic hippocampal slice cultures depends on physical state and exposure time[J]. J Neurochem, 2004(2):349-361.
[22]Yang WN, Ma KG, Qian YH, et al. Mitogen-activated protein kinase signaling pathways promote low-density lipoprotein receptor-related protein 1-mediated internalization of beta-amyloid protein in primary cortical neurons[J]. Int J Biochem Cell Biol, 2015(6):252-264.
(2016-10-28收稿,2016-12-05修回)
中文编辑: 刘 平; 英文编辑: 刘 华
Influence of β-amyloid Peptide Oligomers on Mitogen-activated Protein Kinases in Rat Hippocampal Primary Cultured Neuron
ZHAO Liang1,2, GUAN Zhizhong2,3,4
(1.DepartmentofMicrobiology,GuizhouMedicalUniversity,Guiyang550025,Guizhou,China; 2.DepartmentofPathology,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 3.KeyLaboratoryofEndemicandEthnicDiseases,GuizhouMedicalUniversity,MinistryofEducation,Guiyang550004,Guizhou,China; 4.KeyLaboratoryofMedicalMolecularBiology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
Objective: To investigate the influence of β-Amyloid peptide oligomers (AβOs) on mitogen-activated protein kinases (MARK) signal transduction pathways in primary cultured rat hippocampal neuron. Methods: The primary cultured neurons were isolated, and their purity was checked by immunostaining methods. The AβOs were prepared and identified. The primary cultured neurons were exposed to AβOs at different concentrations(0.25, 0.5, 1 and 10 μmol/L)for 48 h and the survival rate of cells was detected by CCK-8 test. Western blotting was adopted to detect total protein expression level of extracellular signal regulated protein kinase(ERK), c-Jun N-terminal kinase (JNK) and p38. Results: The results of immunostaining showed that the purity of primary cultured neurons was more than 85%. AβOs at the concentration of less than 0.5 μmol/L had no obvious toxic effect on primary cultured neurons, but prompted the protein expression increase of phospho-ERK1/2 and phospho-JNK. AβOs at the concentration ≥1.0 μmol/L had obvious toxic effect on primary cultured neurons and prompted the protein expression decrease of phospho-ERK1/2 and phospho-JNK, but had no obvious effect protein expression levels of pan-ERK1/2 and pan-JNK. The protein expression levels of phospho-p38 and pan-p38 were negatively correlated to AβOs concentration. Conclusions: The influence of AβOs on MAPK signaling pathway may be different according to different concentration of AβOs.
Alzheimer's disease; β-amyloid peptide oligomers; mitogen-activated protein kinases; primary cultured neurons
国家自然科学基金(81260173); 教育部“长江学者和创新团队发展计划资助”(IRT13058); 贵州省科技计划[黔科合重大专项字(2014)6008号]; 贵州省创新计划项目[黔教合协同创新中心(2014)06]
时间:2016-12-15
http://www.cnki.net/kcms/detail/52.1164.R.20161215.1534.024.html
R749.16; R34-33
A
1000-2707(2016)12-1365-05
10.19367/j.cnki.1000-2707.2016.12.001
**通信作者 E-mail:1457658298@qq.com

