两种方法治疗第一、二肝门旁小肝癌的疗效及影响因素分析
陈 勇,陈祖舜,袁卫平
(广西医科大学附属肿瘤医院肝胆外科,南宁 530000)
两种方法治疗第一、二肝门旁小肝癌的疗效及影响因素分析
陈 勇,陈祖舜,袁卫平
(广西医科大学附属肿瘤医院肝胆外科,南宁 530000)
目的 探讨第一、二肝门旁原发性小肝癌在B超引导下行经皮肝穿刺射频(PRFA)联合治疗的疗效及影响因素。方法 回顾性分析该院2008年1月至2012年6月肿瘤位于第一或第二肝门旁、≤5cm、临床或病理证实为原发性肝癌行PRFA联合经肝动脉化疗栓塞术(TACE)或无水酒精注射术(PEI)治疗的60例患者的资料。对患者术后疗效进行随访,对预后影响因素进行单因素及Cox模型多因素分析。结果 76.7%患者术后天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)明显升高,所有患者术后胆红素均未见明显升高,均无胆管狭窄、胆漏、肝脓肿,肝内出血等严重并发症出现。甲胎蛋白(AFP)阳性患者转阴率为72.1%。术后1个月复查CT/MRI得到第一、二肝门旁肿瘤完全消融率为91.8%(56/61);术后1、3、5年无瘤生存率为81.7%、46.7%和33.3%;术后1、2、3、5年生存率为91.7%、80.0%、61.7%和34.9%;Cox模型多因素分析提示对患者术后生存率有影响的独立因素为肝功能Child-Pugh分级、是否联合TACE治疗、肿瘤数目、肿瘤直径。结论B超引导下行PRFA联合TACE或PEI治疗第一、二肝门旁小肝癌是可行且疗效确切的治疗方案。
小肝癌;肝门旁;导管消融术;经肝动脉化疗栓塞术;无水酒精注射术
原发性肝癌是世界上最常见的恶性肿瘤之一,具有病死率高、进展快、易复发等特点。虽然手术切除已作为肝癌治疗的金标准,但临床上仅有5%~20%的患者具备手术切除治愈的可能[1]。射频消融自20世纪90年代后期应用于临床以来,经过10多年的发展,以创伤小、效果确切、并发症少、易于操作等优势,已成为非手术治疗肝癌的重要手段之一,尤其在治疗小肝癌上,其远期疗效能与手术治疗相媲美[2]。对于第一、二肝门旁的小肝癌,肿瘤位于肝脏中央部位,手术切除难度大、创伤大、肿瘤切缘近、复发率高、预后较差。目前临床上常采用经皮肝穿刺射频(PRFA)治疗作为主要的治疗手段,但由于其位置特殊,大血管纵横交错且有胆管伴行,使术中风险、术后并发症、术后肿瘤残留率、复发率都较其他部位肿瘤要更高。笔者就本院2008年1月至2012年6月在B超引导下行PRFA联合经肝动脉化疗栓塞术(TACE)或无水酒精注射术(PEI)治疗的60例第一、二肝门旁小肝癌患者的治疗情况进行讨论分析,相关结果报道如下。
1 资料与方法
1.1 一般资料 收集本院2008年1月至2012年6月在B超引导下行PRFA联合治疗肝门旁小肝癌患者60例。选入标准:(1)经临床影像学或病理检查证实为原发性肝癌,且无远处脏器转移;(2)肝门旁肿瘤定义为离第一或第二肝门区大血管(门静脉、肝静脉或下腔静脉)距离小于或等于1cm的病灶;(3)多发肿瘤患者,肿瘤数目小于或等于3个且最大直径小于或等于5cm。其中复发患者24例,无手术史患者36例;男53例,女7例;年龄30~78岁,平均49.87岁;44例患者有肝炎病史,36例患者有肝硬化;33例患者为单发肿瘤,24例患者有2个肿瘤,3例患者有3个肿瘤,其中1例患者第一、二肝门旁各1个肿瘤,其余患者肝门旁均只有1个肿瘤。总共有病灶90个,肝门旁病灶61个,其中21个病灶位于第一肝门旁,40个病灶位于第二肝门旁;肝门旁病灶直径1.2~5.0cm,平均2.966cm,≤3cm的32个,>3cm的29个。术前甲胎蛋白(AFP)阴性(≤20ng/mL)患者17例,阳性(>20ng/mL)患者43例;32例患者术前联合TACE治疗,26例患者术中或术后联合PEI治疗,2例单纯PRFA治疗。术前41例患者肝功能Child-Pugh分级为A级,19例患者为B级,其中1例术前肝功能为B级患者,入院时肝功能为C级,经护肝、补充清蛋白等支持治疗后,肝功能改善为B级。
1.2 设备 日立二郎神彩超HIVISIONAvius:美国GELOGIQ9超声仪;美国Valley公司生产Cool-tipTM系统,单束ACT2020、ACT2030射频针,最大输出功率200W,单次消融3~5cm,每次自动消融12min。
1.3 方法 根据患者彩超、CT或MRI检查提示,评估患者病灶的大小、位置、毗邻关系、穿刺路径,而决定患者的具体的治疗方案。(1)对于肿瘤较小,血供不丰富,与周围血管毗邻关系良好,术前评估行单纯射频治疗可完全消融的患者,术前未联合TACE治疗:在B超引导下,经导向器定位,尽量将电极针与血管保持平行或交错进针,并靠近血管一侧远离胆管一侧,避免直接损伤血管或胆管,并在消融范围确保安全的条件下尽量靠近血管壁一侧,以便能够完全消融肿瘤。依次开动冷循环泵和射频治疗仪,保持针尖温度在20 ℃左右,功率在150~100W,循环泵的流量80mL/min,自动射频消融12min,术中B超随时探查消融范围情况。根据肿瘤大小、位置及术中B超探查消融范围情况,可调整射频针位置进行分层多点叠合消融,以达到消融范围覆盖肿瘤外5mm以上。治疗结束时,针道加热至80~90 ℃,维持10s,烧灼针道。(2)对于肿瘤较大且血供丰富的患者,术前1~2周联合TACE治疗:局部麻醉下,取右股动脉穿刺点,穿刺成功,置动脉鞘,将肝导管置入腹腔干先行肝右动脉造影,根据术中造影情况,选用常规导管或微导管经肝动脉至肿瘤供血血管,予洛铂或顺铂行灌注化疗,碘化油混合乳剂2~20mL行血管栓塞。(3)对于肿瘤与血管或胆管紧密相邻,术前评估在确保安全性的前提下肿瘤难以完全消融或术后复查彩超/超声造影(CEUS)发现病灶残留的患者,术后行PEI补充治疗:在B超引导下择点定位,2%利多卡因局部麻醉,通过5.0MHz凸阵穿刺探头引导,用18G×20CM穿刺针,注射无水酒精4~15mL,后退针至近肝表面处予2%利多卡因局部麻醉1mL封闭后拔针。隔日复查B超,可选择行多次PEI补充治疗。典型案例见图1~3。
1.4 术后临床观察及检查 术后常规饮食,心电监测4h,卧床6h以上。观察患者是否出现术后并发症。术后复查血常规、肝肾功能、AFP。术后48h行彩超/CEUS检查,评估是否仍有残留病灶。

A:术前CT动脉期;B:术前CT静脉期。
图1 下腔静脉及肝右静脉旁肿瘤射频术前CT检查
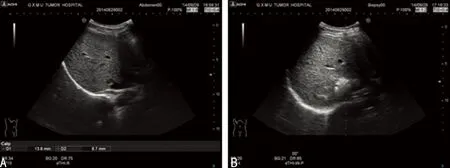
A:术前B超探查;B:术后B超探查。
图2 射频术前、术后B超探查对比

图3 射频术后1个月复查CT
1.5 术后随访 术后定期复查及随访,监测患者血清AFP水平、射频灶变化及射频相关的远期并发症。根据欧洲肝病治疗研究组织(EASL)的标准,术后1个月复查CT/MRI检查,评估肿瘤是否完全坏死[3]。以术后复查CT/MRI发现局部复发或肝内新发病灶为射频术后复发。
1.6 统计学处理 应用统计软件SPSS11.0计算第一、二肝门旁病灶的完全坏死率及射频术后1、3、5年的无瘤生存率;以射频术后至死亡日期或最后一次随访日期为截止日期,以月为单位计算患者1、2、3、5年的生存率;根据相关报道及本科经验筛选可能影响预后的12项因素,采用Kaplan-Meier法和Log-rank检验对各项因素进行单因素分析,对具有统计学意义的因素采用Cox模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 术后疗效观察 1例术前肝功能Child-PughB级患者术后肝功能降至C级,考虑其入院时肝功能为Child-PughC级,肝硬化严重,耐受能力较差所致,其余患者肝功能均未见明显变化。46例(76.7%)患者术后出现天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)明显升高,所有患者术后胆红素均未见明显升高,均无胆管狭窄、胆漏、肝脓肿,肝内出血等严重并发症出现。19例(31.7%)患者术后出现发热症状,27例(45.0%)患者术后有局部疼痛症状,5例(8.3%)患者术后有恶心、呕吐症状,1例(1.7%)患者术后出现呃逆,经对症支持治疗3~5d后,症状均明显好转。术后复查彩超/CEUS,发现7例患者有病灶残留,经1~5次PEI补充治疗后,复查B超/CEUS均未见残留灶。
2.2 随访结果 60例患者术后均定期复查及随访,随访截止日期为2015年8月,生存时间为6~83个月,中位生存时间为41.5个月。72.1%(31/43)患者AFP转阴,9例(20.9%)患者AFP明显降低,3例(7.0%)患者AFP无明显变化或升高。术后1个月复查CT或MRI提示第一、二肝门旁61个病灶完全消融率为91.8%,其中第一肝门旁21个病灶的完全消融率为90.5%,第二肝门旁40个病灶的完全消融率为92.5%,差异无统计学意义(P>0.05),见表1。患者术后1、3、5年无瘤生存率为81.7%、46.7%和33.3%; 1、2、3、5年生存率为分别为91.7%、80.0%、61.7%、34.9%。
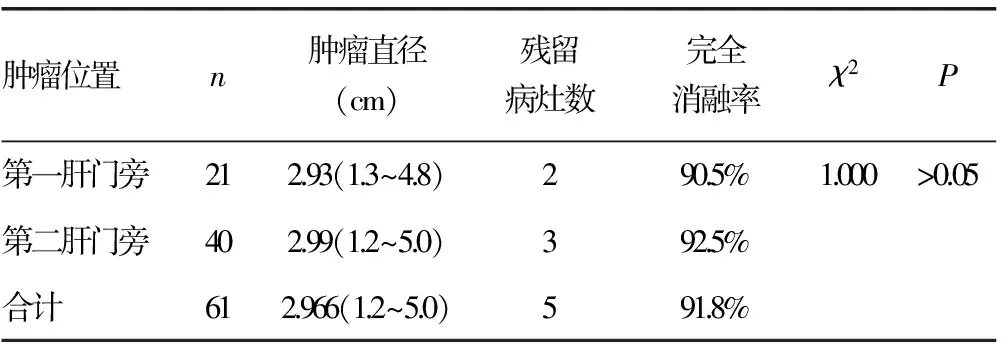
表1 第一、二肝门旁肿瘤消融情况
2.3 影响因素分析
2.3.1 单因素分析 性别、年龄、肿瘤位置、有无肝炎史等4项因素对生存期的无影响(P>0.05);而肝功能Child-Pugh分级、是否有肝硬化、术前AFP值、肿瘤数目、肿瘤直径、是否联合TACE治疗、是否联合PEI治疗、是否有手术史等8项因素对生存期有影响(P<0.05)。见表2。

表2 影响预后的单因素分析

续表2 影响预后的单因素分析
2.3.2 多因素分析 对单因素分析中有统计学意义的8项因素进行Cox模型多因素分析,结果提示:肿瘤直径、肿瘤数目、是否联合TACE治疗、肝功能Child-Pugh分级为影响预后的独立因素。见表3、图4。

表3 影响预后的多因素Cox模型回归变量表
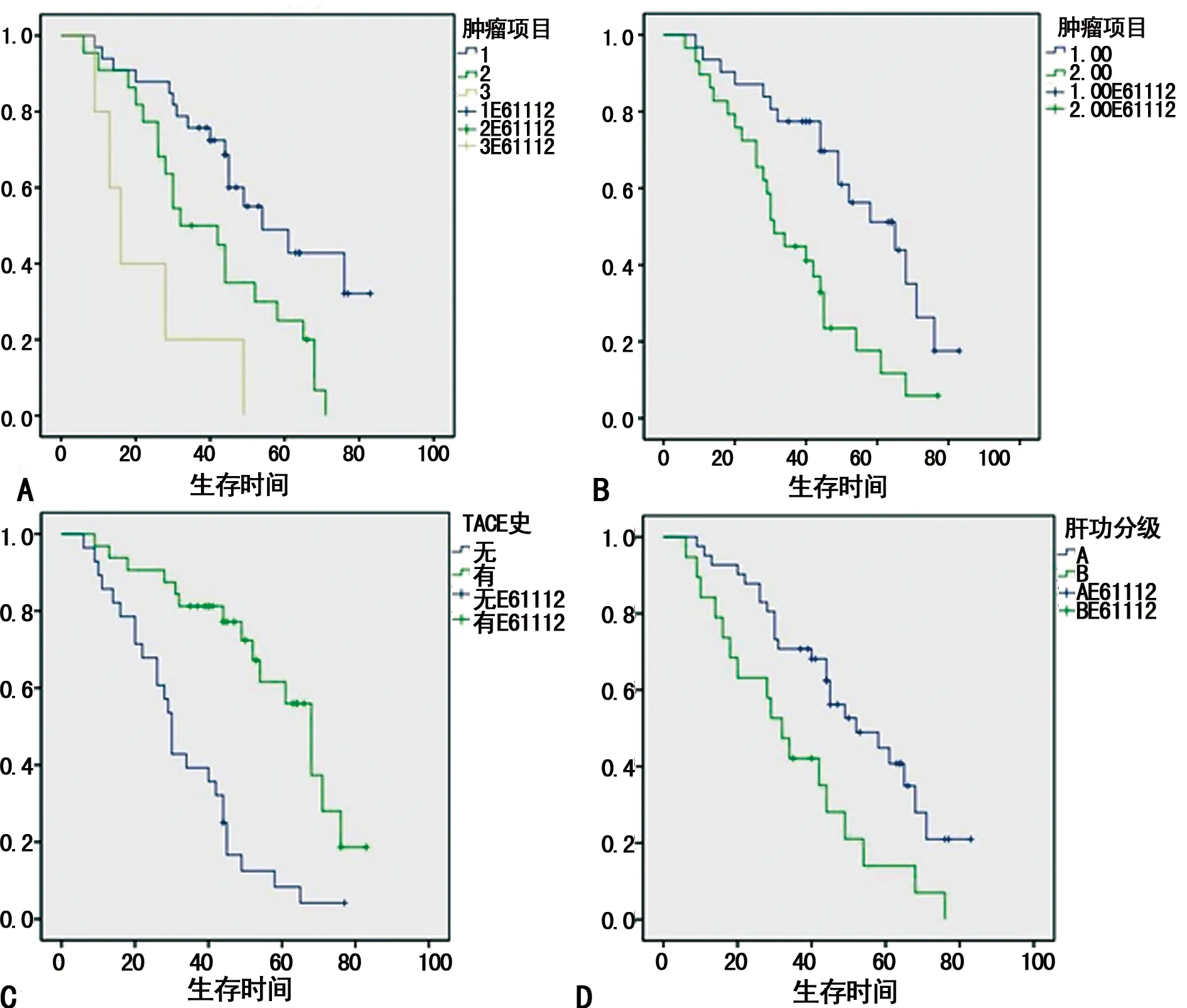
A:肿瘤数目;B:肿瘤直径;C:是否联合TACE;D:肝功能Child-Pugh分级。
图4 不同影响因素生存曲线
3 讨 论
射频消融是一种热凝固疗法,通过插入肿瘤组织的电极针尖端产生高频交流电,使局部温度高达90~120 ℃,高温使射频针周围肿瘤组织出现凝固性坏死,对于第一、二肝门旁靠近大血管或胆管的肿瘤,容易因为“热沉效应”而导致肿瘤消融不完全,或因为过于靠近胆管、血管而造成术后胆管狭窄、胆漏、肝内感染、肝内出血等严重并发症。相对于肝内其他部位的肿瘤,第一、二肝门旁肿瘤射频治疗的难度大、风险高。本组61个肿瘤第一、二肝门旁病灶经射频联合TACE或PEI治疗后的完全消融率为91.8%(56/61),且术后无严重并发症的发生,其疗效与报道[1,4]的肿瘤完全坏死率89.7%和90.9%相近。
对于第一、二肝门旁的病灶,笔者认为术前通过CT/MRI对病灶位置、大小、血供、毗邻关系的了解及术中进针路径的选择是至关重要的。在选针和布针方面,与钱超文等[5]学者的观点一致,采用冷循环系统单束针进行射频治疗。因为它是直线型、无需撑开,在B超引导下比较容易布针,消融范围较易控制,不易直接损伤血管、胆管,尤其对于肝门旁肿瘤具有一定的优势[6]。进针方向尽量与血管走行方向保持平行或交错,对于第一肝门旁病灶,因胆管内胆汁流速缓慢、热沉降效应弱易受热损伤,射频针进针方向应尽量靠近血管一侧远离胆管一侧。肿瘤较大者采用调整进针角度及分层多点叠合消融。操作过程中在保证消融的安全性和精确性前提下,扩大消融的安全范围,切勿为追求完全消融而过于靠近血管或胆管,造成血管、胆管的损伤。
对于肿瘤较大、血供丰富、多发病灶的患者,射频术前联合TACE治疗,通过栓塞肿瘤供血动脉及周边血管,减少RFA治疗过程中的热量流失,提高消融有效温度,温度升高条件下肿瘤细胞对化疗药物更加敏感,能够有效提高肿瘤的完全消融率,改善预后[7-10]。本组术前联合TACE治疗的32例患者的肝门旁肿瘤完全消融率为90.6%(29/32),与文献[11-12]报道的关于射频联合TACE治疗小于或等于5cm小肝癌完全消融率相近。
常规超声在评估射频术后病灶是否残留过程中,易受气体、体型、病灶部位的影响,不能准确判断肿瘤治疗后的坏死情况。据文献报道[13]CEUS对肝癌射频术后坏死情况的敏感性、特异性、准确性与增强CT一致,本组患者术后48h常规行CEUS,评估是否有病灶残留。根据报道[14-15],射频联合PEI治疗,能有效扩大肿瘤范围,提高肿瘤完全坏死率。本组患者中对于毗邻血管,术前评估难以完全消融的19个病灶及术后复查B超/CEUS发现有残留的7个病灶,行1~5次PEI补充治疗。联合PEI治疗的26个肝门旁病灶的完全消融率为88.5%(23/26),未联合PEI治疗的35个肝门旁病灶的完全消融率为94.5%(32/35),差异无统计学意义(P>0.05)。
本组60例患者的1、2、3、5年生存率为91.7%、80.0%、61.7%、34.9%与文献[16-18]学者报道的射频术后或手术治疗后生存率无明显差异。根据Yang等[18]报道的非特殊部位组和特殊部位组小肝癌射频术后1、3、5年无瘤生存率分别为88.2%、55.6%、36.3%和77.9%、49.0%、38.0%,差异无统计学意义(P>0.05),本组患者术后1、3、5年无瘤生存率分别为81.7%、46.7%、33.3%与其无瘤生存率无明显差异。通过对12项可能对预后有影响的因素进行单因素分析及Cox模型多因素分析,得出肿瘤直径、肿瘤数目、是否联合TACE治疗、肝功能Child-Pugh分级为影响术后生存率的独立因素。对于射频术后影响预后的独立因素方面,各学者的研究仍存在差异,本组研究得出的结果与学者[16,19]报道的独立影响因素稍有不同,而与Yang等[18]学者报道的独立影响因素相似,可能因各学者纳入研究的标准不一样有关。
笔者认为射频联合TACE或PEI治疗第一、二肝门旁小肝癌是可行且疗效确切的方法,其疗效与其他部位小肝癌射频治疗疗效无明显差异。但本组研究纳入病例数量较少,要得到准确的结论,尚需大量数据的验证。
[1]KelogrigorisM,LaspasF,KyrkouK,etal.Percutaneousradiofrequencyablationformalignantlivertumoursinchallenginglocations[J].JMedImagingRadiatOncol,2012,56(1):48-54.
[2]陈敏山,陈敏华.肝癌射频消融治疗规范的专家共识[J].临床肝胆病杂志,2011,27(3):236-238.
[3]GoldbergSN,GrassiCJ,CardellaJF,etal.Image-guidedtumorablation:standardizationofterminologyandreportingcriteria[J].Radiology,2005,235(3):728-739.
[4]SongI,RhimH,LimHK,etal.Percutaneousradiofrequencyablationofhepatocellularcarcinomaabuttingthediaphragmandgastrointestinaltractswiththeuseofartificialascites:safetyandtechnicalefficacyin143patients[J].EurRadiol,2009,19(11):2630-2640.
[5]钱超文,陈丽羽,陈俊英,等.部分特殊部位肝恶性肿瘤的超声引导下冷循环射频消融治疗[J].中华超声影像学杂志,2005,14(9):659-663.
[6]ChopraS,DoddGD,ChaninMP,etal.Radiofrequencyablationofhepatictumorsadjacenttothegallbladder:feasibilityandsafety[J].AJRAmJRoentgenol,2003,180(3):697-701.
[7]BloomstonM,BinitieO,FraijiE,etal.Transcatheterarterialchemoembolizationwithorwithoutradiofrequencyablationinthemanagementofpatientswithadvancedhepaticmalignancy[J].AmSurg,2002,68(9):827-831.
[8]GaspariniD,SponzaM,MarzioA,etal.Combinedtreatment,TACEandRFablation,inHCC:preliminaryresults[J].RadiolMed,2003,104(5/6):412-420.
[9]HoriguchiN,TakayamaH,ToyodaM,etal.Hepatocytegrowthfactorpromoteshepatocarcinogenesisthroughc-Metautocrineactivationandenhancedangiogenesisintransgenicmicetreatedwithdiethylnitrosamine[J].Oncogene,2002,21(12):1791-1799.
[10]KitamotoM,ImagawaM,YamadaH,etal.Radiofrequencyablationinthetreatmentofsmallhepatocellularcarcinomas:comparisonoftheradiofrequencyeffectwithandwithoutchemoembolization[J].AJRAmJRoentgenol,2003,181(4):997-1003.
[11]PengZW,ZhangYJ,ChenMS,etal.Radiofrequencyablationasfirst-linetreatmentforsmallsolitaryhepatocellularcarcinoma:long-termresults[J].EurJSurgOncol,2010,36(11):1054-1060.
[12]程洪涛,郭晨阳,黎海亮,等.TACE联合射频消融治疗原发性肝癌疗效的影响因素分析[J].介入放射学杂志,2012,21(3):216-219.
[13]MaruyamaH,YoshikawaM,YokosukaO.Currentroleofultrasoundforthemanagementofhepatocellularcarcinoma[J].WorldJGastroenterol,2008,14(11):1710-1719.
[14]AzabM,ZakiS,El-SheteyAG,etal.Radiofrequencyablationcombinedwithpercutaneousethanolinjectioninpatientswithhepatocellularcarcinoma[J].ArabJGastroenterol,2011,12(3):113-118.
[15]LinJW,LinCC,ChenWT,etal.Combiningradiofrequencyablationandethanolinjectionmayachievecomparablelong-termoutcomesinlargerhepatocellularcarcinoma(3.1-4cm)andinhigh-risklocations[J].KaohsiungJMedSci,2014,30(8):396-401.
[16]周乐杜,王志明,廖锦堂,等.射频消融治疗原发性肝癌的疗效及预后因素分析:附195例报告[J].中国普通外科杂志,2008,17(11):1112-1116.
[17]周铁,仇毓东,孔文韬,等.小肝癌射频消融与手术切除的疗效分析[J].肝胆外科杂志,2007,15(6):424-427.
[18]YangW,YanK,WuGX,etal.Radiofrequencyablationofhepatocellularcarcinomaindifficultlocations:Strategiesandlong-termoutcomes[J].WorldJGastroenterol,2015,21(5):1554-1566.
[19]罗敏,时美欣,张巍,等.影响肝细胞癌射频消融术后疗效的相关因素分析[J/CD].中华医学超声杂志(电子版),2015(6):453-461.
陈勇(1991-),在读硕士,主要从事肝胆外科工作。
�验交流·
10.3969/j.issn.1671-8348.2016.36.038
R
B
1671-8348(2016)36-5157-05
2016-07-08
2016-09-11)

