亚贡叶的化学成分分离与鉴定
白 珺,冉小库,窦德强,曾 峥
(1 辽宁中医药大学,辽宁 大连 116000;2 珍奥集团股份有限公司,辽宁 大连 116000)
亚贡叶的化学成分分离与鉴定
白 珺1,冉小库1,窦德强1,曾 峥2
(1 辽宁中医药大学,辽宁 大连 116000;2 珍奥集团股份有限公司,辽宁 大连 116000)
对亚贡叶中化学成分进行进一步分离研究,并对分离化合物进行结构鉴定和分析。通过采用ODS,硅胶柱色谱,凝胶柱色谱以及半制备色谱结合谱学数据鉴定的方法,对亚贡叶乙醇提取物进行分离。通过谱学鉴定,分离得到4个单体化合物,并将其分别确定为亚油酸乙酯(9E,12E)enyloctadeca-9,12-dienoate,ent-18-hydroxykautan-16-en-19-oic acid,Grandiflorolic acid和8β-methacryloxymelampolide-14-oic acid methyl ester。其中化合物亚油酸乙酯为首次从亚贡叶中分离得到。
亚贡叶;亚油酸乙酯;分离鉴定
亚贡Smallanthussonchifolius,又名Yacon,雅贡,又有别名雪莲果、菊薯、雪莲薯等。菊科属植物,属多年生草本[1],是南美药食两用植物之一[2]。不仅在缓解二型糖尿病方面,特别适合糖尿病人及减肥者食用,而且在包括肠道功能紊乱在内的多种慢性疾病以及消化道和循环系统疾病、结肠癌等治疗领域[3-5]都有着较为显著的治疗作用。亚贡原产地出于南美的安第斯地区,在诸多国家均得到了广泛的研究与开发[6],亚贡后也被引种到多国,包括日本、美国、新西兰和欧洲等等。除此之外,亚贡同时也在我国的云南省、台湾省、海南省、江苏省、辽宁省等地有大量种植,并已被成功引种[2],随着成功引进,对亚贡的相关研究也越来越多。亚贡叶也具有广泛的药理活性,具备降血糖、抗菌、抗癌作用等临床作用[7],对亚贡叶中的化学成分进行分离并鉴定,可为广泛利用及分析亚贡叶中的成分打下基础。
1 仪器与材料
BRUKER-ARX-500核磁共振波谱仪,德国Bruker;ODS,日本富吉;890/5975C气相色谱/质谱联用仪,美国Agilent公司;HITACHI7100制备型高效液相色谱仪,日本;Agilent 1260高效液相色谱仪,美国安捷伦Agilent科技公司;色谱柱(YMC-PackODS-A,5 μm,10 mm×250 mm,日本);柱色谱及TLC所用硅胶,青岛海洋化工厂;FA-1004电子天平,上海精科天平厂;旋转蒸发仪,予华仪器有限责任有限公司;DZF-6050真空干燥箱,上海一恒科技有限公司。
液相用甲醇(色谱纯级别),天津市大茂化学试剂厂;其它试剂为分析纯级别;亚贡叶于2012年采于辽宁省大连市开发区德胜镇,经辽宁中医药大学药学院康廷国教授鉴定,为菊科植物亚贡Smallanthussonichifolius的叶。
2 提取与分离
将干燥的亚贡叶(5.0 kg)粉碎至粗粉,用10倍量95%乙醇浸泡2 h,在60 ℃水浴下进行回流提取,过滤提取液,将剩余药渣再加入10倍量的95%乙醇提取,过滤,将两次滤液合并,用旋转蒸发仪,回收乙醇,旋至近干,置于真空干燥箱中进行干燥。上述提取所得干燥浸膏,用甲醇溶解,拌样采用100~200目硅胶,后进行分离,采用200~300目硅胶,梯度洗脱以二氯甲烷-甲醇作为洗脱剂,得到6个馏分,分别通过ODS和LH-20柱色谱以及半制备HPLC将馏分进行分离,最终从第1个馏分中分离得到化合物1,并将其波谱鉴定,从第3馏分中分离并鉴定得到化合物2和3,乙烷-甲醇洗脱,第2个馏分中分离并鉴定得到化合物4。
3 结构鉴定
3.1 化合物1
液体,无色油状。C20H36O2,在13C-NMR中,共给出20个碳信号数据,通过δ173.9可提示结构中含有1个羰基,δ130.23,130.07,128.07,127.94提示结构中含有4个烯碳原子,δ60.18,14.05提示机构中可能含有一个OCH2CH3,δ14.26提示结构中还含有另一个甲基。δ34.41,34.36,31.54,29.6,29.36,29.17,29.12,29.04,27.21,25.65,24.99,22.58则为剩余长脂肪链烃信号,经查阅文献[8]发现,化合物碳谱数据与亚油酸乙酯基本一致,因此初步判断化合物为亚油酸乙酯。信号归属如下:δ:173.9(C-1),130.23(C-9),130.07(C-10),128.07(C-12),127.94(C-13),60.18(C-1′),14.05(C-2′),22.58(C-17),14.26(C-18),δ24.99-34.41(C-2~C-8,C-11,C-14~C-16)。GC-MS,给出分子离子峰[M]+308.3,离子碎片峰279.3,263.3,245.2,220.2,195.2,178.2,150.1,123.1,95.1,67.1,41,数据库给出结果为亚油酸乙酯,结合碳谱数据最终确定化合物为亚油酸乙酯,结构如图1所示。

图1 化合物1结构
Fig.1 Structure of compound 1
3.2 化合物2
白色无定型粉粉末无色针晶ent-18-hydroxykauran-16-en-19-oic acid,13C-NMR共给出20个碳信号,δ179.8(19-C)为羰基碳信号,δ156.8(16-C),δ103.7(17-C)为末端双键碳特征信号。δ70.1(18-C)为连氧碳特征信号,推测为ent-kaurane类化合物。将化合物光谱数据与文献[9]对比发现二者基本完全一致,因此鉴定该化合物为已知化合物ent-18-hydroxy-kauran-16-en-19-oic acid。其NMR数据归属如下:13C-NMR(CD3OD):179.8(19-C),156.9(16-C),103.7(17-C),70.8(18-C),56.6(5-C),52.3(9-C),50.8(4-C),50.1(15-C),49.4(8-C),45.2(13-C),42.2(3-C),41.7(7-C),40.8(1-C),40.5(10-C),34.2(14-C),33.1(12-C),22.8(6-C),19.8(11-C),19.5(2-C),16.5(20-C)。结构如图2所示。

图2 化合物2结构
3.3 化合物3
无定型粉末,白色,13C-NMR数据中共给出20个碳信号,δ183.7(19-C)为羰基碳信号,160.3(16-C),106.3(17-C)为末端双键碳特征信号。82.8(15-C)为连氧碳特征信号,推测为ent-kaurane类化合物。将化合物光谱数据与文献[10]对比发现二者基本完全一致,因此鉴定该化合物为已知化合物ent-15β-hydroxy-kaur-16-en-19-oic acid(Grandiflorolic acid)。其NMR数据归属如下:13C-NMR(CDCl3):183.7(19-C),160.3(16-C),108.3(17-C),82.8(15-C),57.1(5-C),53.4(9-C),47.8(8-C),43.8(4-C),42.4(13-C),40.8(1-C),39.9(10-C),37.9(3-C),36.3(7-C),35.3(14-C),32.6(12-C),29.0(18-C),21.0(6-C),19.1(2-C),18.3(11-C),15.9(20-C)。结构如图3所示。

图3 化合物3结构
3.4 化合物4
白色粉末,C20H24O6,13C-NMR共给出3个羰基信号,化学位移值分别为169.54,167.43,166.08,给出8个烯碳信号,化学位移值分别为142.37,137.7,135.85,135.45,131.2,126.14,126.02,120.49,提示结构中含有4个双键,化学位移75.78,67.34,52.04,提示可能存在3个连氧碳信号,52.04证实可能含有一个甲氧基,由上述低场区信号推测该结构可能为倍半萜内酯类化合物,剩余高场碳信号为结构中其它甲基,亚甲基,次甲基信号化学位移值分别为49.78,37.15,30.24,25.69,18.29,17.02。经文献[11]检索,发现碳谱数据与化合物8β-methacryloxymelampolide-14-oic acid methyl ester基本相同,因此确定化合物结构为8β-methacryloxymelampolide-14-oic acid methyl ester,信号归属如下:142.37(1-C),25.69(C-2),37.15(C-3),137.7(C-4),126.02(C-5),75.78(C-6),49.78(C-7),67.34(C-8),30.24(C-9),131.2(C-10),135.45(C-11),169.54(C-12),120.49(C-13),167.43(C-14),17.02(C-15),166.08(C-1′),135.85(C-2′),18.29(C-4′),52.04(C-COOMe)。结构如图4所示。
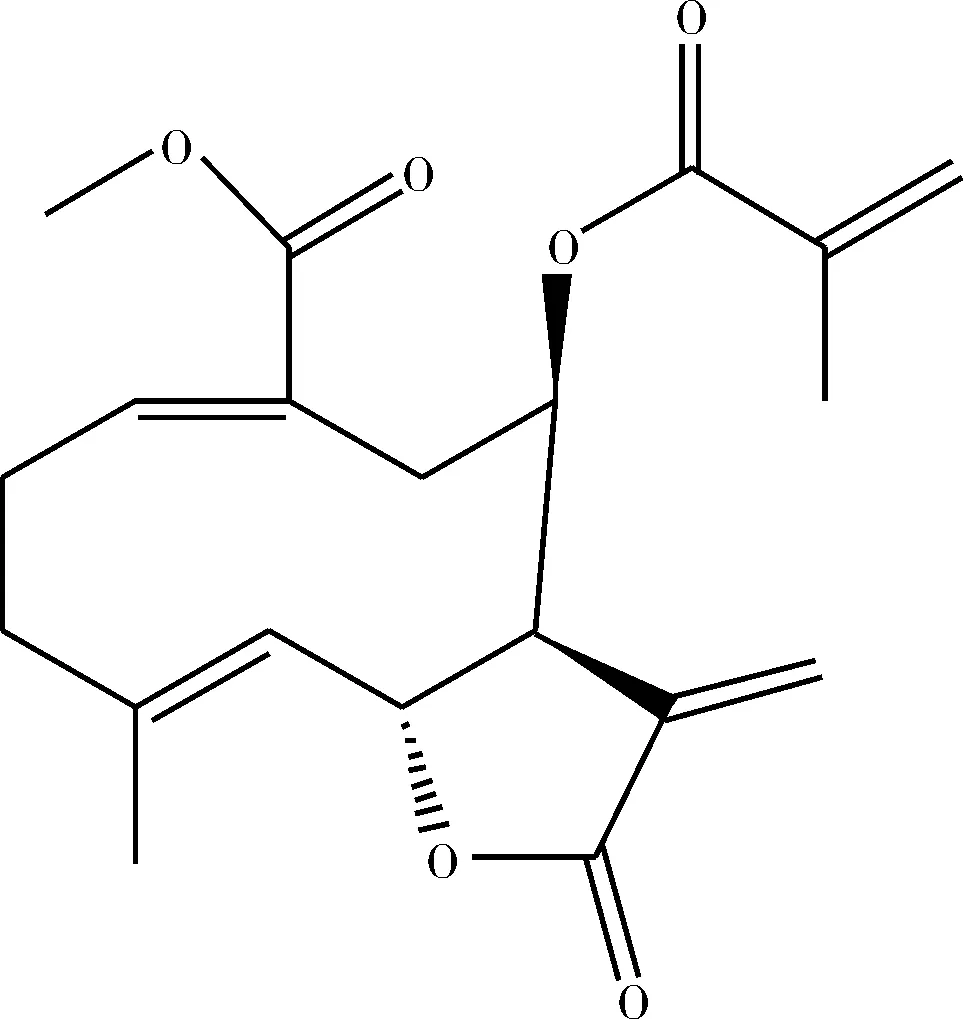
图4 化合物4结构
4 讨 论
采用回流提取法对亚贡叶化学成分进行了提取分离以及鉴定,乙醇作为提取溶媒,可以提取亚贡叶中的大部分小分子化学成分,为阐明亚贡叶的药效物质基础奠定了基础。通过硅胶柱色谱,以不同比例和溶剂组成的流动相进行反复的柱层析,最终确定以二氯甲烷-甲醇为流动相,通过分离将亚贡叶醇提物按照极性大小分为不同部位,继而采用反相ODS柱色谱以不同浓度甲醇-水为洗脱剂继续进行洗脱剂洗脱,采用LH-20柱色谱,联合半制备高效液相色谱仪等分离手段联合应用,分离得到了单体化合物,并通过采用化学和13C-NMR、GC-MS等波谱技术,对分离得到的化合物进行了结构解析。本研究对亚贡叶的化学成分进行了进一步的了解,也为后期亚贡叶的研究奠定基础。
5 结 论
采用硅胶柱色谱,ODS与凝胶柱色谱以及半制备色谱对亚贡叶乙醇提取物进行分离和纯化得到4个化合物,通过13C-NMR、GC-MS等谱学数据与文献进行对照分析,确定这些化合物分别是亚油酸乙酯(9E,12E)enyloctadeca-9,12-dienoate,ent-18-hydroxykautan-16-en-19-oic acid,Grandiflorolic acid。其中化合物1为首次从该植物中分离得到。
[2] 金文闻,余龙江,孟思进,等.亚贡的植物学及其药理作用研究概况[J].中草药,2006,37(4):633-636.
[3] 金文闻,余龙江,孟思进,等.亚贡植物学及药理作用研究概况[J].中草药,2006,37(4): 633-636.
[4] National Reaeach Council. Lost Crops of the Incas. Little- known Plants of the Andes with Promise for Worldwide Cultivation [M]. Washington DC: Natioml Academy Presa,1989.
[5] Grau A. Yacon: A high productive root crop [A].Newplants Dossier No.9 Crop & Food Reseath Institute Internal[C].
[6] Zeng S. Tissue culture and rapid propagation of Smallanthussonchifolius[J]. Plant PhysiolCommun, 2004,40(2):212.
[7] Valentova K, Cvak L, Muck A, et al. Antioxidant activity of extracts from the leaves of Smallanthussonchifolius[J]. European Journal of Nutrition, 2003, 42(1):61-6.
[8] Inoue A, Tamogami S, Kato H, et al. Antifungal melampolides from leaf extracts of Smallanthussonchifolius[J]. Phytochemistry, 1995, 39(4):845-848.
[9] 项峥,窦德强.亚贡叶的研究与开发[A].全国中药和天然药物学术研讨会[C],2011.
[10]Yamasaki K, Kohda H, Kobayashi T, et al. Structures of stevia diterpene-glucosides: Application of13C NMR[J]. Tetrahedron Letters, 1976, 17(13):1005-1008.
[11]Lin F, Hasegawa M, Kodama O. Purification and Identification of Antimicrobial Sesquiterpene Lactones from Yacon (Smallanthussonchifolius) Leaves(Organic Chemistry)[J]. Bioscience Biotechnology & Biochemistry, 2003, 67(10):2154-2159.
Isolation and Identification on the Chemical Components of Yacon Leaves
BAIJun1,RANXiao-ku1,DOUDe-qiang1,ZENGZheng2
(1Liaoning University of Traditional Chinese Medicine, Liaoning Dalian 116000; 2 Zhenao Group Co., Ltd., Liaoning Dalian 116000, China)
To research the chemical fractions from yacon leaves extract, separation and purify methods was applied to the extract of yacon leaves. Slica gel column, ODS, sephadex column chromatography and semi manufactured by high performance liquid chromatography were used to the research. Four compounds were obtained and identified as (9E,12E)enyloctadeca-9,12-dienoate(1),ent-18-hydroxykautan-16-en-19-oic acid(2), Grandiflorolic acid(3) and 8β-methacryloxymelampolide-14-oic acid methyl ester(4).Compound 1 was isolated from yacon leaves as the first time.
Smallanthussonchifolius; (9E,12E)enyloctadeca-9,12-dienoate; isolation and identification
R284.1
A
1001-9677(2016)023-0110-03

