黑龙江某牛场腹泻犊牛大肠杆菌致病株分离鉴定及耐药性和耐药基因检测
岳山,刘宇,2,刘通,周金玲,王华欣,赵静虎,何泊宁,刘珊珊,张世勋,王天,刘增禄,朱战波
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2黑龙江省兽医科学研究所)
黑龙江某牛场腹泻犊牛大肠杆菌致病株分离鉴定及耐药性和耐药基因检测
岳山1,刘宇1,2,刘通1,周金玲1,王华欣1,赵静虎1,何泊宁1,刘珊珊1,张世勋1,王天1,刘增禄1,朱战波1
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2黑龙江省兽医科学研究所)
为了解黑龙江省绥化市某规模化奶牛场腹泻犊牛大肠杆菌分离株的耐药性及耐药基因携带情况,在2016年4月,收集该牛场群发腹泻犊牛的8份粪便,通过细菌分离鉴定,生化实验等鉴定方法,确定牛群腹泻的病因为大肠杆菌感染。结果显示对氟苯尼考,多粘菌素B高度敏感,对青霉素具有较强的耐药性,耐药率达100%,其四环素、环丙沙星、恩诺沙星耐药率达75%;应用PCR方法检测大肠杆菌耐药基因,共检出5种耐药基因,分别为blaTEM、tetA、Sul2、aac(3)-Ⅱ、ParC。表明该牛场大肠杆菌分离株的耐药现象特别严重,提示该养殖场应合理使用抗生素。
犊牛;大肠杆菌;药敏试验;PCR;耐药基因
引起犊牛腹泻的病原较多,包括轮状病毒、冠状病毒、病毒性腹泻病毒、沙门氏菌、空肠弯曲菌、大肠杆菌等,大肠杆菌是常见的细菌性病原,可引起犊牛腹泻、泌乳牛乳房炎、犊牛或育成牛肠毒血症等。近几年来,随着养牛规模的扩大和集约化生产程度的提高,犊牛腹泻的发病率和死亡率也呈上升趋势[1],其中由致病性大肠杆菌引起的约占90%[2],给养殖场带来严重的经济损失。
大肠杆菌病的防治以抗生素治疗为主,临床常用青霉素、链霉素、氟苯尼考、环丙沙星等药物。随着抗生素的广泛使用,大肠杆菌耐药现象日益严重。目前,大肠杆菌超级菌株、食品中毒、广谱耐药等问题已经成为全球关注的热点,监测动物源大肠杆菌耐药性具有重要的公共卫生意义[3]。因此对牛源大肠杆菌耐药性的调查与耐药基因检测,了解牛场常用药物,对于预防和控制牛大肠杆菌病具有重要意义。
1 材料与方法
1.1 材料
1.1.1 病料
无菌采集腹泻粪样8份,并对其进行编号,然后放置-20℃保存待检。
1.1.2 培养基及试剂
营养肉汤、营养琼脂培养基、伊红美蓝培养基、麦康凯培养基(购自青岛高科园海博生物技术有限公司)、革兰氏染色液、Marker DL2000购自TaKaRa公司、TaqMasterMix购自康为世纪有限公司、革兰氏染色液安徽省巢湖市弘慈医疗器械有限公司、药敏质控菌株ATCC25922来自本实验室保存。生化管、药敏片购自杭州天和微生物试剂有限公司。细菌基因组DNA提取试剂盒购自天根生物技术公司。
1.1.3 引物设计
引入参考文献[4-8]进行设计引物(见表1),引物由上海生物工程有限公司合成。

表1 引物序列Table 1 peimer sequence
1.2 方法
1.2.1 细菌分离鉴定
用无菌接菌环沾取少量粪便在普通营养琼脂上进行划线37℃培养18 h后取出,挑取疑似大肠杆菌的菌落接种到麦康凯培养基上继续培养18 h,挑取麦康凯上的红色单菌落接种到伊红美蓝培养基上,37℃过夜培养,挑取伊红美蓝培养基上生成带黑色金属光泽的菌落进行营养琼脂平板纯化。
1.2.2 染色镜检
挑取纯化后普通营养琼脂平板上生成的单个菌落进行涂片染色镜检。
1.2.3 生化鉴定
镜检符合大肠杆菌形态特征的菌体采用肠杆菌科生化试验进行鉴定。
1.2.4 药敏实验及判定标准
应用K-B纸片扩散法进行药物敏感试验,判定标准参照美国实验室标准委员会(NCCLS)药敏纸片扩散法法规。并用药敏质控株ATCCA25922作为对照。
1.2.5 细菌基因组DNA的提取
参照细菌基因组DNA提取试剂盒说明书进行按步操作提取细菌DNA。
1.2.6 PCR反应体系及扩增条件
设置一个25 μL反应体系,上游引物1 μL,下游引物1 μL,DNA模板1 μL,TaqMasterMix 12.5 μL,去离子水9.5 μL;PCR扩增条件为95℃5 min,94℃30 s,55℃1 min,72℃1 min扩增30个循环,最后72℃延伸5 min。取PCR产物加于1.0%琼脂糖凝胶中,用凝胶成像系统中观察结果。
2 结果
2.1 细菌分离结果
在普通营养琼脂上生成灰白色菌落,在麦康凯培养基上生成红色菌落,在伊红美蓝培养基上生成带黑色金属光泽的菌落。
2.2染色镜检结果
镜检为革兰氏阴性菌,两端钝圆、短杆状、单个或成对存在。
2.3 生化鉴定
大肠杆菌能发酵葡萄糖、乳糖、麦芽糖、阿拉伯糖,部分菌株不分解蔗糖;靛基质实验、甲基红、MR试验阳性均为阳性;VP试验阴性;枸橼酸盐试验阴性,通过伯杰氏细菌鉴定手册[9],以上检测试验结果菌均符合大肠杆菌生化反应特性。
2.4 药敏实验结果
在分离到的8份大肠杆菌中,大肠杆菌除对多粘菌素B敏感外均呈现不同程度的耐药性,其中对青霉素全部耐药,对阿莫西林、氨苄西林、头孢唑林等耐药率高达87.5%,对链霉素、庆大霉素、四环素、环丙沙星、恩诺沙星、氧氟沙星的耐药率高达75%。其具体结果见表2。
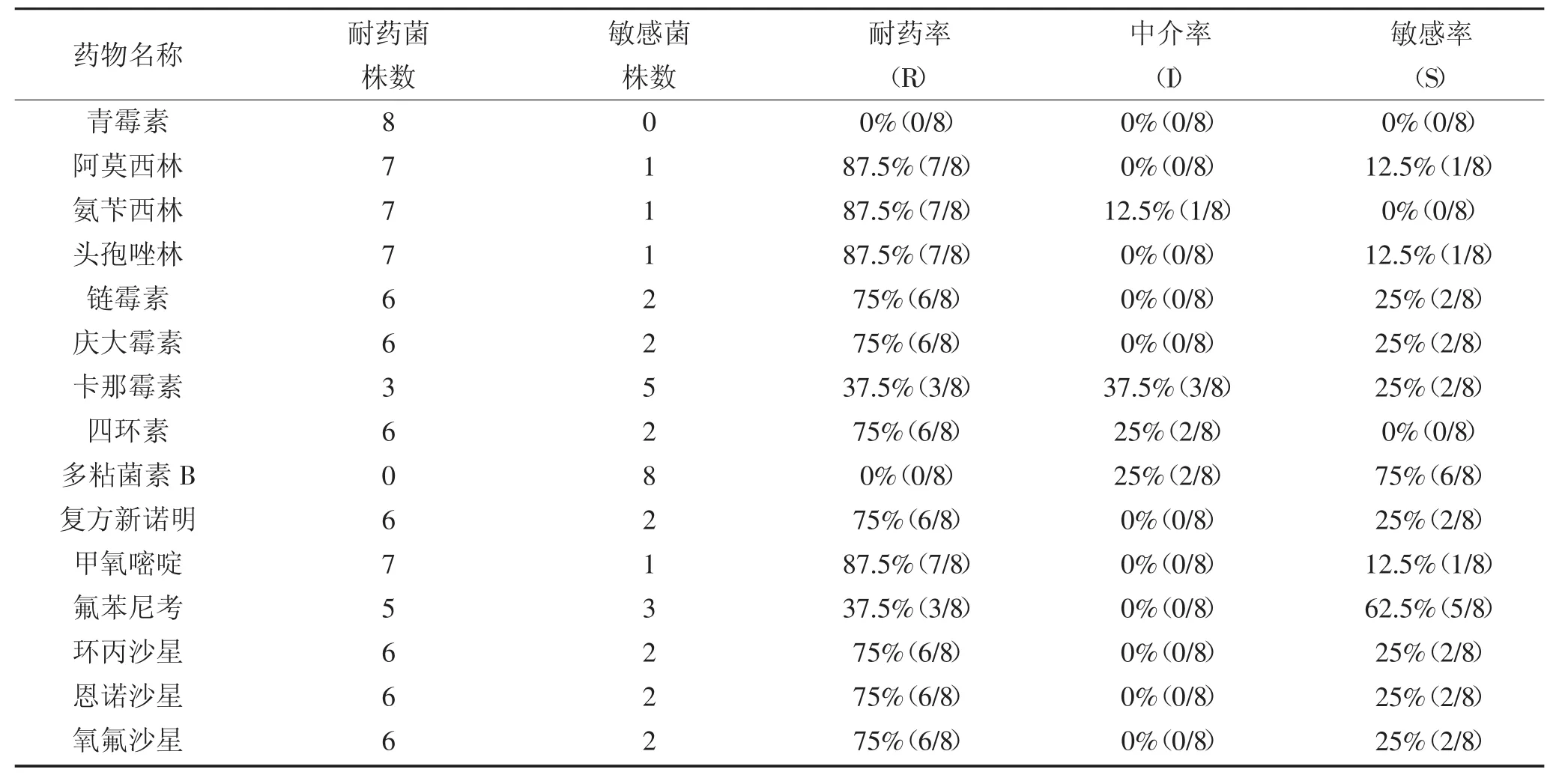
表2 大肠杆菌药敏实验结果Table 2 Drug sensitive test results of E.coli
2.5 PCR检测结果
对6种耐药基因进行检测,共检测出5种耐药基因,其中aadB耐药基因未能检出,在检出的5种耐药基因阳性检出率均为100%,以下是5种耐药基因PCR结果图(见图a~e)。
3 讨论
近年来,由于抗生素的广泛使用,尤其在临床和动物养殖业中的不合理使用,使得大肠杆菌耐药性日益严重,并有逐年上升趋势,细菌耐药菌株的传播和多重耐药菌株的出现是导致传染病治愈率受到限制的主要原因之一。本次药敏试验结果表明所有分离株对青霉素全部耐药,阿莫西林、氨苄西林、头孢唑林的耐药率也高达87.5%,这与牛场长期使用青霉素类药物治疗疾病有关。武瑞兵等[10]对117份肉牛大肠杆菌进行耐药性与耐药基因检测,结果117株大肠杆菌对四环素、氨苄西林、链霉素耐药率分别为89%、42%和38%,除四环素检出率低于89%外,其余均高于武瑞兵等人的报道,马长宾等[11]在192份大肠杆菌奶牛犊牛腹泻样品中,青霉素的耐药率达82%,链霉素耐药率达69%,与试验检测链霉素耐药率相接近,说明大肠杆菌在牛群中的耐药性增强。
试验在8份样品中检测出5种耐药基因其检出率均为100%,由于菌株数量较少,与其他等人报的大肠杆菌耐药基因检出率相比较都偏高。武瑞兵等[8]在26株磺胺类耐药菌株中sul2基因检出率77%(22/26),在104株大肠杆菌耐四环素菌株中tetA基因检出率为55%(57/104),耐β-内酰胺菌株中blaTEM73%(36/49),而试验两种耐药基因检出率为100%,说明青霉素和四环素在治疗大肠杆菌病时使用率较高,不同地区牛场使用抗生素有所差别,导致耐药性和耐药基因比率也各不相同在[12]。实验ParC检出率为100%,说明在治疗大肠杆菌病过程中喹诺酮类药物使用广泛,造成耐药性逐渐增强,加快了耐药基因传播速率。通过药敏试验与检出的耐药基因相比,有两株菌表现出不耐药,但确检测出aac(3)-Ⅱ、ParC耐药基因,其具体机制还有待于进一步研究。

图15 种耐药基因PCR结果Fig.1 PCR results of 5kinds of drug-resistant genes
大肠杆菌耐药性和耐药基因检测结果进一步肯定了在畜牧业中抗菌药物的使用对大肠杆菌耐药性的产生具有重要意义。为养殖场合理用药,避免产生新的耐药菌株和预防耐药性继续扩散提供了参考依据。
[1]高睿.陕西省犊牛大肠杆菌性腹泻的流行病学调查及初步免疫试验[D].杨凌:西北农林科技大学,2008.
[2]方光远,张姝,张玉红,等.腹泻犊牛大肠杆菌的分离鉴定和药敏试验[J].中国兽医杂志,2008,44(10):33-34.
[3]赖婧,刘洋,汪宇,等.800株不同动物源大肠杆菌的耐药性监测[J].中国兽医杂志,2011,47(4):12-14.
[4]马超.奶牛乳腺炎大肠杆菌优势血清型相关毒力基因与耐药基因的检测与序列分析[D].银川:宁夏大学,2014.
[5]Ng L K,Martin I,Alfa M,et al.Multiplex PCR for the detection of tetracycline resistant genes[J].Molecular& Cellular Probes,2001,15(4):209-215.
[6]张忠,曾瑾,邓光存.宁夏地区162株大肠杆菌临床分离株对磺胺类药物的耐药性分析[J].宁夏大学学报:自然科学版,2014,35(1):61-65.
[7]崔冰冰.34株致犊牛腹泻的大肠杆菌耐药性分析及合理用药建议[D].长春:吉林农业大学,2015.
[8]王利勤.鸡源致病性大肠埃希菌耐药基因及毒力基因检测研究[D].杨凌:西北农林科技大学,2012.
[9]Bergey D H,Harrison F C,Breed R S,et al.Bergey's manual of determinative bacteriology[M].Michigan:Williams &Wilkins,1994.
[10]武瑞兵,高玉敏,王鹏翔,等.牛肉源大肠杆菌的耐药性检测及相关耐药基因分布[J].中国畜牧兽医,2015,42(2):452-458.
[11]马长宾,陈文武,王忠山,等.致犊牛腹泻大肠杆菌的分离鉴定及药敏试验[J].中国动物检疫,2015(3):78-82.
[12]徐昊,孙海英,翟军军,等.大庆屠宰牛肉中沙门氏菌的分离鉴定及药敏试验[J].黑龙江八一农垦大学学报,2015,27(3):36-39.
Isolation Identification and Detection of Drug Resistance and Resistance Gene of Pathogenic Escherichia coli Strains Isolated from Cattle Farm in Heilongjiang Province
Yue Shan1,Liu Yu1,2,Liu Tong1,Zhou Jinling1,Wang Huaxin1,Zhao Jinghu1,He Boning1,Liu Shanshan1,Zhang Shixun1,Wang Tian1,Liu Zenglu1,Zhu Zhanbo1
(1.College of Anmimal Science and Technology,Heilongjiang Bayi agriculture university,Daqing 163319;
2.Veterinary Science Research Institute of Heilongjiang Province)
To studydrug resistance and resistance gene of Escherichia coli strains isolated from diarrhealcalves in large scale dairy farm of Suihua city in Heilongjiang province,in April 2016,8 fecal collections were collected from diarrheal calves.The reason of diarrhea disease was the infection of Escherichia coli confirmed by isolation and identification of bacteria,and biochemical test identification methods.Drug susceptibility test results showed that Escherichia coli stains were highly sensitive to fluorine benzene nicol and polymyxin B,resistance of penicillin was 100%,tetracycline ciprofloxacin and enrofloxacinwas 75%.Escherichia coli stains contained five drug resistance genes by PCR,such as blaTEMtetA Sul2 aac(3)-II and ParC.Results showed that resistance phenomenon of Escherichia coli strains was particularly serious in the largescale dairy farm,and antibiotics should be rationally used.
calves;Escherichia coli;drug sensitivity test;drug resistance gene
S855.1+2
A
1002-2090(2016)06-0079-04
10.3969/j.issn.1002-2090.2016.06.016
2015-08-10
科技部科技支撑计划课题(2014BAD13B03-1);省农垦总局课题(HNK135-04-03)。
岳山(1991-),男,黑龙江八一农垦大学动物科技学院2015级硕士研究生。
朱战波,教授,博士研究生导师,E-mail:zhanbozhu@163.com。

