集约化牛场泌乳奶牛硒缺乏症血液临床病理学变化研究
曹宇,李兰,张洪友
(黑龙江八一农垦大学动物科技学院,大庆 163319)
集约化牛场泌乳奶牛硒缺乏症血液临床病理学变化研究
曹宇1,李兰2,张洪友1
(黑龙江八一农垦大学动物科技学院,大庆 163319)
从两个集约化奶牛场(A、B),选取了缺硒组(30头)与健康对照组(20头),检测试验奶牛的抗氧化、免疫功能、肝功指标。结果显示:与健康对照组相比,缺硒组血浆中GSH-Px活性显著的降低,与硒水平呈显著正相关;MDA、T-NOS和LPO水平明显升高,MDA、T-NOS、LPO与硒水平呈显著负相关。缺硒组血浆中IL-1β、IgG、TNF-α和IL-6水平都显著的降低(P<0.05),TNF-α、IL-6、IgG、IL-2与硒水平呈显著正相关。缺硒组血浆中ALP、TP水平明显的增加,ALP、TP与硒水平呈显著负相关。表明硒缺乏症会影响泌乳奶牛抗氧化能力和免疫功能。
奶牛;硒缺乏;抗氧化;免疫功能;肝功
硒缺乏症是泌乳奶牛的一种重要的营养代谢病。它会引起泌乳期奶牛产奶量降低,免疫功能低下,并继发其他疾病如乳房炎、子宫内膜炎等。近年来,我省集约化牛场奶牛单产不断提高,亚临床代谢病时有发生,危害日趋严重。硒缺乏会对机体的抗氧化能力,繁殖性能及生产性能产生影响。目前,反刍动物硒缺乏还没有受到人们的广泛关注及研究。实验通过检测奶牛血浆中硒含量,为硒缺乏对奶牛繁殖性能和泌乳性能的影响做进一步研究。并通过对泌乳奶牛抗氧化、肝功及细胞因子等指标进行检测,并将硒含量和氧化应激指标、细胞因子、肝功指标进行相关性分析,探究泌乳奶牛硒与抗氧化能力,免疫功能和肝功的相关性,为泌乳奶牛提早补硒提供科学依据。
1 材料和方法
1.1 试验动物及分组
在牧场A和牧场B两个不同区域的集约化牛场中,以血清硒小于70 μg·L-1为缺硒标准,选取30头硒缺乏奶牛作为缺硒组,选取20头健康奶牛作为健康对照组(血浆硒含量在正常范围的泌乳奶牛头数较少,为了保持缺硒组与健康对照组数量上的大致平衡,在两牛场随机选取80头进行生化指标样品检测)。
1.2 实验试剂和试剂盒
肝素抗凝剂购自江苏万邦生化医药公司;谷胱甘肽过氧化物酶(GSH-Px)生化试剂盒(20131115)、超氧化物歧化酶(SOD)生化试剂盒(20131115),丙二醛(MDA)生化试剂盒(20131119)、一氧化氮(NO)生化试剂盒(20131119)、过氧化氢酶(CAT)生化试剂盒(20131115)、总一氧化氮合成酶(T-NOS)试剂盒(20140906)、肿瘤坏死因子(TNF-α)ELISA测定试剂盒(201409)、白介素-1受体(IL-1β)ELISA测定试剂盒(201409)、白介素-2(IL-2)ELISA测定试剂盒(201409)、过氧化脂质(LPO)生化试剂盒(20140829)、免疫球蛋白G(IgG)ELISA测定试剂盒(201409)、白介素-6(IL-6)ELISA测定试剂盒(201409),以上试剂盒均购自南京建成生物有限公司。
1.3 样品采集
牧场A和牧场B,清晨空腹尾静脉采集试验奶牛血液样品,肝素抗凝采血10 mL,4 000 rmp·min-1离心,取上清液,-80℃冻存,备用。
1.4 检测指标及方法
首先检测样品硒含量以确定缺硒组和对照组,之后两组血液样品检测项目包括抗氧化(GSH-Px、SOD、T-AOC、MDA、T-NOS、LPO、NO、CAT)、免疫功能(TNF-α、IL-6、IgG、IL-1β、IL-2)、肝功(ALB、ALP、TP、GLB、A/G)的各项指标。
硒采用原子吸收方法检测,SOD(U·mL-1)采用比色法检测,MDA(nmol·mL-1)采用硝酸还原酶法检测、NO(μmol·L-1)采用硝酸还原酶法检测、TP(g·L-1)采用比色法检测;ALB(g·L-1)采用比色法检测。CAT(U·mL-1)采用可见光法检测、T-NOS(U·mL-1)采用比色法检测、T-AOC(U·mL-1)采用比色法检测、GSH-Px(U·mL-1)采用比色法检测、LPO(μmol·mL-1)采用分光光度法检测,具体操作步骤严格按照试剂盒说明书执行(操作方法见附录),上述指标均在南京建成生物技术有限公司检测。IL-1β(ng·L-1)、IL-2(ng·L-1)、IL-6(ng·L-1)、TNF-α(ng·L-1)、IgG(mg·mL-1)采用酶联免疫分析方法检测,具体操作步骤严格按照试剂盒说明执行,每个标准品孔、空白对照孔和样品孔均设对照孔,上述指标均在南京建成生物技术有限公司检测。
1.5 数据分析
数据采用SPSS19.0软件的单因素方差进行分析,结果以“平均数±标准差”表示,阈值P设为0.05。相关性利用Pearson相关系数分析。
2 实验结果
2.1 硒缺乏对泌乳奶牛抗氧化功能的影响

表1 试验奶牛抗氧化状况Table 1 Antioxidant condition of the experimental dairy cattle
2.2 血浆硒与氧化应激指标的相关性分析
如表2所示,通过Pearson相关性分析硒与抗氧化指标的相关性分析,其中GSH-Px和MDA水平与缺硒相关性最大。

表2 血浆中硒与抗氧化指标的相关性Table 2 Correlation between selenium and antioxidant index
2.3 硒缺乏对泌乳奶牛免疫功能的影响
由表3可见,缺硒组奶牛血液IL-1β、TNF-α、 IgG、IL-6水平显著低于对照组(P<0.05)。

表3 试验奶牛血清细胞因子的水平Table 3 Cytokines index of the experimental dairy cattle serum
2.4 血浆硒与免疫功能指标的相关性分析
Pearson相关性分析表明(表4),血浆中IL-1β(R=0.24,P=0.20)与硒水平有相关性但差异不显著,IL-6(R=0.35*,P=0.03)、IgG(R=0.39*,P=0.02)、IL-2(R=0.38*,P=0.03)、TNF-α(R=0.37*,P=0.02)与硒水平呈显著正相关。

表4 奶牛血浆硒与细胞因子的相关性Table 4 Correlation between selenium and cytokines of dairy cattle plasma
2.5 硒缺乏对泌乳奶牛肝功的影响
由表5可见,缺硒组中ALP、TP之间差异均显著(P<0.05)。

表5 试验奶牛肝功能状况Table 5 Liver function status of the experimental dairy cattle
2.6 血浆硒与肝功指标的相关性分析
ALP(R=-0.32*,P=0.03)和TP(R=-0.41*,P= 0.02)与硒水平呈显著负相关。
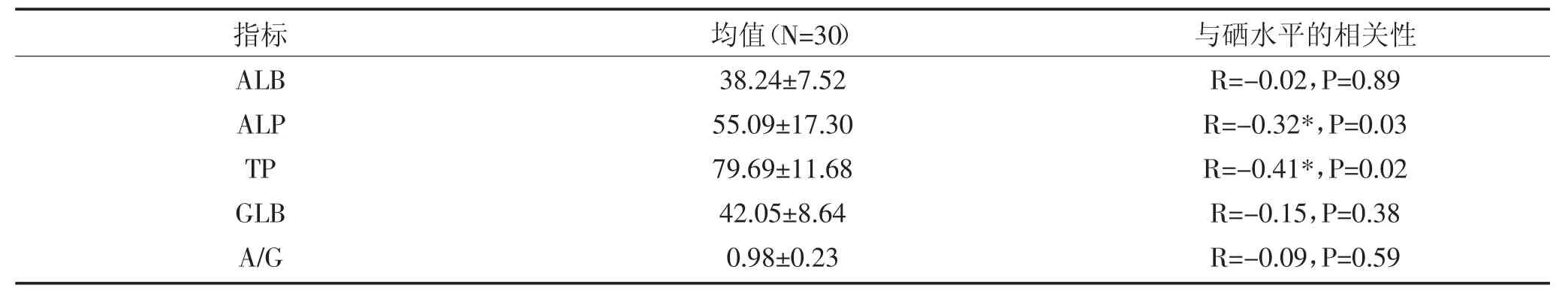
表6 奶牛血浆硒与肝功指标的相关性Table 6 Correlation between selenium and liver function index in dairy cattle plasma
3 分析与讨论
3.1 硒缺乏对泌乳奶牛抗氧化功能的影响
硒是动物体细胞抗氧化系统的组成部分。硒是GSH-Px的主要成分,GSH-Px能清除体内多余的自由基,同时也可以作为脂质抗氧化的调节者,其检测范围在45.53-88.52 U·mL-1[1]。SOD的主要作用是清除体内自由基,保护脱氢酶免受超氧自由基影响失活,其正常的生理范围在46.13±5.58 U·mL-1。MDA是反映机体氧化应激的重要指标,可以通过测定其含量了解膜脂过氧化的程度,其检测范围在1.96~ 3.31 nmol·mL-1[2]。T-AOC是衡量动物机体抗氧化功能的综合指标,可以反映对外来刺激的代偿能力以及机体自由基代谢状况,该防御体系的机能降低会引起其他疾病的发生[3]。当机体长时间缺硒会导致TNOS表达水平升高,大量的NO释放,导致NO代谢改变引发器官损伤。当体内H2O2大量生成时,LPO含量增高,协同GSH-Px和CAT共同完成细胞内H2O2的分解,LPO的检测范围是1.6~5.2 μmol·mL-1。在奶牛饲料中添加硒可以明显的看到血清中GSH-Px、SOD的活性增加,MDA、LPO的含量下降,机体自由基水平下降,维持机体氧化系统和抗氧化系统相对平衡,减少细胞损伤,表明机体的抗氧化系统较好[3]。甘璐研究发现,补硒的大鼠体内MDA含量下降,SOD、CAT、GSH-Px及T-AOC活性增高,表明机体内抗氧化酶的活性有效的抑制大鼠肝脏的脂质过氧化[4]。这表明硒能有效的清除体内活性氧,减少体内过氧化物的产生而保护细胞膜免受氧化物的损害。实验中健康对照组与缺硒组相比,健康对照组血浆中SOD、GSH-Px、活性升高,MDA、LPO、T-NOS活性降低,T-AOC和CAT活性无明显变化。这表明缺硒会使机体处于氧化应激状态,相比硒正常状态时会对机体健康造成损害。
3.2 血浆硒与抗氧化指标的关系
在正常情况下,奶牛机体的抗氧化能力和氧化能力(产生自由基)一直处于在一个相对平衡状态,并且不会对机体造成损伤。这种稳定平衡一旦被打乱,会导致机体组织氧化损伤,改变机体内环境的稳定,使机体极易继发多种疾病。
动物体都有一套完整的抗氧化系统来防止氧自由基对生物膜的损伤。按其性质可分为酶抗氧化系统和非酶抗氧化系统,SOD、GSH-Px和T-AOC属于酶抗氧化系统,Cu、Mn、Zn是酶抗氧化系统的中心元素,但他们属于非酶抗氧化系统。硒是谷胱甘肽过氧化物酶中起氧化还原催化作用的原子,起关键作用[6]。硒可以促进干扰素的产生,并且可以在体外增加γ-干扰素的活性,增强人体自然杀伤(NK)细胞的细胞毒作用,而不损伤靶细胞膜[7]。硒可以对抗由叔丁基过氧化氢诱导的脂质过氧化损伤,解除动物体内过氧化物对机体的毒害作用[8]。
在实验中,通过Pearson相关系数表明GSH-Px(R=0.36*,P=0.01)与硒水平呈显著正相关,MDA(R=-0.36*,P=0.02)、T-NOS(R=-0.30*,P=0.05)、LPO(R=-0.30*,P=0.04)与硒水平呈显著负相关。这表明当奶牛硒缺乏时,GSH-Px活性发生改变,清除自由基能力减弱,抗氧化系统发生变化,导致机体组织氧化损伤,产生大量的自由基和脂质过氧化物,使机体氧化平衡状态被打破。当机体处于硒缺乏状态时,GSH-Px、T-AOC、CAT、SOD水平会降低,MDA、TNOS、LPO、NO水平会升高。
3.3 硒缺乏对泌乳奶牛免疫功能的影响
细胞免疫应答可以特异性杀伤抗原同时对体液免疫也起到促进的作用,细胞免疫正常情况下是由T淋巴细胞介导参与的特异性防御反应。IL-2是T细胞发育过程中重要的生长因子,由活化的T淋巴细胞产生作用于T淋巴细胞表面的IL-2受体,进一步刺激T细胞的分泌增殖。动物体内IgG主要由脾脏和淋巴结中的浆细胞产生,有抗病毒和抗菌等免疫活性作用。尚远宏等研究发现,补硒可以使小鼠血清中IL-2和干扰素水平显著增加[9]。硒可以促进淋巴细胞分泌IL-1和IL-2,提高机体合成IgG能力,抗体水平明显提高。实验研究也发现健康对照组IL-2和IgG水平比缺硒组高,表明硒可以干扰免疫活性细胞分泌细胞因子,提示缺硒使得机体的免疫能力下降,引起免疫功能的抑制。
IL-1β具有免疫调节功能,是单核巨噬细胞产生的细胞因子和多肽调节因子。研究表明当硒缺乏时,雏鸡血清IL-1β含量下降,免疫器官(脾脏)受到损伤导致机体防御机能下降[10]。Safir报道了畜禽通过补硒可以提高巨噬细胞分泌IL-6、IL-1和TNF-α的能力[11]。实验同样的证实了健康对照组IL-1β、IL-6和TNF-α水平明显的高于缺硒组。
3.4 血浆硒与免疫功能指标的关系
硒通过GSH-Px对特异性和非特异性免疫起到抗氧化作用。机体硒缺乏时,T、B淋巴细胞受到抑制。补硒可以增加机体免疫功能,促进T淋巴细胞的分裂增殖。IL-6是活化的T细胞和成纤维细胞产生的淋巴因子。能使B细胞前体成为产生抗体的细胞,并且通过和集落刺激因子协同来增强自然杀伤细胞的裂解功能[12]。
在实验中,IgG(R=0.39*,P=0.02)、IL-2(R= 0.38*,P=0.03)、IL-6(R=0.35*,P=0.03)、TNF-α(R= 0.37*,P=0.02)与硒水平显著正相关,这表明缺硒会对免疫功能有影响。当机体处于正常状态,成熟淋巴细胞需依赖抗原刺激而分化增殖,继而发挥其免疫功能。当机体处于硒缺乏状态时,IgG、IL-2、IL-6、TNF-α水平降低。
3.5 硒缺乏对泌乳奶牛肝功的影响
评价奶牛肝功能的指标通常是观测TP、ALB和GLB三项指标,同时它们也是检测奶牛蛋白质营养状况的标志[13]。ALB的浓度伴随着日粮蛋白质的变化而变化,当ALB浓度下降表明机体缺乏蛋白质,也会导致肝脏白蛋白合成降低。白蛋白和球蛋白通过相互补偿来维持总蛋白的恒定水平[14]。泌乳奶牛血液TP的正常范围在62~82 g·L-1,ALB的正常范围是28~39 g·L-1,GLB是34~53 g·L-1,ALP的检测范围是8.9~121U·L-1,A/G的正常范围值小于1[15]。ALP在临床上用于肝胆疾病的诊断,其广泛分布于人体肝脏、肠、肾、胎盘和骨骼等组织,它们都会经肝脏向胆外排出的一种酶,临床上用于肝胆疾病的诊断。TP作为营养物质的载体参与物质的转运,它的浓度变化都在正常范围内。机体在正常情况下,ALP会受到细胞膜的屏障作用,不会在血液中出现,当机体自由基大量聚集时,细胞膜的通透性会升高,使ALP释放到血液中的速度加快,会增加ALP在血浆中的浓度。TP在血液中浓度过高,表明肝脏储存能力较低,不利用细胞的修复。在实验中,尽管两组中ALP和TP差异显著,但是全部指标均处于正常范围内,这表明微量缺硒并未对肝功造成明显的损害并且表明硒含量多可以刺激抗体的产生,提高机体抗病能力的同时也提高机体修复和愈合能力[16]。但不排除严重缺硒会对泌乳奶牛肝脏产生影响。
3.6 血浆硒与肝功指标的关系
TP、ALB和GLB通常是评价奶牛肝功能的指标,也是反应机体肝脏健康状况的指标,同时也能反应外界免疫能力的强弱。实验中,通过Pearson相关系数表明,动物体硒水平与ALB、ALP、TP、GLB、A/G全部呈负相关。其中ALP(R=-0.32*,P=0.03)和TP(R=-0.41*,P=0.02)与硒水平呈显著负相关。这表明缺硒会对肝脏有影响,降低机体的抗病能力,但是在正常的范围内不会对肝脏照成损伤。有文献表明人类适当补硒对人类肝脏具有保护作用,患肝病的人普遍体内都存在缺硒现象[17-18]。当机体处于硒缺乏的状态时,ALP、TP水平会增高。
4 结论
缺硒奶牛易处于氧化应激状态,同时缺硒对免疫功能和肝功也造成了显著的影响,故对牛群硒水平的检测评估对及早预防疾病的发生以及改善饲养管理水平尤为重要。
[1]McCay P B,Gibson D D,Kuo-Lan F,et al.Effect of glutathione peroxidase activity on lipid peroxidation in biological membranes[J].Biochimica et Biophysica Acta(BBA)-Lipids and Lipid Metabolism,1976,431(3):459-468.
[2]黄志坚,林藩平,邱承亮,等.富硒酵母对奶牛抗氧化能力和免疫功能的影响[J].营养学报,2004,26(1):27-30.
[3]朱宏娟.不同硒源及硒水平对肉仔鸡生产性能和血液抗氧化指标的影响[D].长沙:湖南农业大学,2006.
[4]甘璐,刘琼.硒对大鼠肝脏抗氧化酶活性及基因表达的影响[J].中国公共卫生,2003,19(2):159-160.
[5]王巧红.硒缺乏致鸡免疫抑制机制的研究[D].哈尔滨:东北农业大学,2009.
[6]Rotruck J T,Pope A L,Ganther H E,et al.Selenium:biochemical role as a component of glutathione peroxidase[J]. Science,1973,179(4073):588-590.
[7]祝念林,张玲珍.微量元素硒对人天然杀伤细胞毒活性(NR)功能的体外影响[J].中华微生物学和免疫学杂志,1989(3):168-172.
[8]王传蓉.维生素E和硒对荷斯坦母牛及新生犊牛的影响[D].扬州:扬州大学,2008.
[9]尚远宏,田金凤,李松青,等.不同缺血时间对脑缺血/再灌注损伤大鼠神经行为学的影响[J].西南民族大学学报,2015,41(5):539-543.
[10]仝宗喜,康世良,武瑞.硒缺乏雏鸡细胞因子水平变化的研究[J].畜牧兽医学报,2004,35(6):731-735.
[11]Safir N,Wendel A,Saile R,et al.The effect of selenium on immune functions of J774.1 cells[J].Clinical Chemistry and Laboratory Medicine,2003,41(8):1005-1011.
[12]倪丽丽.有机硒对奶牛瘤胃发酵,抗氧化功能及免疫功能的影响[D].呼和浩特:内蒙古农业大学,2011.
[13]郑家三,刘健男,吴凌,等.泌乳奶牛不同泌乳阶段某些主要维生素与微量元素缺乏的调查研究[J].黑龙江八一农垦大学学报,2015,26(3):52-53.
[14]宋平.不同饲养方式下奶牛血液生化指标测定与分析[D].哈尔滨:东北农业大学,2007.
[15]李新萍,陶岳,张孝恩,等.新疆石河子地区奶牛血液生化指标正常参考值范围的建立[J].中国奶牛,2011(18):47-50.
[16]曹雪瑾.不同硒源及水平对断奶仔猪生长性能,血液生化指标和抗氧化指标的影响[D].南宁:广西大学,2011.
[17]段毅力.慢性肝炎补硒治疗的研究[J].微量元素与健康研究,2001,18(4):25.
[18]李文广,颜晓文.高危人群补硒预防肝癌的作用[J].中华预防医学杂志,2000,34(6):336-338.
Study of Blood Clinical Pathological Changes of Selenium Deficiency of Dairy Cattle in Intensive Dairy Farm
Cao Yu1,Li Lan2,Zhang Hongyou1
(Collge of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
30 dairy cattle(selenium group)and 20 dairy cattle(healthy control group)were selected from two intensive dairy farms(A,B)and analyzed their anti-oxidation ability,immune function and liver function.The results showed that compared with the control group,plasma selenium significantly reduced GSH-Px activity,and selenium levels were significantly correlated,MDA,T-NOS and LPO levels significantly increased,MDA,T-NOS,LPO and selenium levels were significantly negatively correlated;Plasma IL-1β,IgG,TNF-α and IL-6 levels in selenium group were significantly reduced(P<0.05),TNF-α,IL-6,IgG,IL-2 and selenium levels were significantly correlated.Selenium deficiency in plasma ALP,TP levels were significantly increased,ALP,TP and selenium levels were significantly negatively correlated.It showed that selenium deficiency disease affected antioxidant capacity and immune function of the lactating cattle.
dairy cattle;Selenium deficiency;antioxidant;immune function;liver function
S858.23
A
1002-2090(2016)06-0049-06
10.3969/j.issn.1002-2090.2016.06.010
2015-11-20
东北农区奶牛规模化健康养殖生产技术集成与产业化示范(2012BAD12B05)。
曹宇(1991-),男,黑龙江八一农垦大学动物科技学院2014级硕士研究生。
张洪友,男,教授,硕士研究生导师,E-mail:zhy478@163.com。

