HPLC法测定芪红水煎剂中花旗松素和槲皮素的含量
巴寅颖 于 萍 杜宇琼 车念聪 靳 华 吴 霞
(1 首都医科大学中医药学院,中医络病研究北京市重点实验室,北京,100069; 2 首都医科大学附属佑安医院,北京,100069)
HPLC法测定芪红水煎剂中花旗松素和槲皮素的含量
巴寅颖1于 萍1杜宇琼1车念聪1靳 华2吴 霞1
(1 首都医科大学中医药学院,中医络病研究北京市重点实验室,北京,100069; 2 首都医科大学附属佑安医院,北京,100069)
目的:建立高效液相色谱法测定芪红水煎剂中2种主要有效成分花旗松素和槲皮素的含量。方法:采用Waters Sunfire C18(250 mm×4.6 mm,5 μm)色谱柱,以甲醇-0.5%磷酸溶液为流动相梯度洗脱,流速1 mL/min,检测波长290 nm(花旗松素)、365 nm(槲皮素)。结果:花旗松素和槲皮素线性范围分别为0.075 5~0.120 8 μg(r=0.999 4)和0.030 8~0.092 4 μg(r=0.999 9);平均加样回收率(n=6)分别为102.74%(RSD=1.71%)和102.45%(RSD=1.52%)。结论:本法简便、准确,重复性好,可用于芪红水煎剂中花旗松素和槲皮素的含量测定。亦可作为芪红水煎液质量控制方法之一。
芪红水煎剂;水红花子;黄芪;花旗松素;槲皮素
芪红水煎剂是“全国名老中医药专家钱英教授传承工作室”和中医络病研究北京市重点实验室基于肝纤维化络病“虚”“瘀”并存的基本病机及结合国家级名老中医药专家钱英教授多年的临床经验总结,选用水红花子:黄芪=1∶4相配伍制成的用于治疗肝纤维化的中药方剂[1-2]。此配伍与中医学对肝纤维化气虚血瘀、正虚邪恋的病机认识相一致。文献调研和前期的药理研究表明,水红花子、黄芪及芪红水煎剂对免疫肝纤维化大鼠的肝组织纤维化程度有明显改善作用[3-8]。为保证药物质量可控,芪红水煎剂亟待建立稳定、可靠的质量控制方法。水红花子为蓼科植物红蓼(PolygonumorientaleL.)的成熟果实。味辛、咸,性微寒。归肝、脾、胃经。具有散血消癓,消积止痛的功效。在临床上可用于急慢性肝病中的各期的治疗。花旗松素和槲皮素是水红花子的主要有效成分[9-14],花旗松素也是2015版药典中水红花子含量测定的指标性成分[15]。因此,研究芪红水煎剂中花旗松素和槲皮素的含量测定方法具有重要意义。本实验采用HPLC法建立芪红水煎剂中花旗松素和槲皮素的含量测定方法,为系统建立芪红水煎液的质量控制方法提供实验依据。
1 材料与方法
1.1 材料 Waters 2695高效液相色谱仪(waters科技有限公司),2998PDA检测器,Empower工作站,自动进样;Sartorious AG ME2355型1/100000电子分析天平(北京赛多利斯仪器有限公司);KQ-500DE型超声波清洗器(昆山超声仪器有限公司);HH-S型电热恒温水浴锅(北京市长风仪器仪表公司)。水红花子药材购自北京同仁堂有限公司(批号:091117,产地:辽宁本溪);黄芪购自北京同仁堂有限公司(批号:100918,产地:甘肃渭原)。槲皮素(批号:100081-201408,纯度:99.1%)和花旗松素(批号:111816-201102,纯度:98.9%)对照品均购自中国食品药品检定研究院。甲醇、乙腈(Fisher公司,色谱纯);娃哈哈纯净水;磷酸(北京试剂厂,分析纯)。其他试剂均为分析纯。
1.2 试验方法
1.2.1 溶液制备 对照品溶液制备:精密称取花旗松素7.55 mg、槲皮素7.70 mg,分别置于25 mL容量瓶中,加甲醇溶解并定容,摇匀,作为对照品储备液。花旗松素对照品储备液浓度0.302 mg/mL,槲皮素对照品储备液浓度0.308 mg/mL。供试品溶液制备:称取水红花子10.0 g,黄芪40.0 g,置于圆底烧瓶中,加8倍量蒸馏水,回流提取1.5 h,过滤,滤渣继续加6倍量蒸馏水,回流提取1 h,过滤。合并滤液,浓缩干燥成干粉,备用。精密称取芪红水煎剂样品粉末约400 mg,置于三角瓶中,精密量取甲醇10 mL,称重,超声30 min,放至室温后再称重,补足至原重量,0.45 μm微孔滤膜过滤,即得供试品溶液。
1.2.2 色谱条件与系统适应性试验 色谱柱:Waters Sunfire C18(250 mm×4.6 mm,5 μm);检测波长290 nm(花旗松素)、365 nm(槲皮素);流速:1.0 mL/min;柱温:25 ℃;进样量:20 μL。流动相:甲醇(A)-0.1%磷酸(B),梯度洗脱:30%~39%甲醇(0—10 min),39%~47%甲醇(10—20 min),47%甲醇(20—30 min),47%~58%甲醇(30—40 min)。依上述色谱条件,分别精密吸取花旗松素和槲皮素对照品溶液各10 μL、供试品溶液20 μL分别进样,进行系统适应性试验。
1.2.3 线性关系考察 精密吸取一定量的花旗松素和槲皮素对照品储备液,置于10 mL容量瓶中,甲醇定容摇匀,配制成6份不同浓度的混合对照品溶液。6份混合对照品溶液中花旗松素对照品浓度为0.007 55、0.015 1、0.030 2、0.060 4、0.090 6、0.120 8 mg/mL,槲皮素对照品浓度为0.003 08、0.007 7、0.015 4、0.030 8、0.061 6、0.092 4 mg/mL。分别取以上对照品溶液,用自动进样器进样10 μL,按“2.1”项下色谱条件测定色谱峰峰面积。以对照品进样量为横坐标,以色谱峰峰面积为纵坐标绘制标准曲线,并分别进行线性回归。
1.2.4 精密度考察 精密吸取同一混合对照品溶液10 μL,注入高效液相色谱仪,按“2.1”项下色谱条件测定色谱峰峰面积,连续测定6次,计算花旗松素和槲皮素色谱峰面积RSD。
1.2.5 稳定性试验 精密吸取同一芪红水煎剂样品溶液,分别于样品溶液制备后0、2、4、6、8、12、24 h样,每次进样20 μL,按“2.1”项下色谱条件测定色谱峰峰面积。计算花旗松素和槲皮素色谱峰面积RSD。1.2.6 重复性试验 精密称取同一批芪红水煎剂样品粉末6份,每份约400 mg。按“2.1.2”项下方法制成供试品溶液,按“2.1”项下色谱条件,分别进样20 μL,记录花旗松素和槲皮素峰面积。计算芪红水煎剂样品中花旗松素和槲皮素的平均含量和RSD。
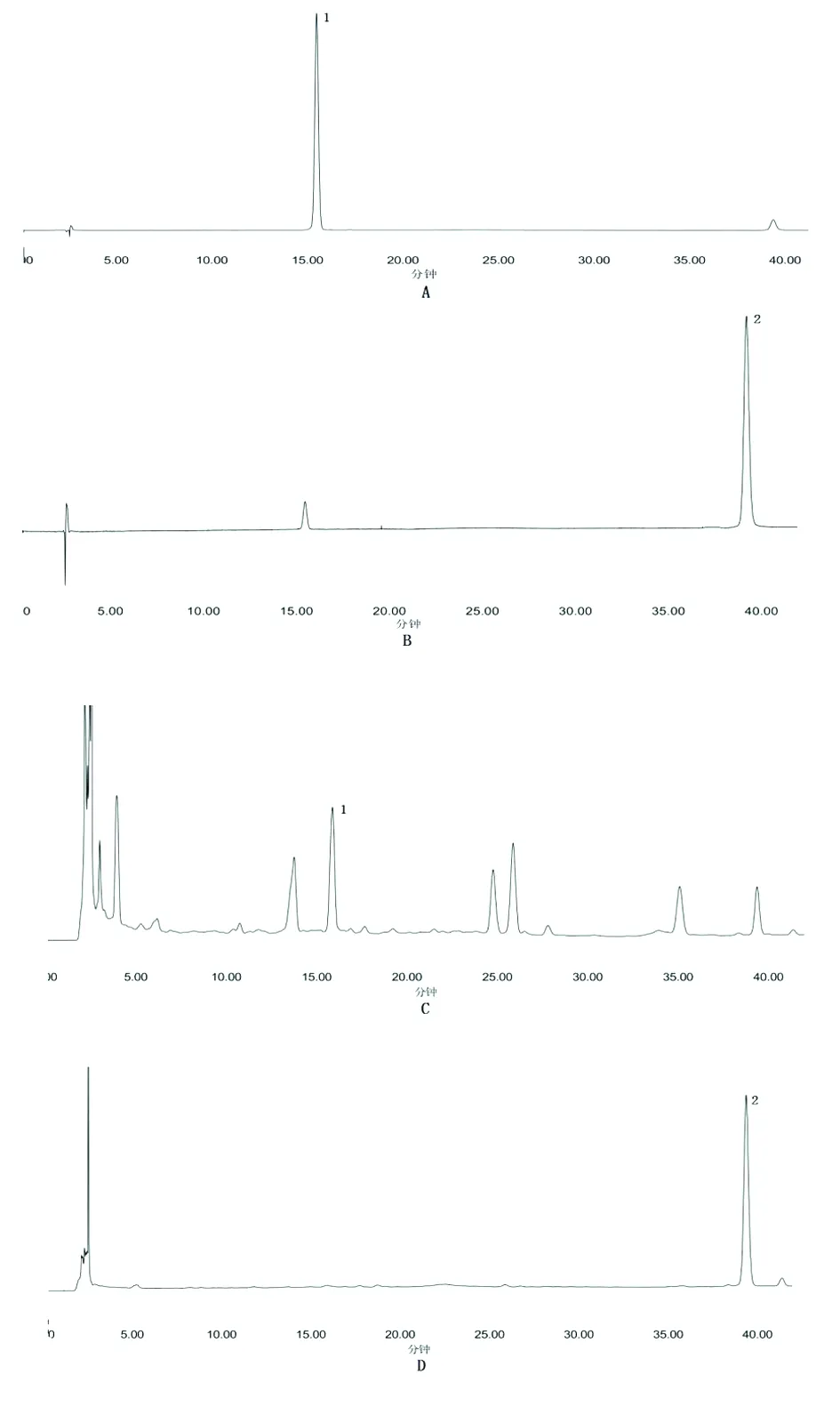
图1 芪红水煎剂样品与对照品高效液相色谱图
注:A花旗松素对照品(290 nm);B槲皮素对照品(365 nm);C芪红水煎剂样品溶液(290 nm);D芪红水煎剂样品溶液(365 nm)。1花旗松素;2槲皮素。
1.2.7 加样回收率试验 精密称取同一批芪红水煎剂样品粉末(花旗松素和槲皮素的平均含量为0.548 mg/g和0.438 mg/g)6份,每份约200 mg,置于三角瓶中,分别加入花旗松素对照品溶液0.35 mL(浓度为0.030 2 mg/mL)、槲皮素对照品溶液0.3 mL(浓度为0.308 mg/mL),精密量取甲醇5 mL,称重,超声30 min,放至室温后再称重,补足至原重量,0.45 μm微孔滤膜过滤,制成供试品溶液,按“2.1”下色谱条件,进样20 μL,记录花旗松素和槲皮素峰面积。计算花旗松素和槲皮素的平均回收率和RSD。
2 结果
2.1 系统适应性试验 依上述色谱条件,花旗松素的洗脱时间为15.8 min,槲皮素的洗脱时间为39.5 min,在对照品溶液和供试品溶液色谱图相应位置上,有相同保留时间且有相同紫外吸收的色谱峰,且与其他成分分离良好。结果见图1。
2.2 线性关系考察 花旗松素回归方程为:Y=34 801 528.75 X+15 909.96,r=0.999 4(n=6);槲皮素回归方程为:Y=59 529 654.69 X+21387.78,r=0.999 9(n=6)。结果表明,花旗松素、槲皮素分别在0.075 5~0.120 8 μg和0.030 8~0.092 4 μg质量范围内与色谱峰面积呈良好的线性关系。
2.3 精密度考察 花旗松素和槲皮素色谱峰面积RSD分别为0.68%、1.07%。表明该方法精密度良好,符合定量分析要求。
2.4 稳定性试验 花旗松素和槲皮素色谱峰面积RSD分别为1.71%和1.36%。表明供试品溶液在24 h内稳定。
2.5 重复性试验 计算得芪红水煎剂样品中花旗松素和槲皮素的平均含量分别为0.548 mg/g和0.438 mg/g,RSD分别为1.98%和2.21%。表明该方法重复性良好。
2.6 加样回收率试验 计算得花旗松素和槲皮素的平均回收率(n=6)分别为102.74%和102.45%,RSD分别为1.71%和1.52%。具体结果见表1。
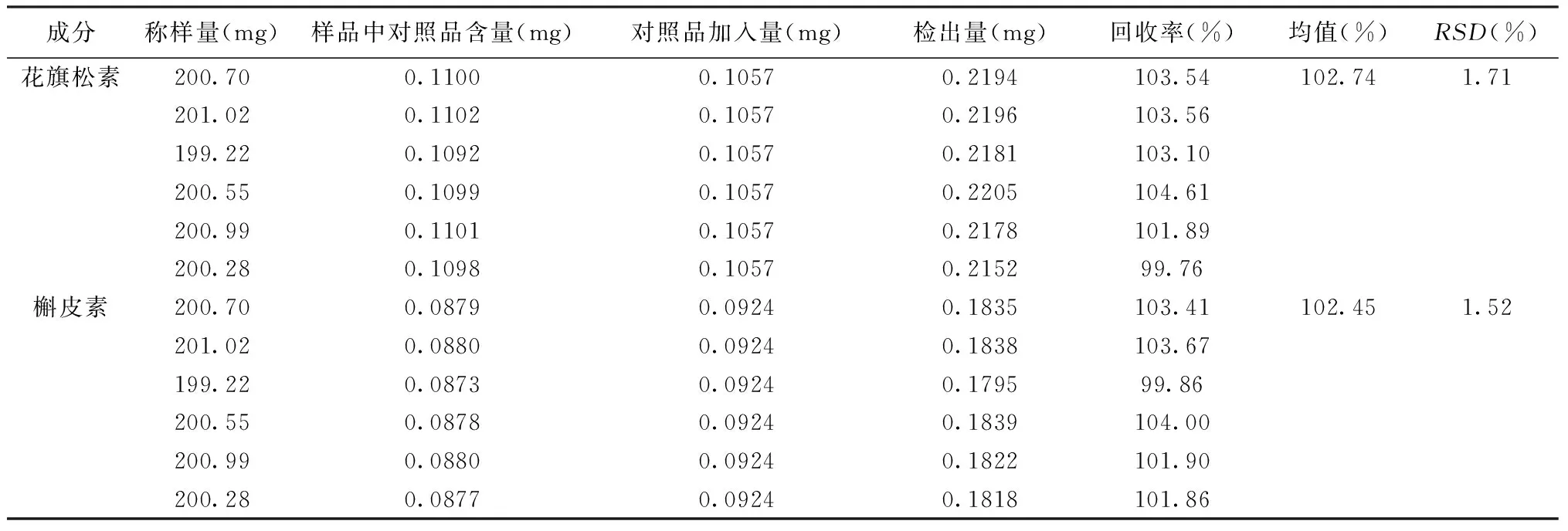
表1 加样回收率试验结果(n=6)
2.7 样品含量测定 按芪红水煎剂处方比例(水红花子:黄芪=1∶4)将药材混合,共50 g,8倍量水回流提取1.5 h,过滤,滤渣继续用6倍量水回流1 h,过滤,合并滤液,浓缩干燥成干粉,同时制备3批。精密称取每批芪红水煎剂样品粉末约400 mg,分别置于三角瓶中,精密量取甲醇10 mL,称重,超声30 min,放至室温后再称重,补足至原重量,0.45 μm微孔滤膜过滤,进样20 μL,按“2.1”项下色谱条件测定色谱峰峰面积。计算花旗松素和槲皮素含量。结果见表2。
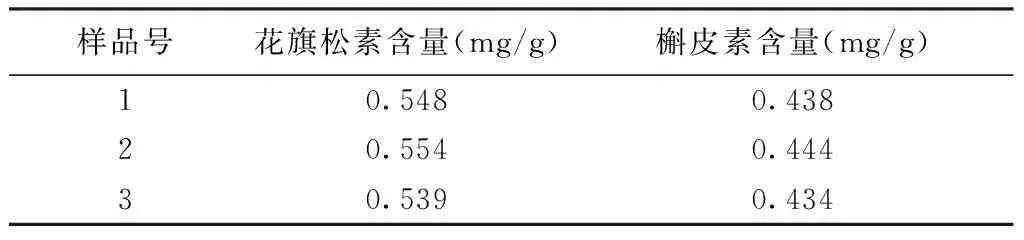
表2 芪红水煎剂中花旗松素和槲皮素含量(n=3)
3 讨论
本试验首次采用高效液相色谱法测定芪红水煎剂中花旗松素和槲皮素的含量,所建立的方法简单、准确、可靠,可作为芪红水煎剂质量控制方法之一。
为保持与临床药理实验的一致性,本试验所采用的提取方法与临床药理实验样品一致。流动相选择时,曾考察了乙腈-0.5%甲酸水溶液、乙腈-0.5%磷酸水溶液、甲醇-0.5%甲酸水溶液、甲醇-0.5%磷酸水溶液等,结果用甲醇-0.5%磷酸水溶液进行梯度洗脱分离度较好。
[1]杜宇琼,车念聪,张秋云,等.钱英教授“养血柔肝法”治疗肝纤维化经验初探[J].中西医结合肝病杂志,2012,22(6):366-367.
[2]杜宇琼,宋乃光,车念聪,等.“络病”理论指导下的肝纤维化治疗思路研究[J].中华中医药杂志,2010,25(10):1604-1606.
[3]杜宇琼,车念聪,高彦彬,等.水红花子现代药理作用研究进展[J].北京中医药,2015,34(12):993-995.
[4]杜宇琼,车念聪,张秋云,等.芪红水煎液对免疫肝纤维化大鼠肝功能及肝纤维化标志物的影响[J].中国中医急症,2016,25(9):1679-1681.
[5]杜宇琼,车念聪,赵晖,等.黄芪对肝纤维化大鼠肝组织TIMP-1及MMP-1表达的影响[J].北京中医药大学学报,2013,36(11):775-778.
[6]杜宇琼,赵晖,张秋云,等.水红花子对免疫肝纤维化大鼠肝功能及血清肝纤维化标志物的影响[J].中国中医急症,2011,20(9):1433-1434.
[7]张晨,黄进,詹菲,等.黄芪多糖对四氯化碳诱导的大鼠肝纤维化的保护作用[J].世界中医药,2015,10(6):887-890.
[8]刘畅,刘平,慕永平,等.黄芪汤治疗慢性肝病研究进展[J].世界中医药,2015,10(2):157-161.
[9]包永睿,王帅,孟宪生,等.水红花子黄酮类成分对人肝癌细胞株SMMC-7721的影响[J].中药材,2013,36(2):255-259.
[10]盛华刚.水红花子的化学成分和药理作用研究进展[J].化工时刊,2013,27(2):44-46.
[11]秦佩,雷志明,吴双,等.槲皮素对Con A诱导自身免疫性肝损伤作用[J].中国公共卫生,2015,31(6):757-759.
[12]翟延君,佟苗苗,程飞,等.花旗松素和3,3′-二甲氧基鞣花酸-4-O-β-D-吡喃葡萄糖苷对肿瘤细胞的增殖抑制作用[J].中成药,2012,34(2):217-220.
[13]沈钦海,秦召敏,刘丽,等.槲皮素对肝细胞氧化应激损伤的保护作用[J].天津医药,2015,43(10):1100-1103.
[14]刘英娟,申玉金,杜金梁,等.槲皮素对四氯化碳致建鲤肝细胞损伤的保护作用[J].农业生物技术学报,2015,23(3):369-379.
[15]国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2015:83.
(2016-05-05收稿 责任编辑:王明)
Determination of Taxifolin and Quercetin in Qihong Decoction: HPLC Method
Ba Yinying1, Yu Ping1, Du Yuqiong1, Che Niancong1, Jin Hua2, Wu Xia1
(1BeijingKeyLaboratoryofTCMCollateralDiseaseTheoryResearch,SchoolofTraditionalChineseMedicine,CapitalMedicalUniversity,Beijing100069,China; 2BeijingYouAnHospitalAffiliatedtoCapitalMedicalUniversity,Beijing100069,China)
Objective:To establish an HPLC method for the determination of taxifolin and quercetin in Qihong decoction.Methods:The determination was carried out with Waters Sunfire C18column (250 mm×4.6 mm, 5 μm), using methanol-0.5% phosphoric acid as mobile phase with gradient elution at a flow rate of 1.0 mL/min and it was detected that the wave length was 290 nm (taxifolin) and 365 nm (quercetin).Results:The linear ranges of taxifolin and quercetin were 0.0755~0.1208 μg(r=0.9994) and 0.0308~0.0924 μg(r=0.9999); the average recovery rate (n=6) was 102.74% (RSD=1.71%) and 102.45% (RSD=1.52%) respectively.Conclusion:This method was simple, steady and reliable, which could be used to determine the contents of taxifolin and quercetin and to control the quality of Qihong decoction.
Qihong decoction; Fructus polygoni orientalis; Radix astagali; Taxifolin; Quercetin
首都中医药研究专项课题(编号:16ZY07)
巴寅颖(1986.02—),女,博士,讲师,研究方向:中药化学,Tel:(010)83911633,E-mail:byy3333@sina.com
吴霞(1967.10—),女,博士,教授,研究方向:中药化学,Tel:(010)83911671,E-mail:wuxia6710@163.com
R284.1
A
10.3969/j.issn.1673-7202.2016.11.057

