黄芪多糖对肥胖小鼠的减肥作用与调节肠道菌群的关系研究
何旭云 贺姣姣 郑宁宁 王顺春 李后开
(1 上海中医药大学交叉科学研究院中医方证与系统生物学中心,上海,201203; 2 上海中医药大学中药研究所,上海,201203)
黄芪多糖对肥胖小鼠的减肥作用与调节肠道菌群的关系研究
何旭云1贺姣姣1郑宁宁1王顺春2李后开1
(1 上海中医药大学交叉科学研究院中医方证与系统生物学中心,上海,201203; 2 上海中医药大学中药研究所,上海,201203)
目的:观察黄芪多糖(AstragalusPolysaccharides,APS)对于高脂饮食诱导的肥胖小鼠的减肥作用与调节肠道菌群的关系。方法:1)将50只C57bl/6J小鼠随机分为5组(n=10),分别为正常对照组(Con)、HFD(high-fat diet)组和APS低中高(在高脂饮食中添加分别添加2%,4%,或8%的APS)剂量组。利用高脂饮食连续喂养8周诱导出小鼠肥胖模型,给药组同步喂养,每周进行称重。实验周期结束后,收集各组粪便样本,利用基于细菌16S rDNA测序的元基因组学方法,分析了APS对于高脂喂养小鼠肠道菌的影响。2)将10只C57bl/6J小鼠随机分为2组(n=5),分别为HFD_R组(HFD_Receptor)和APS_R组(APS_Receptor),每天分别灌胃来自HFD组和APS低剂量组(2%APS)小鼠的新鲜粪便提取液进行肠道菌移植,前八周给予正常饮食,后四周更换为HFD。结果:APS能够明显抑制高脂喂养小鼠肥胖的形成、减轻肝脏脂肪变性、降低肝脏TG水平、改善胰岛素敏感性、显著恢复高脂喂养小鼠的肠道菌群紊乱,增加拟杆菌(Bacteroidetes)与厚壁门(Firmicutes)菌的相对丰度、降低变形菌门(Proteobacteria)细菌的相对丰度,并且,APS的减肥效应能够通过肠道菌移植转移给高脂喂养受体小鼠。结论:APS对高脂喂养小鼠具有减肥作用,且APS的减肥作用与调节肥胖小鼠的肠道菌群有关。
黄芪多糖;肥胖;肠道菌群;胰岛素敏感性;脂肪变性;16S rDNA
肥胖是多种慢性代谢性疾病的共同病理基础[1-2]。21世纪肥胖的流行,及其所引发的各种代谢性疾病包括2型糖尿病、脂肪肝、高血压及心血管疾病等严重威胁着人类的健康[3-6]。尽管一直以来,肥胖被认为主要是由于遗传及环境因素共同作用下,机体能量代谢失衡所导致[7-8]。2004年美国华盛顿大学Jeffrey Gordon等人在无菌小鼠中首次证实肠道菌群作为一种环境因素调控宿主体内脂肪的聚集[9],由此引发了国际上针对肠道菌群参与宿主能量代谢调控研究的热潮。越来越多的研究证据表明肠道菌群在肥胖的发生发展中扮演了极其重要的角色[10-13]。目前认为,人类的消化系统中有超过1 000种共生的肠道微生物,这些肠道微生物所含有的基因数目至少是我们宿主本身的100倍[14]。因此,肠道菌群又被认为是肝脏以外的又一重要的“微生物器官”[15-16]。肠道菌群的主要功能包括调节宿主免疫功能[17]、抵抗病原菌侵入[18]、调节能量代谢[12]及参与对外源性化合物的代谢[14]等。研究表明,肥胖的形成伴随有明显的肠道菌群失衡[19],尤其是在肠道中占有主要比例的厚壁门与拟杆菌门细菌的比例失调(Firmucutes/Bacteroidetes),而针对肥胖的减肥措施能够明显恢复厚壁门与拟杆菌门细菌的比例[20]。因此,肠道菌群已经被认为是防治肥胖及相关疾病的重要干预靶标[21]。
黄芪多糖(AstragalusPolysaccharides,APS)是传统补气中药黄芪(Astragalus)中的主要活性成分之一。研究表明,APS能够改善高脂喂养及糖尿病模型小鼠的葡萄糖代谢与胰岛素敏感性[22-25],降低高脂喂养大鼠血脂[26],及血浆胆固醇水平[27],并对高脂喂养小鼠的体重具有一定的降低作用[28]。但是,到目前为止,APS是否可能通过调节肠道菌群发挥减肥作用仍不清楚。本研究旨在从肠道菌群调节的角度,研究APS的减肥作用与调节肠道菌群的关系,明确肠道菌群是APS发挥减肥作用的重要干预靶标。
1 材料
粪便DNA提取试剂盒(QIAGEN,德国,批号:154018883);Ion Torrent PGM系统(Life Technology,美国);胰岛素试剂盒(Rat/Mouse Insulin ELISA Kit Mercodia,瑞典,批号:24243);TG试剂盒(南京建成,批号:20151008,);T-CHO试剂盒(南京建成,批号:20151006);HDL-C试剂盒(上海荣盛生物药业有限公司,批号:20160202123),LDL-C试剂盒(上海荣盛生物药业有限公司,批号:20160201124);血糖试纸(德国罗氏诊断有限公司,批号:473101)。高脂饲料(60 kcal% Fat,Research Diets,美国,批号:15110407);黄芪多糖(纯度>90%,陕西慈缘生物技术有限公司)。
C57雄性小鼠,清洁级,由上海中医药大学实验动物中心提供。体重(20±2)g,购自上海斯莱克实验动物有限公司,许可证号SCXK(沪)2012-0002。饲养于上海中医大学动物实验中心。
2 方法
2.1 高脂诱导小鼠肥胖模型复制与动物处理 C57小鼠经过1周适应性的饲养后,将小鼠随机分为5组:正常对照组(Con组,n=10),高脂饮食组(HFD组,n=10),APS低剂量组(APS2%,n=10),APS中剂量组(APS4%,n=10),APS高剂量组(APS8%,n=10)。Con组给予正常小鼠饲料,HFD组给予高脂饲料、3组给药组在高脂饲料中分别添加低剂量(APS2%:20 g APS/kg HFD)、中剂量(APS4%:40 g APS/kg HFD)和高剂量(APS8%:80 g APS/kg HFD)的APS,所有动物连续喂养8周,期间每周测定动物体重1次。第8周末,所有动物禁食过夜,10%水合氯醛腹腔注射(100 μL/10 g体重)麻醉,心脏采血,室温放置30 min后,3 000 r/min离心10 min,收集血清用于后续检测。收集动物肝脏及睾丸周围白色脂肪组织,准确称重,经液氮快速冷冻后-80 ℃保存。收集盲肠内容物,经液氮快速冷冻后-80 ℃保存,用于肠道菌群分析。
2.2 血清生化指标检测 小鼠于实验第七周时禁食过夜,次日早晨使用血糖试纸断尾检测小鼠空腹血糖。血清TG、TC、HDL、LDL采用酶法,血清胰岛素采用ELISA法,严格按照试剂盒说明进行检测。
2.3 肝脏与白色脂肪组织病理学检测 将经过10%中性福尔马林固定24 h后的肝脏与白色脂肪组织,进行常规石蜡包埋,苏木素与伊红染色(HE),光学显微镜下观察肝脏脂肪变性程度及白色脂肪细胞的体积。
2.4 粪便细菌DNA提取与细菌16S rDNA测序分析 按照文献的方法[29],取50~100 mg盲肠内容物,采用粪便DNA提取试剂盒,提取细菌总DNA,并对提取的DNA样本进行质检,检验合格的样本用于后续的分析。采用16S rDNA V3区的通用引物V3R(5′CCTACGGGAGGCAGCAG 3′)和V3F(5′ATTACCGCGGCTGCTGG 3′)对质检合格的DNA样品进行扩增,并采用Ion Torrent PGM系统进行上机测序。采用FASTX Toolkit 0.0.13软件(http://hannonlab.cshl.edu/fastx_toolkit/index.html)对测序的结果进行过滤。要了解群体样本的物种构成就需要对序列进行聚类,将彼此相似度高的序列分成同一类,分成的一个类就是一个操作分类单元(Operational Taxonomic Units,OTU)。为了得到每个OTU的对应的物种分类信息,采用RDP classifer贝叶斯算法对97%相似水平的OTU代表序列进行分类,并在各个水平(界、门、纲、目、科、属、种)统计每个样品的群落组成[30]。根据各样品OTU组成和丰度的差异,计算样品间的相似度,绘制样品的相似度树,采用thetayc算法(http://www.mothur.org/wiki/Thetayc)进行群落相似度的主坐标分析(principal co-ordinates analysis,PcoA),以观察各组肠道菌的整体差异。基于OTU的相对丰度(样本中某一OTU的reads数/该样本总OTU的reads总数),计算不同水平下(如门)样本中各种菌在该样本中的比例,从而比较不同组别下肠道菌内部比例的差异。我们还选取了丰度在前100的OUT,基于这100个OTU的相对丰度,绘制热图(heatmap),从而直观地比较各组动物肠道菌的差别。
2.5 肠道菌移植试验 为了明确APS改变的肠道菌在APS的减肥效应中的作用,我们将提前经过4周HFD与含2% APS的HFD饮食喂养小鼠的粪便细菌移植给另外2组受体小鼠。动物饲养于具有独立净化通风的小鼠饲养笼(IVC,苏州市冯氏实验动物设备有限公司)系统中,受体小鼠分别标记为HFD_R与APS_R组,每组5只。供体小鼠粪便细菌制备方法参考已经发表的文献[31],并经过适当的修改,即受体小鼠在接受粪便移植前3 d连续灌胃给予广谱抗生素亚胺培南100 mg·kg-1·d-1,以尽可能清除动物自身的肠道菌。每日清晨收集新鲜供体小鼠的粪便,每组约取150 mg粪便混悬在1.5 mL无菌生理盐水中,静置分层,取含细菌的上清液对受体小鼠进行灌胃(100 μL/只)。受体小鼠于实验前8周给予正常饲料喂养,后4周更换为高脂饮食。
2.6 统计学方法 数据表示为均值±标准误,利用SPSS 16.0统计软件,计量资料采用双尾Student′st检验,以P<0.05为差异有统计学意义。
3 结果
3.1 APS明显抑制高脂喂养小鼠肥胖的形成 本研究表明,高脂饮食喂养8周,成功复制出肥胖小鼠模型,而在3个实验剂量下,APS明显抑制高脂饮食诱导的小鼠体重增长(图1A)。日均摄食量及能量摄入的数据分析表明,高脂及APS喂养各组动物日均摄食量明显低于正常饮食对照组(图1B),但是,各组间日均能量摄入没有明显差别(图1C)。与正常组相比,小鼠性腺周围白色脂肪重量及比例高脂喂养组明显增多,在APS喂养组明显降低(图1D-E)。褐色脂肪是小鼠重要的能量消耗器官,本研究发现,小鼠褐色脂肪的绝对重量在高脂饮食喂养明显增加,并在APS组显著降低,但是,各组动物褐色脂肪的比例没有明显差异(图1F-G),说明APS的减肥效应不是通过增加褐色脂肪的耗能实现的。基于本次研究中低剂量的APS即具有明显的减肥作用,我们选择正常、高脂及低剂量的APS组,对3组动物白色脂肪组织进行HE染色,结果表明高脂饮食喂养动物脂肪细胞体积明显增大,而APS喂养组脂肪细胞体积则显著缩小(图1H)。
注:A:各组小鼠体重增长曲线;B:小鼠平均日摄食量;C:小鼠平均日摄入能量;D-E:小鼠睾丸周围白色脂肪重量及系数(白色脂肪重量/体重*100%);F-G:小鼠褐色脂肪组织重量及系数(褐色脂肪重量/体重*100%);H:小鼠白色脂肪组织HE染色(n=5,200倍);*P<0.05,**P<0.01,***P<0.001,与正常对照组相比;#P<0.05,##P<0.01,###P<0.001与高脂饮食组相比;采用双尾t检验。
3.2 APS减轻高脂喂养小鼠肝脏脂肪变性 为了进一步了解APS对高脂喂养肥胖小鼠血清及肝脏脂质的影响,我们测定了各组小鼠血清TG,TC,HDL,LDL的水平,结果表明,我们意外发现,血清TG在高脂喂养组显著低于正常对照组,而APS组血清TG水平呈现剂量依赖性的升高趋势,高剂量的APS组基本与正常组相同(图2A),我们推测血清TG水平的变化与高脂饮食喂养的时间有关,而相似的结果也见于其他的研究报道[32-33],在我们后续的实验中发现当高脂喂养时间延长到12周以上时,小鼠血清TG水平明显升高(未发表数据)。与TG不同的是,血清TC,LDL,HDL的水平在高脂喂养小鼠组均明显高于正常对照组,而APS喂养对上述3种血清脂质的水平没有明显作用(图2B-D)。肝脏组织TG,TC检测结果表明,高脂喂养明显升高了小鼠肝脏TG水平,但TC水平没有明显升高,3种剂量下的APS喂养均明显降低了肝脏TG水平,有趣的是,肝脏TC水平只有在高剂量的APS组明显下降(图2E-F)。我们同样选择正常、高脂及低剂量的APS组作为代表,对3组动物的肝脏组织进行HE染色,结果显示高脂喂养组小鼠肝脏有明显的脂肪变性、脂质聚集现象,而即使是低剂量的APS也能明显改善高脂饮食所导致的肝脏脂肪变性程度(图2G)。
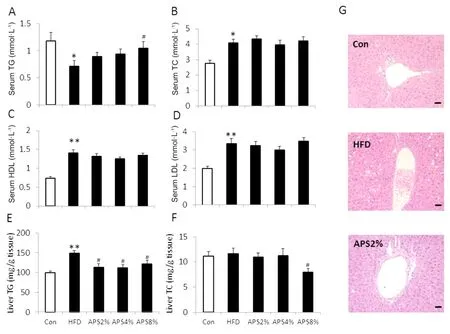
图2 APS减轻高脂喂养小鼠肝脏脂肪变性(n=10)
注:A-D:小鼠血清TG,TC,HDL,LDL水平;E-F:小鼠肝脏TG,TC水平;G:小鼠肝脏组织HE染色图片(n=5,200倍);*P<0.05,**P<0.01与正常对照组相比;#P<0.05与高脂饮食组相比;采用双尾t检验。
3.3 APS改善高脂喂养小鼠胰岛素敏感性 胰岛素抵抗是肥胖为基础的代谢性疾病的共同病理基础。为了进一步明确APS对于胰岛素敏感性的作用,我们分别测定了正常组、高脂饮食组及低剂量APS组动物空腹血糖及胰岛素的水平,结果表明,8周高脂饮食及APS干预后,各组动物空腹血糖水平没有明显差异(图3A),但是,空腹胰岛素的水平在高脂组明显升高,在低剂量的APS组明显降低(图3B),相应的HOMA-IR指数也表明APS明显改善了高脂喂养小鼠的胰岛素抵抗(图3C)。
3.4 APS明显改变高脂喂养小鼠的肠道菌群结构 为了明确APS的减肥作用与改变肠道菌群的关系,我们利用基于16S rDNA序列测定的元基因组学方法,分析了正常组、高脂饮食组及低剂量的APS组肠道菌群。3组样本间的PCoA图显示,高脂饮食喂养动物与正常对照组沿着第一主成分方向明显分离,第一主成分对于整体区分的贡献度达到43.61%,不过,正常组有一只动物与高脂饮食组位于第一主成分的同侧,说明该只动物的肠道菌群结构可能与高脂组相似。有趣的是,APS喂养组与正常组动物位于第一主成分的同侧,并明显与高脂组分离,说明APS喂养明显改变了高脂饮食喂养动物的肠道菌群结构(图4A)。为了进一步比较各组动物肠道菌群的差异,我们在门(phylum)的水平,比较了各个动物肠道菌群的组成。我们发现,在正常组及APS喂养组,拟杆菌与厚壁门菌占到所有细菌丰度的90%,而在高脂饮食喂养组仅70%左右,而变形菌门(Proteobacteria)细菌在高脂饮食组的丰度升高到25%左右(图4B)。上述结果表明,高脂饮食喂养明显改变了小鼠肠道菌群的结构,而APS则明显恢复了高脂饮食所改变的肠道菌组成。热图(heatmap)是以颜色的变化反映各种细菌在样本中的丰度变化。我们利用热图对相对丰度较大的前100个细菌OTU在门和属(genus)的水平进行比较,结果表明,高脂饮食喂养的确显著改变了部分OTU的相对丰度,而APS则部分逆转了高脂饮食的影响(图4C)。因此,APS喂养的确可以恢复高脂饮食所引起的肠道菌群改变。

图3 APS改善高脂喂养小鼠胰岛素敏感性(n=8)
注:A:空腹血糖水平;B:空腹胰岛素水平;C:HOMA-IR指数(空腹血糖(mmol·L-1)*空腹胰岛素(mIU·L-1)/22.5);*P<0.05与正常对照组相比;#P<0.05与高脂饮食组相比;采用双尾t检验。
3.5 APS喂养小鼠肠道菌移植明显降低小鼠体重增长 为了确定APS的减肥作用与其对高脂喂养动物的肠道菌群调节的关系,我们利用肠道菌移植的方法,将经过4周高脂饮食及APS喂养动物的肠道菌移植给另外2组小鼠,分别为HFD_R和APS_R,连续给予8周的正常饮食和4周的高脂饮食,具体方案见(图5A)。我们首先发现,接受高脂饮食及APS喂养的肠道菌供体小鼠体重具有明显的差异(图5B),与前述的实验结果一致(图5A)。肠道菌移植的受体小鼠在经过8周的正常饮食喂养情况下,2组小鼠的体重未见明显(图5C)。之后,我们将肠道菌移植受体小鼠的饮食更换为高脂饮食,继续喂养4周,结果发现,APS_R小鼠的体重增长速度明显低于HFD_R组(图5D),说明APS喂养小鼠的肠道菌可以降低高脂喂养小鼠的体重增长速度,但不影响正常饮食喂养下的小鼠体重增长,APS改变的动物肠道菌是APS发挥减肥作用的重要原因。
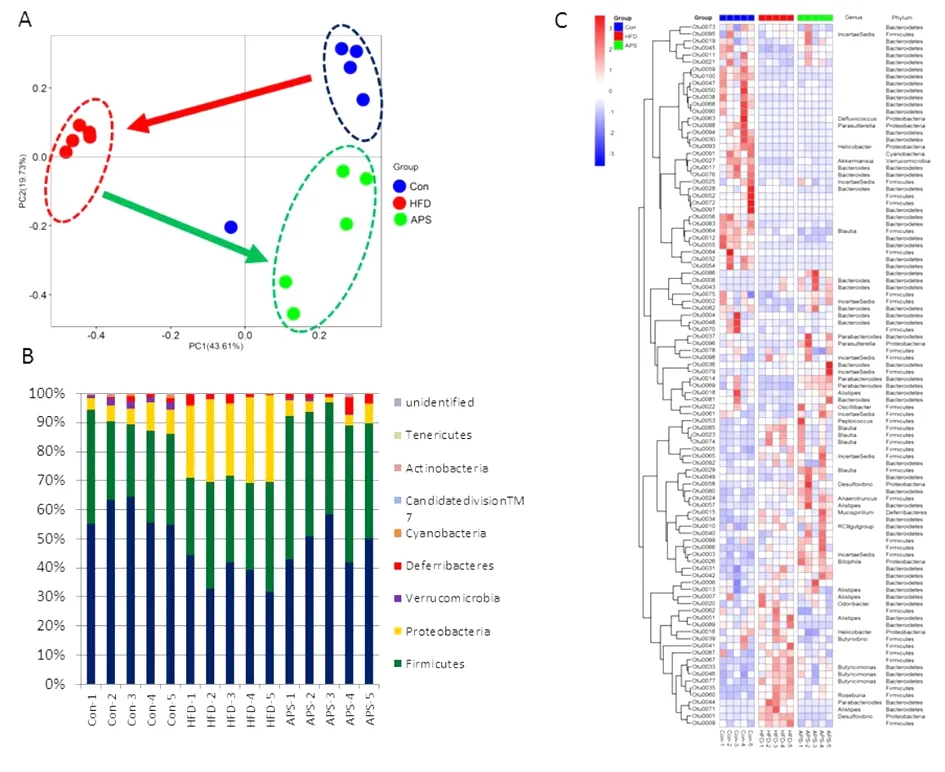
图4 APS明显改变高脂喂养小鼠的肠道菌群结构(n=5)
注:A:肠道菌群PCoA图;B:肠道菌群相对丰度柱形图;C:前100个OTU相对丰度的热图。
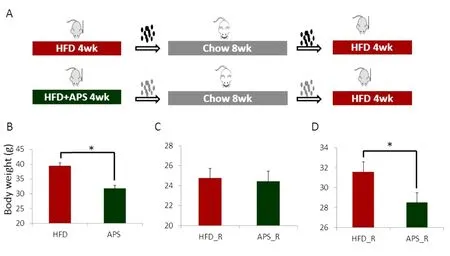
图5 APS喂养小鼠肠道菌移植降低高脂喂养小鼠体重增长(n=5)
注:A:肠道菌移植实验设计图;B:供体小鼠实验终点时的体重;C:肠道菌移植受体小鼠连续给予8周正常饮食后的体重;D:肠道菌移植受体小鼠继续给予高脂饮食4周后的体重;*P<0.05,采用双位t检验。
4 讨论
APS作为黄芪中的主要活性成分之一,以往的研究表明其对于高脂饮食喂养动物及糖尿病模型动物的胰岛素敏感性、葡萄糖代谢、血脂,及胆固醇均具有一定的调节作用[23-25,27-28]。但是,APS可能的减肥作用,以及减肥的机制并不清楚。我们本次研究表明,APS对于高脂饮食喂养小鼠肥胖的形成具有明确的抑制作用,并能显著改善模型动物的肝脏脂肪变性及胰岛素敏感性。我们还发现,APS不仅能明显恢复高脂喂养小鼠紊乱的肠道菌群结构,而且,APS喂养小鼠的肠道菌移植能够明显降低小鼠接受高脂饮食喂养后的体重增长速度,说明APS的减肥作用是通过,或至少部分通过改变小鼠的肠道菌而实现的,而肠道菌的这种作用只有在高脂饮食条件下才能发挥,说明APS所改变的肠道菌降低了动物从高脂饮食中能量的摄取。
越来越多的证据表明,肠道菌群在肥胖形成中扮演了极其重要的作用[34],因而肠道菌群被认为是潜在的药物干预的重要靶标[16]。利用益生菌、益生元、抗生素或中药等手段,扰动宿主的肠道菌群结构,从而达到改善机体糖脂代谢、胰岛素抵抗及降低体重的目的,被认为是研发安全有效的肥胖及代谢性疾病防治药物的重要途径[35-38]。植物多糖是在多种天然产物中普遍存在的一大类活性成分,虽然其在哺乳动物胃肠道的吸收效率很低,但研究表明植物多糖大多具有广泛的药理效应,尤其是对于机体免疫功能、糖脂及能量代谢的调节作用往往被认为与肠道菌群的调节密切相关[39-41]。研究表明,灵芝多糖通过改变高脂喂养小鼠的肠道菌群结构,从而明显减轻高脂饮食喂养小鼠肥胖的形成[31,42]。麦冬多糖MDG-1对膳食诱导的肥胖小鼠肠道菌紊乱具有明显的改善作用,表现为增加益生菌台湾乳杆菌与鼠乳杆菌的数量[43]。此外,研究表明,麦冬多糖MDG-1改善糖尿病小鼠的胰岛素抵抗与降低糖尿病小鼠肠道内大肠杆菌与链球菌的丰度,促进双歧杆菌的增殖有关[44]。本研究中,我们发现革兰氏阴性菌变形菌门细菌丰度在高脂饮食小鼠中显著升高,而拟杆菌与厚壁门菌的相对丰度明显下降,APS则能够有效恢复高脂饮食所导致的肠道菌总体结构变化。我们认为,不同组成的植物多糖尽管对于机体糖脂代谢可能具有相似的调节作用,但是,在对肠道菌群的影响上应该存在异同性。本研究中发现的APS所改变的肠道菌,哪些种属的细菌可能是其发挥减肥效应的关键仍在进一步的研究中。
不同来源的植物多糖在分子量大小及糖的组成上存在较大差异。冯怡等人在麦冬多糖中分离获得的,具有明显活性的MDG-1是分子量在5 000左右的2→1链接的呋喃型β-D-果聚糖[43],而在灵芝多糖中,研究人员发现具有减肥效应的主要为灵芝多糖中分子量>300 kDa的多糖组份,其组成主要由47.5%甘露糖(mannose)、26.3%葡萄糖(glucose)、16.9%半乳糖(galactose),以及少量的半乳糖胺(galactosamine)、阿拉伯糖(arabinose)、葡萄糖胺(glucosamine)、海藻糖(fucose)等[31]。目前,黄芪粗多糖根据其提取方法不同,鉴定出的多糖主要包括水溶性与水不溶性的α葡聚糖、水溶性酸性杂多糖等类型[45],不过,目前为止,APS的功效研究主要是以粗多糖为主,APS的不同组份与其功效之间的关系仍不清楚。本次研究所使用的APS也为黄芪中纯度>90%的粗多糖成分,下一步我们将进一步确认具有减肥效应的APS多糖化学组成,深入探讨APS通过调节肠道菌群,调控宿主能量代谢通路,从而发挥减肥作用的分子机制。
[1]Matsuda M,Shimomura I.Roles of adiponectin and oxidative stress in obesity-associated metabolic and cardiovascular diseases[J].Rev Endocr Metab Disord,2014,15(1):1-10.
[2]Murphy K G.Editorial overview:Endocrine and metabolic diseases:Waistline weapons:new therapeutic avenues for the treatment of obesity and metabolic disease[J].Curr Opin Pharmacol,2015,25:iv-vi.
[3]Koot B G,De Groot E,Van Der Baan-Slootweg O H,et al.Nonalcoholic fatty liver disease and cardiovascular risk in children with obesity[J].Obesity(Silver Spring),2015,23(6):1239-1243.
[4]Bhupathiraju S N,Hu F B.Epidemiology of Obesity and Diabetes and Their Cardiovascular Complications[J].Circ Res,2016,118(11):1723-1735.
[5]Shamseddeen H,Getty J Z,Hamdallah I N,et al.Epidemiology and economic impact of obesity and type 2 diabetes[J].Surg Clin North Am,2011,91(6):1163-1172,vii.
[6]Ziyyat A,Ramdani N,Bouanani Nel H,et al.Epidemiology of hypertension and its relationship with type 2 diabetes and obesity in eastern Morocco[J].Springerplus,2014,3:644.
[7]Hofbauer K G.Molecular pathways to obesity[J].Int J Obes Relat Metab Disord,2002,26(Suppl 2):S18-27.
[8]Mantzoros C S.The role of leptin in human obesity and disease:a review of current evidence[J].Ann Intern Med,1999,130(8):671-680.
[9]Backhed F,Ding H,Wang T,et al.The gut microbiota as an environmental factor that regulates fat storage[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(44):15718-15723.
[10]Gerard P.Gut microbiota and obesity[J].Cell Mol Life Sci,2016,73(1):147-162.
[11]Greenhill C.Obesity:Gut microbiota,host genetics and diet interact to affect the risk of developing obesity and the metabolic syndrome[J].Nat Rev Endocrinol,2015,11(11):630.
[12]Miele L,Giorgio V,Alberelli M A,et al.Impact of Gut Microbiota on Obesity,Diabetes,and Cardiovascular Disease Risk[J].Curr Cardiol Rep,2015,17(12):120.
[13]Qian L L,Li H T,Zhang L,et al.Effect of the Gut Microbiota on Obesity and Its Underlying Mechanisms:an Update[J].Biomed Environ Sci,2015,28(11):839-847.
[14]Li H,Jia W.Cometabolism of microbes and host:implications for drug metabolism and drug-induced toxicity[J].Clin Pharmacol Ther,2013,94(5):574-581.
[15]O′hara A M,Shanahan F.The gut flora as a forgotten organ[J].Embo Reports,2006,7(7):688-693.
[16]Jia W,Li H,Zhao L,et al.Gut microbiota:a potential new territory for drug targeting[J].Nat Rev Drug Discov,2008,7(2):123-129.
[17]Bengmark S.Gut microbiota,immune development and function[J].Pharmacol Res,2013,69(1):87-113.
[18]Kamada N,Chen G Y,Inohara N,et al.Control of pathogens and pathobionts by the gut microbiota[J].Nat Immunol,2013,14(7):685-690.
[19]Ley R E,Backhed F,Turnbaugh P,et al.Obesity alters gut microbial ecology[J].Proc Natl Acad Sci U S A,2005,102(31):11070-11075.
[20]Turnbaugh P J,Ley R E,Mahowald M A,et al.An obesity-associated gut microbiome with increased capacity for energy harvest[J].Nature,2006,444(7122):1027-1031.
[21]Holmes E,Kinross J,Gibson G R,et al.Therapeutic modulation of microbiota-host metabolic interactions[J].Sci Transl Med,2012,4(137):137rv6.
[22]Zhang J,Xie X,Li C,et al.Systematic review of the renal protective effect of Astragalus membranaceus(root)on diabetic nephropathy in animal models[J].J Ethnopharmacol,2009,126(2):189-196.
[23]王涛,魏学娟,翁孝刚,等.黄芪多糖对肥胖大鼠胰岛素敏感性的影响[J].中国药学杂志,2011,46(3):3.
[24]翁孝刚,梁辉,王涛,等.黄芪多糖对高脂喂养肥胖大鼠胰岛素敏感性的影响[J].西安交通大学学报:医学版,2009,30(5):4.
[25]毛先晴,欧阳静萍.黄芪多糖对饮食诱导小鼠肝脏胰岛素抵抗的预防作用[J].中国病理生理杂志,2007,23(11):4.
[26]童红莉,田亚平,汪德清,等.黄芪多糖对高脂血症大鼠血脂的调节[J].中国临床康复,2006,10(11):3.
[27]Cheng Y J,Tang K,Wu S H,et al.Astragalus Polysaccharides Lowers Plasma Cholesterol through Mechanisms Distinct from Statins[J].Plos One,2011,6(11):11.
[28]Mao X Q,Yu F,Wang N,et al.Hypoglycemic effect of polysaccharide enriched extract of Astragalus membranaceus in diet induced insulin resistant C57BL/6J mice and its potential mechanism[J].Phytomedicine,2009,16(5):416-425.
[29]Zhang X,Zhao Y,Zhang M,et al.Structural changes of gut microbiota during berberine-mediated prevention of obesity and insulin resistance in high-fat diet-fed rats[J].PLoS One,2012,7(8):e42529.
[30]Cole J R,Wang Q,Cardenas E,et al.The Ribosomal Database Project:improved alignments and new tools for rRNA analysis[J].Nucleic Acids Res,2009,37(Database issue):D141-145.
[31]Chang C J,Lin C S,Lu C C,et al.Ganoderma lucidum reduces obesity in mice by modulating the composition of the gut microbiota[J].Nat Commun,2015,6:7489.
[32]任亚浩,李岩溪,赵越,等.白藜芦醇对C57BL_6J小鼠脂代谢的影响[J].卫生研究,2011,40(4):495-497.
[33]刘芳.不同品系小鼠肥胖模型比较、肥胖机制研究&LRTG减肥作用及作用机理探讨[D].北京:北京协和医学院,2013.
[34]Hersoug L G,Moller P,Loft S.Gut microbiota-derived lipopolysaccharide uptake and trafficking to adipose tissue:implications for inflammation and obesity[J].Obes Rev,2016,17(4):297-312.
[35]Velayudham A,Dolganiuc A,Ellis M,et al.VSL#3 probiotic treatment attenuates fibrosis without changes in steatohepatitis in a diet-induced nonalcoholic steatohepatitis model in mice[J].Hepatology,2009,49(3):989-97.
[36]Wang J,Tang H,Zhang C,et al.Modulation of gut microbiota during probiotic-mediated attenuation of metabolic syndrome in high fat diet-fed mice[J].ISME J,2015,9(1):1-15.
[37]Fan J G,Xu Z J,Wang G L.Effect of lactulose on establishment of a rat non-alcoholic steatohepatitis model[J].World J Gastroenterol,2005,11(32):5053-5056.
[38]Duseja A,Chawla Y K.Obesity and NAFLD:the role of bacteria and microbiota[J].Clin Liver Dis,2014,18(1):59-71.
[39]Yang J,Bindels L B,Segura Munoz R R,et al.Disparate Metabolic Responses in Mice Fed a High-Fat Diet Supplemented with Maize-Derived Non-Digestible Feruloylated Oligo-and Polysaccharides Are Linked to Changes in the Gut Microbiota[J].PLoS One,2016,11(1):e0146144.
[40]Conlon M A,Topping D L.Dietary polysaccharides and polyphenols can promote health by influencing gut microbiota populations[J].Food Funct,2016,7(4):1730.
[41]Zhou S S,Xu J,Zhu H,et al.Gut microbiota-involved mechanisms in enhancing systemic exposure of ginsenosides by coexisting polysaccharides in ginseng decoction[J].Sci Rep,2016,6:22474.
[42]王令仪,王硕,王源,等.麦冬多糖MDG-1对糖尿病小鼠糖耐量及肠道菌群的影响[J].世界华人消化杂志,2011,19(19):5.
[43]Xu J,Wang Y,Xu D S,et al.Hypoglycemic effects of MDG-1,a polysaccharide derived from Ophiopogon japonicas,in the ob/ob mouse model of type 2 diabetes mellitus[J].International Journal of Biological Macromolecules,2011,49(4):657-662.
[44]石林林,王源,冯怡.麦冬多糖MDG-1对膳食诱导肥胖模型小鼠肠道益生菌群多样性影响的研究[J].中国中药杂志,2015,40(4):6.
[45]单俊杰,王顺春,刘涤,等.黄芪多糖的化学和药理研究进展[J].上海中医药大学学报,2000,14(3):5.
(2016-10-27收稿 责任编辑:洪志强)
Study on Anti-Obesity Effect and Modulation of Gut Microbiota by Astragalus Polysaccharides in Mice
He Xuyun1, He Jiaojiao1, Zheng Ningning1, Wang Shunchun2, Li Houkai1
(1CenterforChineseMedicalTherapyandSystemBiology,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 2InstituteofChineseMateriaMedica,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China)
Objective:To explore relationships between the anti-obesity effect and modulation of gut microbioata by APS in high-fat diet (HFD)-fed mice.Methods:1. A total of 50 male C57bl/6J mice were randomly divided into five groups including control group (Con), HFD group, and three APS groups with low, middle and high dosages (2 %, 4 %, 8 % APS mixed in HFD). All animals were fed with corresponding diet for consecutive eight weeks during which their body weight was measured weekly. At the end of the experiment, fecal samples were collected for analysis of gut microbiota by 16S rDNA sequencing approach. 2. To investigate the contribution of gut microbiota to body weight reduction of APS, two groups of mice (n=5/each group) were transplanted with intestinal bacteria from mice that were fed with or without APS (2 % APS in HFD). The receiver mice were designated as HFD_R and APS_R, respectively. The receiver mice were fed with chow diet for consecutive eight weeks first, and then switched to HFD for another four weeks.Results:APS effectively suppressed the HFD-induced obesity formation, attenuated the hepatic steatosis, decreased hepatic TG level, improved insulin sensitivity, restored the balance of gut microbiota in HFD-fed mice by increasing the relative abundance of Bacteroidetes and Firmicutes, and reducing the abundance of Proteobacteria bacteria. Moreover, the anti-obesity effect of APS could be transferred to mice that were transplanted with intestinal bacteria from APS-fed mice in the context of HFD, but not chow diet.Conclusion:APS could inhibit the HFD-induced obesity formation, at least partially, by modulating gut microbiota.
Astragalus polysaccharides; Obesity; Gut microbiota; Insulin sensitivity; Hepatic steatosis; 16S rDNA
国家自然科学基金项目(编号:81673662),上海市科委“浦江人才”计划(编号:14PJD031),上海市教委一流学科创新项目(编号:ZYX-CXYJ-017),上海市高校特聘教授(东方学者)人才计划(2014),上海市教委“曙光学者”人才计划(2016)
何旭云,硕士研究生,Tel:(021)51322748,E-mail:hexuyun@qq.com
李后开,男,研究员,博士研究生导师,研究方向:中药防治肥胖及脂肪肝的机理研究,Tel:(021)51322748,E-mail:houkai1976@126.com
R285.5
A
10.3969/j.issn.1673-7202.2016.11.046

