饥饿对家蚕DefensinA和DefensinB表达水平的影响
杨伟克,唐芬芬,刘增虎,钟 健,董占鹏
(云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661101)
饥饿对家蚕DefensinA和DefensinB表达水平的影响
杨伟克,唐芬芬,刘增虎,钟 健,董占鹏*
(云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661101)
通过不同时间饥饿处理5龄3 d家蚕,采用实时荧光定量PCR检测脂肪体DefensinA和DefensinB表达情况。结果显示,家蚕饥饿处理8,16,24 h后,DefensinB表达量均呈现上调趋势,其中饥饿16 h时DefensinB表达量上调最为明显,而DefensinA几乎无上调表达趋势。结果说明饥饿胁迫能诱导抗菌肽基因DefensinB的表达。
家蚕;饥饿;DefensinA和DefensinB; 实时荧光定量PCR
抗菌肽(Antibacterial pepetides,AMPs)是一类普遍存在的防御性蛋白质,具有分子量小、理化性能稳定和广谱抗菌等特点,在昆虫先天免疫防御系统(体液免疫和肠道免疫)中发挥着重要的作用[1-2]。目前对家蚕抗菌肽基因表达调控的研究大多集中在生物因素(喂食或注射微生物)或特定化学因素(脂多糖LPS和肽聚糖PGN等)诱导的免疫反应模式[3-5],物理和环境胁迫等因素诱导家蚕抗菌肽基因表达的研究相对较少。
昆虫防御素(Insect defensins)是一类富含半胱氨酸的阳离子抗菌肽,通常含有6个保守的半胱氨酸(Cys)残基,形成3个分子内二硫键(Cys-Cys),呈反向平行折叠结构[6-7]。最近在对家蚕抗菌肽基因的研究中发现2个defensin成员,即DefensinA和DefensinB[8-9]。
众所周知,昆虫不但生活在充满各种微生物的环境中,随时随地受到细菌、真菌、病毒的挑战,同时也受到多种环境胁迫的影响,比如饥饿的威胁、温度和湿度的变化等[10-11]。环境胁迫可能对昆虫造成2方面的不良影响:一是影响昆虫的生长、发育、生殖,二是影响昆虫的免疫系统,导致昆虫防御外源异物侵袭能力的下降。
本研究对鳞翅目昆虫家蚕进行饥饿处理,利用实时荧光定量PCR对家蚕脂肪体2个抗菌肽基因DefensinA和DefensinB的表达进行定量检测和分析,探讨饥饿对DefensinA和DefensinB表达水平的影响。
1 材料与方法
1.1 供试昆虫
供试家蚕为932品系,人工孵化,在恒温培养箱于25 ℃桑叶饲养至5龄3 d的幼虫。
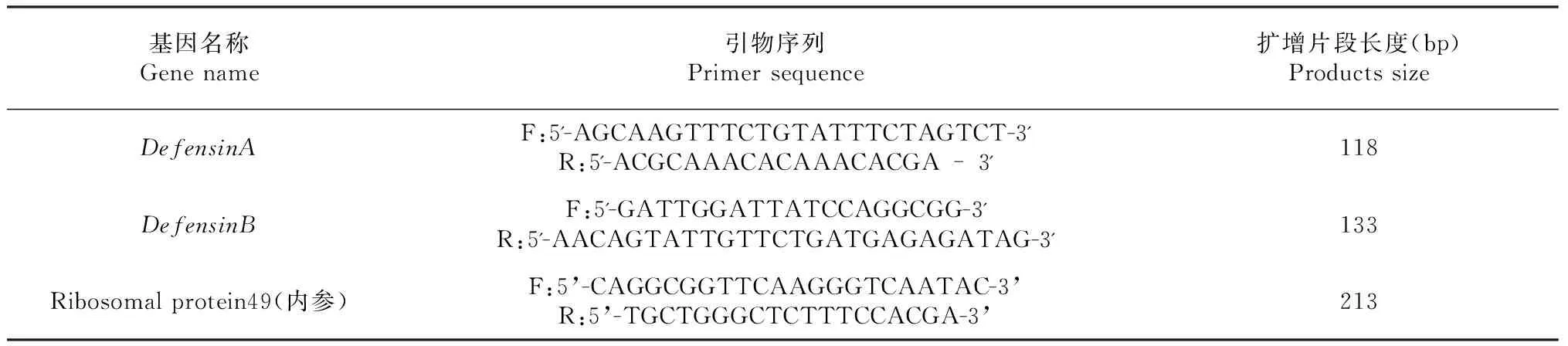
表1 实时荧光定量PCR引物
1.2 试验主要仪器和试剂
主要仪器:PCR扩增仪,琼脂糖凝胶电泳仪,凝胶成像系统,低温高速离心机,恒温培养箱。主要试剂:Trizol Reagents(Invitrongen公司),ReverTra Ace和Real-Time PCR Master Mix(TOYOBO公司)等。
1.3 方法
1.3.1 饥饿处理及样品采集 取发育良好、体重和大小相当的家蚕5龄3 d幼虫,分成2组:一组进行饥饿处理,另一组为对照。饥饿组从5龄3 d上午9:00时开始停止喂食,对照组正常进食,在饥饿处理8、16和24 h后,分别从对照组和饥饿组取10头家蚕幼虫,用脱脂棉蘸取75 %的酒精进行体表消毒、晾干,将家蚕表皮剪开,用镊子刮取脂肪体,每次取样均设3次重复,样品收集后置于-80 ℃保存备用。
1.3.2 总RNA的提取及检测 按照TRIzol Reagent RNA试剂盒操作说明提取脂肪体RNA,将得到的总RNA用试剂盒纯化,并用DNase I处理以去除基因组DNA。通过上述方法制备的RNA,用1 %琼脂糖TBE凝胶电泳检测RNA质量,UVP凝胶成像系统紫外灯下观察并记录RNA样品的抽提效果。用无RNase水稀释2 μl总RNA样品至100 μl,在核酸蛋白分析仪上分别测出OD260、OD280、OD260/OD280的值,取OD260/OD280比值在1.70~2.0的样品,用于下一步实验。并根据RNA的OD260值算出总RNA样品的浓度。
RNA浓度(μg/mL)=(△A260nm/0.024×L)×稀释倍数
1.3.3 cDNA第一链的合成 按照TOYOBO公司 ReverTra Ace试剂使用说明书进行,在无RNAase的离心管中加入下列各物质:RNA 0.4 μg,Oligo(dT) 25 pmoles,5×Buffer 4 μl,dNTPs (10 mM) 2 μl, ReverTra Ace (100 U/μl) 1 μl,RNase Inhibitor 20 U,DEPC水补足体积,反应总体积20 μl,置42 ℃下反应30 min,反应产物作为普通PCR扩增和实时荧光定量PCR检测的模板。
1.3.4 引物设计与合成 根据GeneBank中收录的DefensinA(登录号:AB367525)、DefensinB(登录号AB428671)和内参基因Ribosomal protein 49(RP49,登录号:NM_001098282)序列,利用引物设计软件Primer Premier5.0设计引物。实验所用的引物序列及扩增片段长度见表1。
1.3.5 目的基因的PCR扩增 利用表1中的特异性引物,以反转录得到的家蚕cDNA为模板进行PCR扩增。按照TaKaRa公司 TaKaRaTaqTM试剂盒使用说明书进行。PCR反应程序:94 ℃,5 min → (94 ℃,30 s → 55~65 ℃,30 s→72 ℃,30 s)× 33 cycles → 72 ℃,10 min → 4 ℃,∞。用2 %琼脂糖凝胶电泳检测PCR产物。在5 v/cm的电压下进行电泳,25~30 min后在UVP凝胶成像系统上观察并记录结果。
1.3.6 实时荧光定量PCR检测 荧光定量PCR方法参照Real-time PCR Master Mix 试剂盒(日本TOYOBO公司产品)操作说明进行。PCR反应参数:95 ℃,1 min → [95 ℃,15 s→ 55~65 ℃,30 s→ 72 ℃,45 s(data collection)]×40 cycles → dissociation curve。
由美国ABI实时荧光定量PCR反应仪记录实验结果,每个样本中靶基因A 3个重复的值分别为CtA1、CtA2、CtA3,平均值CtA=(CtA1+CtA2+CtA3)/3。每个样本中靶基因A 的CtA值与内参Ctrp49的差以△CtA表示,则△CtA=CtA-Ctrp49。处理后样品中靶基因A的△Ct值以△CtA’表示,未处理样品中靶基因A的△Ct值以△CtA表示。处理后相对于处理前的△△Ct值以△△CtA’,A表示,则△△CtA’,A=△CtA’-△CtA。根据Livak(2001)等报道的方法,基因A在处理后样品中相对于未处理样品中的相对转录水平变化则可用2-△△CtA’,A表示[12]。
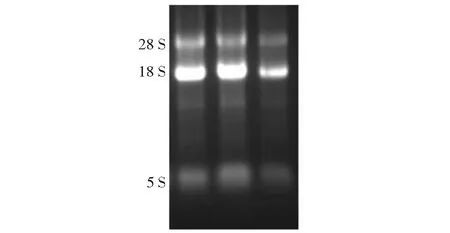
图1 抽提RNA的琼脂糖电泳检测Fig.1 Agarose gel electrophoresis for extracted RNA

电泳图a和b中各点样孔的样品为M:DL2000 Marker;1~3为饥饿组的扩增样品;4~6为正常对照组的扩增样品;7是未加模板的阴性对照The sample in each hole of figure a and b were those M shows DL2000 DNA Marker; 1-3 showed the amplification of starvation sample respectively;4-6 showed the amplification of contral sample respectively;7 showed the amplification of negative control template图2 DefensinA和DefensinB基因的普通PCR 扩增Fig.2 The PCR amplification of DefensinA and DefensinB
2 结果与分析
2.1 RNA质量检测与浓度计算
抽提的各样品总RNA的 OD260/OD280值在1.7~2.0,RNA电泳显示2条清晰的28SrRNA和18SrRNA泳带(图1),说明总RNA样品符合实验要求,同时测算样品中的RNA浓度,用于反转录。
2.2 目的基因的PCR扩增及检测
进行荧光定量PCR 反应之前,先以饥饿组和对照组的脂肪体cDNA为模板,进行普通PCR扩增和检测,其目的一是明确家蚕DefensinA和DefensinB基因引物的特异性,以及是否有明显的引物二聚体产生;二是初步检测饥饿处理后基因在家蚕脂肪体中的大概转录情况,为实时荧光定量PCR检测提供定性参考。
图2表明,基因(DefensinA,DefensinB)的引物都能从cDNA中检测到转录,没有明显的引物二聚体条带出现,说明这些设计的引物可以用于荧光实时定量PCR检测。
2.3 Real-time PCR检测DefensinA和DefensinB对饥饿诱导的响应
利用实时荧光定量PCR(Real-time PCR)技术,对不同时间(8、16和24 h)饥饿处理的家蚕DefensinA和DefensinB进行定量分析,结果如图3所示。从图3可以看出,饥饿处理家蚕8、16和24 h,DefensinB的转录活性都明显被上调,其中饥饿16 h时DefensinB相对转录水平上调最为明显;而DefensinA转录活性变化不明显,仅在饥饿24 h时有微小上调。
3 讨 论
家蚕抗菌肽的产生主要由Toll和IMD 2条信号通路介导产生,其中Toll信号通路主要由真菌和革兰氏阳性菌激活,IMD信号途径主要由革兰氏阳性菌激活[13]。Toll途径和IMD途径都有相应的模式识别蛋白以对外源微生物进行识别。细菌细胞壁和细胞膜上的肽聚糖(PGN)、脂多糖(LPS)和甘露聚糖(Mannan)等被称为病原相关的模式分子(Pathogen-associated molecular patterns, PAMPs),这些模式分子能被相应的受体识别,而识别它们的相应受体被称为模式识别受体(Pattern recognition receptors, PRRs),PRRs识别PAMP分别激活Toll和IMD途径,最后激活NF-κB样蛋白(Rel蛋白超家族成员:在Toll通路中为Dorsal/Dif蛋白;在IMD通路中为Relish蛋白),NF-κB样蛋白作为转录因子与AMPs基因上游的NF-κB位点结合,启动抗菌肽基因的表达[14-16]。
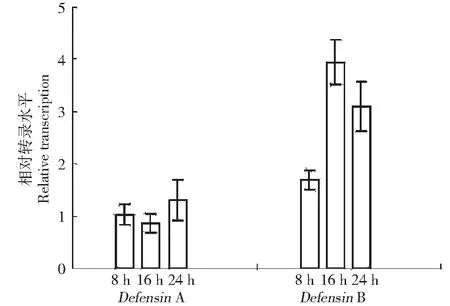
图3 Real-time PCR检测DefensinA和DefensinB的相对转录水平Fig.3 The relative transcription of DefensinA and DefensinB detected by real-time PCR
由本试验结果看,对家蚕5龄幼虫给予适当饥饿处理,抗菌肽基因DefensinB被诱导表达。但是家蚕脂肪体细胞对饥饿信号的识别,显然不是通过PRRs机制的Toll和IMD信号通路实现NF-κB样蛋白转录因子与NF-κB位点结合启动抗菌肽的表达。当食物缺乏或是遭受饥饿的胁迫时,生物体自身代谢变慢,相应的免疫力会有所下降或减弱,这时机体为了预防外来病原微生物的入侵,很有可能会通过其他途径主动提高或增强自身免疫[17-18]。Becker等人的研究发现,双翅目昆虫果蝇类胰岛素水平的变化能影响AMPs基因的表达,即在果蝇处于非感染条件下,给予饥饿处理,其类胰岛素(Insulin-like signaling, ILS)信号水平下降,从而介导 FoxO 转录因子(fork-head transcript factor)调控果蝇抗菌肽Drosomycin基因的表达,并且已证实饥饿诱导Drosomycin的表达不依赖于NF-κB因子[19]。家蚕DefensinB与果蝇Drosomycin同属于阳离子抗菌肽,饥饿是否也通过影响家蚕的胰岛素水平进而介导FoxO转录因子调控家蚕DefensinB的表达,有待进一步后续研究。
[1]覃志彪, 梁静真, 龙 苏,等. 抗菌肽对凡纳滨对虾生产性能及机体成分的影响[J]. 南方农业学报, 2016, 47(4):674-678.
[2]Bulet P, St O Cklin R, Menin L. Anti-microbial peptides:from invertebrates to vertebrates[J]. Immunological Reviews, 2004, 198(1):169-184.
[3]唐芬芬, 杨伟克, 张永红,等. 喂食家蚕核型多角体病毒诱导家蚕抗菌肽基因表达[J]. 南方农业学报, 2015, 46(12):2191-2195.
[4]许平震. 家蚕先天免疫的模式识别、信号传导和抗微生物肽基因表达调控机制研究[D]. 重庆:西南大学, 2010.
[5]唐芬芬, 杨伟克, 邵榆岚, 等. 致病菌与非致病菌诱导对家蚕抗菌肽基因defensinA/B的表达定量分析[J]. 西南农业学报, 2013, 26(3):1282-1285.
[6]孙雁霞, 邬晓勇, 何 钢, 等. Defensin抗菌肽的序列特性分析[J]. 成都大学学报:自然科学版, 2010, 29(2):101-103.
[7]王义鹏, 赖 仞. 昆虫抗菌肽结构, 性质和基因调控[J].动物学研究, 2010, 31(1):27-34.
[8]Kaneko Y, Tanaka H, Ishibashi J, et al. Gene expression of a novel defensin antimicrobial peptide in the silkworm,Bombyxmori[J]. Bioscience,Biotechnology and Biochemistry, 2008, 72(9):2353-2361.
[9]Wen H, Lan X, Cheng T, et al. Sequence structure and expression pattern of a novel anionic defensin-like gene from silkworm (Bombyxmori)[J]. Molecular Biology Reports, 2009, 36(4):711-716.
[10]曾 兰, 林 勇, 张永德, 等. 低温胁迫后不同回温速度下吉富品系尼罗罗非鱼昏迷率和死亡率研究[J]. 西南农业学报, 2014, 27(2):878-885.
[11]常 虹, 孙海莲, 董 玮,等. 环境因子对步甲昆虫的影响研究进展[J]. 安徽农业科学, 2014,42(23):7754-7756.
[12]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-[Delta][Delta]CT method[J]. Methods, 2001, 25(4):402-408.
[13]Aggarwal K, Silverman N. Positive and negative regulation of theDrosophilaimmune response[J]. BMB Reports, 2008, 41(4):267-277.
[14]Kurata S. Recognition of infectious non-self and activation of immune responses by peptidoglycan recognition protein (PGRP)-family members inDrosophila[J]. Dev Comp Immunol, 2004, 28(2):89-95.
[15]程廷才, 王根洪, 李 娟, 等. 昆虫抗菌肽基因表达调控机理[J].蚕学通讯, 2004, 24(3):20-26.
[16]Lemaitre B, Hoffmann J. The host defense ofDrosophilamelanogaster[J]. Annu. Rev. Immunol, 2007, 25:697-743.
[17]Tsuzuki S, Ochiai M, Matsumoto H, et al.Drosophilagrowth-blocking peptide-like factor mediates acute immune reactions during infectious and non-infectious stress[J]. Scientific Reports, 2012(2):210.
[18]Guo L, Karpac J, Tran S L, et al. PGRP-SC2 promotes gut immune homeostasis to limit commensal dysbiosis and extend lifespan[J]. Cell, 2014, 156(1):109-122.
[19]Becker T, Loch G, Beyer M, et al. FOXO-dependent regulation of innate immune homeostasis[J]. Nature, 2010, 463(7279):369-373.
(责任编辑 王家银)
Effects of Starvation onDefensinAandDefensinBExpression in Silkworm,Bombyxmori
YANG Wei-ke,TANG Fen-fen,LIU Zeng-hu,ZHONG Jian,DONG Zhan-peng*
(Institute of Sericulture and Apiculture,Yunnan Academy of Agricultural Sciences,Yunnan Mengzi 661101,China)
In this study,the real-time fluorescent quantitative PCR was applied to analyze the expression ofDefensinAandDefensinBin fat body ofBombyxmoriwhich were treated with starvation at different time after fed to fifth instar and third days.The results revealed that the expression ofDefensinBin the fat body ofBombyxmoriwith starvation-treated for 8,16 and 24 h present a trend of increase, moreover the expression quantity increase was most obvious at 16 h,whereas the expression ofDefensinAdisplayed weekly response. These suggested that the expression of Antibacterial pepetides geneDefensinBmight be induced by starvation in silkworm.
Bombyxmori; Starvation;DefensinAandDefensinB; Real-time fluorescent quantitative PCR
1001-4829(2016)12-3019-04
10.16213/j.cnki.scjas.2016.12.044
2015-02-06
国家自然科学基金项目(31360586);云南省农业科学院蚕桑蜜蜂研究所青年创新基金项目(QC2015002)
杨伟克(1985-),男,助理研究员,硕士,主要从事野蚕资源搜集与利用研究工作,E-mail:WKSUN1985@163.com,*为通讯作者,E-mail:scsdong@163.com。
S88
A

