Napsin A、TTF-1与ERCC1表达对肺癌患者预后状况的临床预测价值
陈晓露,吴蓉宜,罗 昊△
(1.乐山职业技术学院,四川乐山 614000;2.四川省成都市第六人民医院 610051)
Napsin A、TTF-1与ERCC1表达对肺癌患者预后状况的临床预测价值
陈晓露1,吴蓉宜2,罗 昊1△
(1.乐山职业技术学院,四川乐山 614000;2.四川省成都市第六人民医院 610051)
目的 探讨Napsin A、TTF-1与ERCC1的表达对肺癌患者预后状况的临床预测价值。方法 采用免疫组化SP方法检测Napsin A、TTF-1、ERCC1在50例肺癌组织中的表达情况,另选取30例癌旁正常组织作为对照。结果 Napsin A在肺癌组织中的阳性表达率80.00%,低于癌旁正常组织100%;TTF-1与ERCC1则在肺癌组织中呈高表达(P<0.05)。Napsin A和TTF-1的阳性表达与肺癌组织类型有密切关系(P<0.05),Napsin A的阳性表达与分化程度呈正相关,差异有统计学意义(P<0.05)。Kaplan-Meier生存分析显示,ERCC1阳性表达者总生存率优于阴性表达者(P<0.05)。结论 Napsin A、TTF-1与ERCC1与肺癌的发生、发展有关,检测其表达水平有利于医师判别患者的病情变化,且可作为判断预后的重要指标之一。
Napsin A;TTF-1;ERCC1;肺肿瘤
肺癌是临床上常见的恶性肿瘤之一,发病率和病死率都极高,严重威胁着人民的健康和生命[1]。其发病机制至今尚不完全明确,常常由于早期诊断不足,治疗不及时,导致其预后较差[2]。目前尚未发现较为理想的肿瘤标志物来指导该种肿瘤的及早发现。本研究采用免疫组化SP方法检测Napsin A、TTF-1、ERCC1在肺癌组织中的表达情况,分析其阳性表达对肺癌患者预后状况的影响,为肺癌的诊断、治疗及预后措施提供依据,现将结果报道如下。
1 资料与方法
1.1 一般资料 选取成都市第六人民医院2008年5月至2010年5月手术切除的肺癌病理标本50例,其中男37例,女13例,年龄35~78岁,平均(53.56±10.41)岁;腺癌20例,鳞癌15例,大细胞癌9例,小细胞癌6例;高分化22例,中分化15例,低分化13例。以其中30例癌旁正常组织作为对照,所有患者术前均未接受过放疗、化疗或免疫治疗,术后均经病理检查确诊为肺癌。对所有患者进行随访,随访时间5~90个月,末次随访至2015年3月。
1.2 方法 所有组织标本用10%中性甲醛进行固定,作脱水、包埋处理,连续切片5~6张,切片厚度为4 μm,其中一张用于HE染色,核实组织病理学诊断,其他用于免疫组化染色。将切片置入pH 6.0的0.01 mmol/L柠檬酸盐缓冲液中进行抗原修复,在水浴锅中煮20 min后取出,冷却后置入PBS液冲洗3次,每次3 min,加入一抗(Napsin A 1∶100,TTF-1 1∶50,ERCC1 1∶100),4 ℃过夜,再用PBS液冲洗3次,每次3 min,然后加入二抗(En Vision法)试剂,37 ℃、30 min后,用PBS液洗3×3 min,DAB显色10 min,最后苏木精衬染、分化、蓝化、脱水、树脂封片。
1.3 结果判定标准 染色结果由两名有经验的病理科医生阅片审核。在10×40倍光学显微镜下观察标本,随机选取5个视野,计数每个视野阳性细胞所占的比例。Napsin A定位于细胞质,TTF-1和ERCC1定位于细胞核内,均以出现棕黄色颗粒为阳性信号。染色强度评分标准[3]:不着色视为0分,黄色视为1分,棕黄色视为2分,黄褐色视为3分。阳性细胞所占比例评分标准[4]:<10%为0分;10%~<40%为1分;40%~<70%为2分;≥70%为3分。两种评分相加0~<70%者2分,≥70%者3分。二者相加0~2分为“-”,3~6分为“+”,以此标准进行结果判定。
1.4 统计学处理 采用SPSS16.0统计学软件进行数据分析,两组定量资料的比较采用t检验,计数资料的比较采用χ2检验,采用Kaplan-Meier进行生存分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 Napsin A、TTF-1与ERCC1在肺癌组织与癌旁正常组织的表达情况 Napsin A在肺癌组织中的阳性表达率80.00%,低于癌旁正常组织100%,TTF-1与ERCC1则在肺癌组织中呈高表达(P<0.05)。见表1、图1~3。
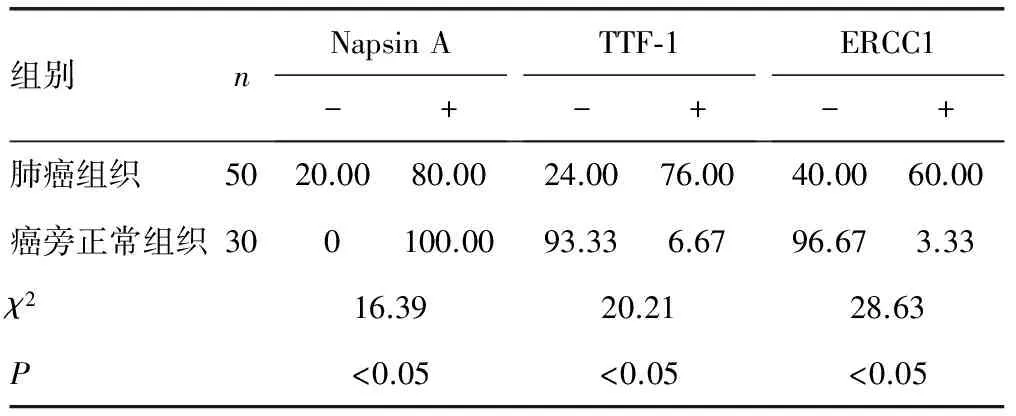
表1 Napsin A、TTF-1与ERCC1在肺癌组织与
2.2 Napsin A、TTF-1及ERCC1的阳性表达与年龄、性别、肺癌组织类型及分化程度的关系 Napsin A、TTF-1及ERCC1的阳性表达与年龄、性别无密切相关,差异无统计学意义(P>0.05)。Napsin A和TTF-1的阳性表达与肺癌组织类型有密切关系(P<0.05)。Napsin A的阳性表达与分化程度呈正相关,差异有统计学意义(P<0.05)。见表2。
2.3 Napsin A、TTF-1及ERCC1的阳性表达与患者生存率的关系 从2008年6月开始,每12个月随访1次,Kaplan-Meier生存分析显示,Napsin A与TTF-1的阳性表达者和阴性表达者的生存率大致相同,差异无统计学意义(P>0.05)。而ERCC1阳性表达者总生存率优于阴性表达者,ERCC1的表达与生存显著相关(P<0.05)。见图4。
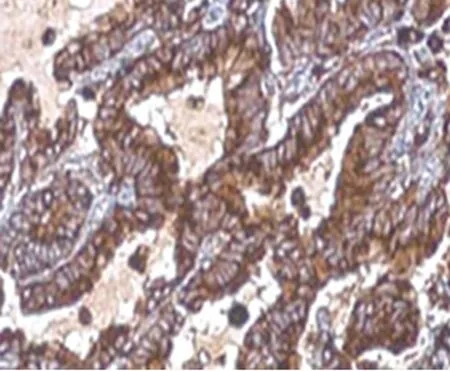
图1 Napsin A在肺癌组织中的表达(SP×400)
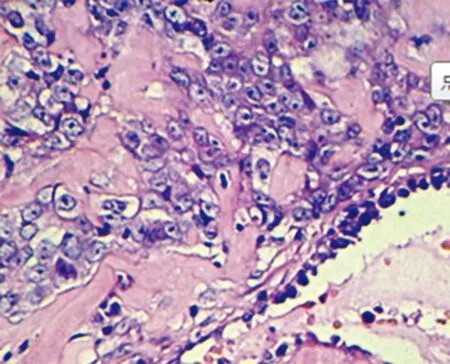
图2 TTF-1在肺癌组织中的表达(SP×400)

图3 ERCC1在肺癌组织中的表达(SP×400)
A:Napsin A表达与患者生存率的关系;B:TTF-1表达与患者生存率的关系;C:ERCC1表达与患者生存率的关系。

图4 Napsin A、TTF-1、ERCCI表达与生存率的关系
3 讨 论
肺癌是临床上常见的恶性肿瘤之一,发病率和病死率都极高,严重威胁着人民的健康和生命。其发病机制尚不十分明确,往往由于该病起病隐匿、进展迅速及诊断不足,导致其预后较差[5]。 Napsin A是一种天门冬氨酸蛋白酶,主要表达于肺和肾脏的上皮细胞中[6]。有研究表明,Napsin A参与了小鼠脾脏、肺和肾脏的发育成熟过程,且在其中发挥了重要作用。另外,它还参与疏水性肺表面活性物质蛋白前体的蛋白水解过程,在蛋白前体成熟、维持肺的正常形态与功能的过程中有重要作用[7-8]。本研究结果显示Napsin A在肺癌组织中的阳性表达率80.00%,低于癌旁正常组织100%,Napsin A的阳性表达与分化程度呈正相关,高分化、中分化和低分化阳性表达率分别为100%、81.22%、66.67%,其机制可能为Napsin A基因或蛋白的减少、缺失促进了肺癌进展,因此认为Napsin A在肺癌组织中的表达,可作为判断预后的一种指标。TTF-1主要表达于甲状腺上皮、间脑及胚胎肺纤毛柱状上皮细胞核中,是一种细胞核蛋白,是近年来发现的一种新的肿瘤标志物。TTF-1在肺的生长、发育及分化等过程中有重要作用。有研究[9-10]表明,TTF-1在肺组织中的表达局限于细支气管上皮和肺泡上皮细胞,可作为肺终末气道细胞及其肿瘤的标志物,在肿瘤的诊断和鉴别诊断中广泛应用,且有人将它作为肺癌的一项预后指标。本研究结果显示TTF-1在肺癌组织中的阳性表达率76.00%,明显高于癌旁正常组织6.67%,此结论与以往的文献报道相符。关于TTF-1在肺癌组织中高表达的机制,有文献[11-12]报道,TTF-1随着肺组织的发育在支气管和柱状上皮中的表达逐渐降低,但在Ⅱ型肺泡上皮及Clara细胞中的表达仍较高,因为大多数肺腺癌起源于肺泡或支气管上皮的周围性肺癌,因此TTF-1在肺腺癌组织中高表达;另有研究发现[13],TTF-1的表达与细胞增殖抗原(Ki67)表达呈负性相关,意味着TTF-1的表达水平越高,癌细胞增殖率越低,提示患者预后越好。ERCC1是核苷酸剪切修复家族中的一个重要成员,在19号染色体上表达,编码297个氨基酸的蛋白,与XPF形成异源二聚体,在DNA单链受损处的5′端进行剪切而发挥功能[14-15]。本研究结果显示ERCC1在肺癌组织中呈高表达,且其表达与生存显著相关,ERCC1阳性表达者5年总生存率优于阴性表达者。ERCC1基因在肺癌组织中的高表达,使其产生的表达产物与DNA修复酶缺乏互补基因F形成紧密的异二聚体在损伤识别和切除损伤5′端中发挥作用,从而防止癌变。
综上所述,Napsin A、TTF-1与ERCC1在肺癌患者中的表达情况与预后密切相关。
[1]成戈,周智鹏,邱维加,等.动态增强MRI定量参数对不同组织学类型肺癌的诊断价值[J].广东医学,2015,36(12):1874-1877.
[2]董鹏飞.非小细胞肺癌患者血清热休克蛋白90α的临床意义研究[J].中国全科医学,2015,18(19):2354-2356.
[3]代莹,傅静,魏兵.经他莫昔芬治疗的乳腺癌ER、PR阳性率和染色强度与预后的关系[J].临床与实验病理学杂志,2013,29(4):419-423.
[4]Qin CX,Chen DW,Tang RC,et al.Studies on silkfabric dyed with a phthalocyanine dye [J].Colo Technol,2010,126(5):303-307.
[5]O′connor JP,Tofts PS,Miles KA,et al.Dynamic con-trast-enhanced imaging techniques:CT and MRI[J].Br J Radiol,2011,84(12):112-120.
[6]Hirashima Y,Yamada Y,Tateishi U,et al.Pharmacoki netic parameters from 3-Tesla DCE-MRI as surrogate biomarkers of antitumor effects of bevacizumab plus FOLFIRI in colorectal cancer with liver metastasis [J].Int J Cancer,2012,130(10):2359-2365.
[7]孙廷谊,李真.Np63和napsinA在肺鳞状细胞癌和肺腺癌鉴别诊断中的应用[J].诊断病理学杂志,2015,22(9):564-564.
[8]郑金旭,管淑红,许清.Ⅱ型肺泡上皮细胞转染Napsin A基因对肺纤维化的干预作用[J].中华医学杂志,2010,90(46):3294-3299.
[9]Roy M,Jain D,Yadav R,et al.TTF-1 and Napsin-A are not markers for biliary phenotype:an immunohistochemical study of gallbladder adenocarcinomas[J].Am J Surg Pathol,2015,39(12):1742-1744.
[10]Yaman B,Nart D,Ekren PK,et al.Expression of p63,TTF-1 and Maspin in non-small cell lung carcinoma and their effect on the prognosis and differential diagnosis[J].Turk Pato Derg,2015,31(3):163-174.
[11]王新根,周有俭.肝内和肝外胆管癌中Napsin-A和TTF-1的表达[J].临床与实验病理学杂志,2015,31(8):916-918.
[12]Rossi G,Cavazza A,Righi L,et al.Napsin-A,TTF-1,EGFR,and ALK status determination in lung primary and metastatic mucin-Producing adenocarcinomas[J].Int J Surg Pathol,2014,22(5):401-407.
[13]张同海,王劲松.联合检测TTF1、CK5/6、p63和napsinA在肺鳞癌和腺癌鉴别诊断中的价值[J].临床与实验病理学杂志,2012,28(8):918-920.
[14]胡艳正,王伟,尚立群,等.液相芯片与免疫组织化学方法检测非小细胞肺癌ERCC1和RRM1表达的比较研究[J].中国肿瘤临床,2013,40(6):349-353.
[15]段志英,朱秀芳.胰腺导管腺癌患者癌组织中切除修复交叉互补基因1、Furin和10号染色体缺失的磷酸酶及张力蛋白同源物的表达及意义[J].中国老年学杂志,2014,20(17):4777-4779.
陈晓露(1977-),副教授,主要从事病理学研究。△
�验交流·
10.3969/j.issn.1671-8348.2016.36.042
R734.2
B
1671-8348(2016)36-5167-04
2016-07-16
2016-09-26)

