紫杉醇与白藜芦醇单体及联合用药诱导人肝癌HepG-2细胞凋亡的比较研究
薛 娅,耿文峰,伍春莲,2
(1.西华师范大学 西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2.西南大学 三峡库区生态环境与生物资源省部共建国家重点实验室,重庆 北碚 400715)
紫杉醇与白藜芦醇单体及联合用药诱导人肝癌HepG-2细胞凋亡的比较研究
薛 娅1,耿文峰1,伍春莲1,2
(1.西华师范大学 西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2.西南大学 三峡库区生态环境与生物资源省部共建国家重点实验室,重庆 北碚 400715)
作者旨在对紫杉醇与白藜芦醇单体及联合用药诱导HepG-2细胞凋亡进行比较研究。CCK-8法测定紫杉醇和白藜芦醇对HepG-2细胞活性的影响;AO/PI双染色法检测HepG-2细胞凋亡形态;JC-1/线粒体膜电位检测HepG-2细胞中线粒体的去极化程度;酶标仪检测Caspase-3/8的活性。CCK-8法结果显示无论是紫杉醇和白藜芦醇还是两种药物联合对HepG-2细胞都有抑制作用,其中联合用药组效果更优,表现出明显的时间依赖性;AO/PI染色和JC-1结果表明紫杉醇和白藜芦醇及两种药物联合皆使HepG-2细胞发生凋亡,联合用药组效果优于单体组;Caspase-3/8的活性检测发现在其凋亡过程中有Caspase-3/8蛋白酶参与其中。得出结论紫杉醇和白藜芦醇两种单体药物以及两种药物联合皆可通过线粒体途径诱导HepG-2细胞凋亡,联合用药组药效更强,且凋亡过程是caspase-3依赖性。
HepG-2;紫杉醇;白藜芦醇;Caspase-3/8;细胞凋亡
据世界卫生组织统计肝癌是位居我国第二的癌症“杀手”,潜伏性高、恶性度高、病情进展快,治疗难度大、预后不良,故寻求新的更合理的抗肝癌药物,对于肝癌的防患与治疗都有重大意义。紫杉醇(Tax,Taxol)是从太平洋紫杉树分离出来的一种高氧化二萜类天然产物,是一种广谱抗癌药物[1-3],其抗癌机制是通过抑制微管解聚而阻止细胞有丝分裂引发细胞凋亡[4]。但很多研究指出Tax对人体有毒副作用,易产生抗药性[5-8]。白藜芦醇(Resveratrol,Res)属于多酚化合物,白藜芦醇具抗肿瘤[9]、抗炎症[10-12]、抗菌等[13-14]作用,而且对正常的人体细胞副作用小[15]。已有报道Tax、Res及其联合药物通过线粒体途径诱导喉癌细胞Hep-2凋亡[16],Tax、Res两者联合应用作用肺癌PC9具有协同抗癌作用[17]。适宜浓度的Tax与RES联合应用可显著增强药物对HepG-2细胞的抑制作用[18]。目前没有关于Tax、Res单体及联合用药时对人肝癌细胞HepG-2的形态学和其诱导细胞调亡的分子机理的研究。因此,本研究以人肝癌细胞HepG-2为材料,探讨Tax、Res单体及联合用药时对人肝癌细胞HepG-2的生长抑制作用及其诱导细胞调亡的信号途径。为减少紫杉醇的用量,降低其对机体的毒副作用,并为开发肝癌综合治疗方案提供相关理论依据。
1 材料与方法
1.1 实验材料
1.1.1 细 胞
人肝癌细胞株HepG-2(购于川北医学院生化与分子免疫研究所)。
1.1.2 试剂
RPMI-1640培养基(购于Gibco公司,美国);胎牛血清(购于杭州四季青生物制品公司,中国);双抗(青霉素,链霉素,购于Gibco公司,美国);胰蛋白酶(购于Amresco公司,美国);Tax(HPLC≥99%)和RES(HPLC≥98%)(购于瑞芬思公司,中国);啶橙(AO)(购于Sigma公司,美国);碘化丙锭(PI)(购于Sigma公司,美国);线粒体膜电位检测试剂盒(JC-1)(购于Beyotime公司,中国);Caspase-3/8检测试剂盒(购于BestBio公司,中国)。
1.1.3 仪 器
CO2培养箱(购于Sanyo公司,日本);倒置显微镜(购于Olympus公司,日本);自动酶标仪(购于Thermo公司,美国);荧光显微镜(购于Olympus公司,日本)。
1.2 实验方法
1.2.1 细胞培养
将人肝癌细胞HepG-2接种到RPMI-1640完全培养液,于37℃、5% CO2培养箱中进行培养。
1.2.2 白藜芦醇、紫杉醇的配制
称取一定量的Tax与Res药品溶于DMSO,用RPMI-1640基础培养液配制成10 mmol/L的高浓度母液备用(DMSO<0.1%),实验时再依次稀释到所需的最终浓度。
1.2.3 CCK-8法测定白藜芦醇和紫杉醇对肝癌HepG-2细胞活性的影响
取对数生长期的HepG-2细胞,制成均匀细胞悬液,接种于96孔板。24 h后加药处理,使各组药品终浓度为:Res(200 μmol/L)、Tax(5 μmol/L)、Res(200 μmol/L)+Tax(5 μmol/L),设置空白对照组,每组设5个平行孔。在37℃、5%的CO2培养箱内孵育12 h、24 h及36 h后,弃上清,每孔加入10 μL的CCK-8溶液,将96孔板于培养箱内再孵育4 h后用酶标仪测定在450 nm处的吸光度。细胞生长抑制率=(1-实验组OD值/对照组OD值)×100%。实验重复3次,结果取平均值。
1.2.4 JC-1/线粒体膜电位检测细胞凋亡
病灶的典型层面及ADCtot值的测量方法见图1。两位医师测得的ADCtot值分别为(1.54±0.27)×10-3、(1.55±0.28)×10-3mm2/s,ICC为0.994,一致性优秀。以ADCtot中位数(1.5×10-3mm2/s)为标准分成高低值两组进行比较。
取对数生长期细胞接种于铺有灭菌盖玻片的6孔板内,放入37℃、5%的CO2培养箱内培养过夜,待细胞长至80%融合时,吸去6孔板内的培养液,加药处理,使各组药品终浓度为:Res(200 μmol/L)、Tax(5 μmol/L)、Res(200 μmol/L)+Tax(5 μmol/L),设定空白对照组。孵育24 h后,取出6孔板根据JC-1说明书进行检测。
1.2.5 AO/PI双染色法检测细胞凋亡
取对数生长期细胞接种于有灭菌盖玻片的6孔板中,放入37℃、5%的CO2培养箱内培养过夜,待细胞长至80%融合时,吸去废液,加药处理,使各组中药品的终浓度为: Res(200 μmol/L)、Tax(5 μmol/L)、Res(200 μmol/L)+Tax(5 μmol/L),设定空白对照组。孵育24 h后,取出盖玻片,用PBS缓冲液洗细胞2~3次,晾干,95%的乙醇固定10 min,AO/PI 复合染液染色1 min,PBS洗净并加入0.1 mol/L的CaCl2进行分色处理。完成后将各盖玻片倒置放于载玻片上,30 s后荧光显微镜观察拍照。

1.2.6 Caspase-3/8活性检测
取对数生长期的细胞,以相同的细胞浓度接种于25 mL培养瓶中,接种24 h后,进行加药处理,使各组药品终浓度分别为:Res(200 μmol/L)、Tax(5 μmol/L)、Res(200 μmol/L)+Tax(5 μmol/L),设定空白对照组,孵育12 h、24 h,根据Caspase-3/8活性检测试剂盒说明书进行活性检测。
2 结 果
2.1 药物作用时间对细胞活性的影响
用Res(200 μmol/L)、Tax(5 μmol/L)和Res(200 μmol/L)+Tax(5 μmol/L)三组药品处理HepG-2细胞12 h、24 h、36 h,结果发现:在加药12 h后,这三组药品对HepG-2细胞的抑制率分别可达22.55%、35.18%和49.10%;在经过24 h后,这三组药品抑制率分别增长至57.85%、65.34%和75.72% 。在加药36 h后,三组药品的抑制率分别为64.01%、68.76%和79.53%(见图1)。结果显示:无论是白藜芦醇和紫杉醇单体还是两种药物联合对HepG-2细胞都有抑制作用,抑制作用呈时间依赖性,其中联合用药组效果更优。
正常细胞在JC-1染色后呈现出高绿和高红的荧光着色效果,如在同一滤光片下观察则为黄绿色(如图2-1)。凋亡细胞在双色滤光片下可以观察到高绿和低红的荧光着色效果,在同一滤光片下为绿色(如图2-2、图2-3、图2-4)。经过最终统计:在经过三组药品处理24 h后,Res(200 μmol/L)、Tax(5 μmol/L)和Res(200 μmol/L)+Tax(5 μmol/L) 中线粒体去极化细胞所占比例分别为:10.0%、46.1%、50.2%和63.1%。结果显示:白藜芦醇和紫杉醇单体或者两种药物联合都破坏线粒体膜电位,诱导细胞凋亡反应,联合组效果更明显。

2.3 药物对细胞凋亡的影响
用Res(200 μmol/L)、Tax(5 μmol/L)和Res(200 μmol/L)+Tax(5 μmol/L)三组药品处理HepG-2细胞24 h,AO/PI染色结果如图3所示。在视野中可见三种不同的细胞形态:活细胞(VN)发绿色荧光;早期凋亡细胞(VA)发橘红色荧光;晚期凋亡细胞(NVA)发红色荧光。结果显示:空白对照组(如图3-1)只有VN;Res与Tax单体用药组(如图3-2、图3-3)有VA;Res +Tax组(如图3-4)观察到NVA,并且有凋亡小体出现。结果表明:白藜芦醇和紫杉醇单体还是两种药物联合都可以诱导细胞发生凋亡,其中联合用药组在相同时间内反应更强烈。

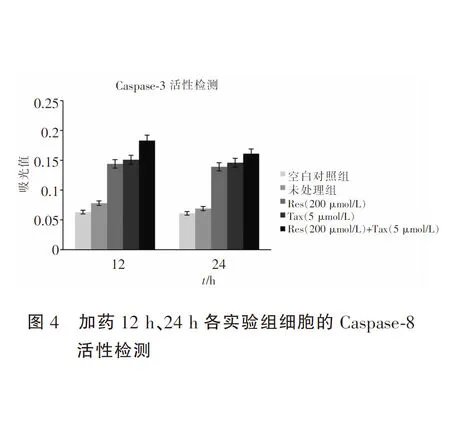
2.4 Caspase-8/3活性检测结果
酶标仪检测Caspase-8和Caspase-3活性(见图4、图5)。加药12 h后,Res(200 μmol/L)、Tax(5 μmol/L)和Res(200 μmol/L)+Tax(5 μmol/L)三组药品的Caspase-8活性测定值分别为0.144、0.151和0.183,与未处理组的0.078以及空白对照组的的0.063相比,有显著升高(P<0.01),而未处理组与空白对照组相比则无明显差异(P>0.05)。加药24 h后,三组药品的Caspase-8活性测定值分别为0.139、0.146和0.161,与未处理组的0.069以及空白对照组的0.061相比,有显著升高(P<0.01)。加药12 h后,Res(200 μmol/L)、Tax(5 μmol/L)和Res(200 μmol/L)+Tax(5 μmol/L)三组药品的Caspase-3活性测定值分别为0.133、0.138和0.154,与未处理组的0.063以及空白对照组的的0.057相比,有显著升高(P<0.01)。而未处理组与空白对照组相比则无明显差异(P>0.05)。加药24 h后,三组药品的Caspase-3活性测定值分别为0.154、0.161和0.191,与未处理组的0.089以及空白对照组的0.066相比,有显著升高(P<0.01)。而未处理组与空白对照组相比依旧无明显差异(P>0.05)。结果显示:三组药品皆可诱导HepG-2细胞发生凋亡,且凋亡的发生过程呈Caspase-3依赖性,其中联合组药效更强。三组药品诱导HepG-2细胞发生凋亡的过程是通过Caspase-8激活的,提示有死亡受体途径参与其中。

3 讨 论
根据相关报道[18],当二者联合作用时,紫杉醇与白藜芦醇分别在5~20 μmol/L以及100~1 000 μmol/L的浓度范围内呈现出相加效果,本研究选择适宜的浓度Res(200 μmol/L)、Tax(5 μmol/L)和Res(200 μmol/L)+Tax(5 μmol/L)三组药品处理HepG-2细胞。CCK-8法测定白藜芦醇和紫杉醇联合用药对肝癌HepG-2细胞活性影响时发现无论是两种单体用药还是联合用药,它们对HepG-2细胞都有抑制作用,并表现出明显的时间依赖性。分析数据发现联合用药组不但药效较单体药品更强,其在较短时间内的作用亦更加明显,反应速度明显优于RES与Tax单独用药组,潘洪明等[19]在胃癌的研究中也得出了相似结果。JC-1/线粒体膜电位检测和AO/PI双染色法分析细胞凋亡实验中,发现无论是两种单体药物亦或两种药物联合,它们皆可诱导HepG-2细胞调亡,其中联合用药组效果更优,Res作用肝癌HepG-2后电子显微镜观察到线粒体的跨膜电位明显降低[20],与本文研究结果一致。
Caspase蛋白酶家族在细胞凋亡发生过程中有重要作用。其中Caspase-3与细胞的DNA断裂、染色质凝集以及凋亡小体的发生皆有关系,是Caspase中的最关键分子。另外,在死亡受体介导的细胞凋亡途径中,Caspase-8位于整个凋亡信号通路的最上游,并且可被TNF激活,再被细胞表面受体激活后,Caspase-8可以通过级联放大反应导致下游Caspase-3的活化[21]。在本论文中,各用药组细胞的Caspase-3活性明显高于未处理组和空白组,联合用药组的Caspase-3活性最强。说明Res、Tax和Res +Tax皆诱导HepG-2细胞发生凋亡过程是Caspase-3依赖的,Dhandayuthpani等[22]指出白藜芦醇诱导凋亡的机制与上调促凋亡基因Caspase-3有关。为进一步了解紫杉醇与白藜芦醇联合用药诱导HepG-2细胞发生凋亡的途径,又对各用药组细胞的Caspase-8活性进行了检测,结果显示各用药组细胞的Caspase-8活性明显高于未处理组和空白组,联合用药组的Caspase-8活性最强,综合发现12 h的Caspase-8活性比24 h高,而且12 h的Caspase-3活性低于24 h。提示两种单体药物亦或两种药物联合诱导HepG-2细胞调亡有通过死亡受体途径参与其中。Garcia-Zepeda等[23]也揭示白藜芦醇通过死亡受体途径介导Caski、Siha及C33A细胞凋亡。
本研究从细胞活性与形态、酶活性等各个方面关于Res和Tax单独用药以及联合用药时对HepG-2细胞生长的抑制作用及诱导调亡的途径做比较研究。联合用药和综合疗法作为目前生物医学领域的研究热点也开始逐渐应用于临床[24];并且为我们提供了肿瘤及癌症治疗的新思路,用以减少Tax这种化学抗癌药物的用量,降低其对机体的毒副作用。Res和Tax所涉及的细胞凋亡过程到底是否还有其他凋亡途径的参与需要进一步的研究。
[1] WANI M C,TAYLOR H L,WALL M E,et al.Plant antitumor agents.VI.The isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxus brevifolia[J].J Am Chem Soc,1971,93(9):2325-2327.
[2] YARDLEY DA.Taxanes in the elderly patient with metastatic breast cancer[J].Breast Cancer:Targets and Therapy,2015,7:293-301.
[3] LUO Y,WANG X,WANG H,et al.High bak expression is associated with a favorable prognosis in breast cancer and sensitizes breast cancer cells to paclitaxel[J].PloS one,2015,10(9):e0138955.
[4] SCHIFF P B,FANT J,HORWITZ S B,et al.Promotion of microtubule assembly in vitro by taxol[J].Nature,1979,277(5698):665-667.
[5] 金 涛,李铁晶,吴 桐,等.紫杉醇抗肿瘤机理与毒副作用[J].东北农业大学学报,2005,36(6):816-819.
[6] YANG H,LI XD,ZHOU Y,et al.Stemness and chemotherapeutic drug resistance induced by EIF5A2 overexpression in esophageal squamous cell carcinoma[J].Oncotarget,2015,6(28):26079-26089.
[7] SHEN Y A,LI W H,CHEN P H,et al.Intraperitoneal delivery of a novel liposome-encapsulated paclitaxel redirects metabolic reprogramming and effectively inhibits cancer stem cells in Taxol-resistant ovarian cancer[J].American journal of translational research,2015,7(5):841-855.
[8] ZOU D,WANG D,LI R,et al.MiR-197 induces taxol resistance in human ovarian cancer cells by regulating NLK[J].Tumor Biology,2015,36(9):6725-6732.
[9] FULDA S,DEBATIN K M.Extrinsic versus intrinsic apoptosis pathways in anticancer chemotherapy[J].Oncogene,2006,25(34):4798-4811.
[10] DONNELLY L E,NEWTON R,KENNEDY G E,et al.Anti-inflammatory effects of resveratrol in lung epithelial cells:molecular mechanisms[J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2004,287(4):L774-L783.
[11] AFZAL M,SAFER AM,MENON M.Green tea polyphenols and their potential role in health and disease[J].Inflammopharmacology,2015,23(4):151-161.
[12] LI M,TAN Y,STENMARK K R,et al.High pulsatility flow induces acute endothelial inflammation through overpolarizing cells to activate NF-κB[J].Cardiovascular engineering and technology,2013,4(1):26-38.
[13] DESTE F,TOMASINSIG L,SKERLAVAJ B,et al.Modulation of cytokine gene expression by cathelicidin BMAP-28 in LPS-stimulated and-unstimulated macrophages[J].Immunobiology,2012,217(10):962-971.
[14] HAIN R,REIF HJ,KRAUSE E,et al.Disease resistance results from foreign phytoalexin expression in a novel plant[J].Nature,1993,361(6408):153-156.
[15] 韩雪莲.白藜芦醇及其衍生物和类似物抗肿瘤研究进展[J].化工进展,2014,33(6):1526-1532.
[16] 卢晨欣,孙警辉,伍春莲.白藜芦醇与紫杉醇联合用药对人喉癌Hep-2细胞凋亡机制的研究[J].中国中药杂志,2016,03:476-483.
[17] 崔秀娟.白藜芦醇与紫杉醇联合应用对肺癌细胞PC9的杀伤效应[J].蚌埠医学院学报,2015,08:994-997.
[18] 耿文峰,伍春莲,陈杨琼,等.紫杉醇与白藜芦醇联合用药对人肝癌细胞HepG-2活性的影响[J].西华师范大学学报(自然科学版),2012,33(3):261-264.
[19] 潘洪明,费洪新,黄小义.紫杉醇与白藜芦醇联合应用对人胃癌MGC803细胞作用的研究[J].中华中医药杂志,2008,23(9):815-817.
[20] 戴维奇,徐 凌,王 锋,等.白藜芦醇对肝癌细胞增殖和凋亡影响及其机制[J].现代生物医学进展,2012,12:16-26.
[21] MOCARSKI E S,UPTON J W,KAISER W J.Viral infection and the evolution of caspase 8-regulated apoptotic and necrotic death pathways[J].Nature Reviews Immunology,2012,12(2):79-88.
[22] DHANDAYUTHAPANI S,MARIMUTHU P,HORMANN V,et al.Induction of apoptosis in HeLa cells via caspase activation by resveratrol and genistein[J].Journal of medicinal food,2013,16(2):139-146.
[23] GARCIA-ZEPEDA S P,GARCIA-VILLA E,DIAZ-CHAVEZ J,et al.Resveratrol induces cell death in cervical cancer cells through apoptosis and autophagy[J].European Journal of Cancer Prevention,2013,22(6):577-584.
[24] 田宇楠,祝慧凤,万 东.肝肺肿瘤临床联合用药的研究进展[J].实用临床医学杂志,2014,11:191-194.
Comparative Study of Induced Apoptosis on the Effect of Paclitaxel and Resveratrol Combination Therapy in Hepatocellular HepG-2 cell
XUE Ya1,GENG Wenfeng1,WU Chunlian1,2
(1.Key Laboratory of Southwest China Wildlife Resources Conservation (China West Normal University),Ministry of Education,Nanchong Sichuan 637009,China;2. State Key Laboratory Breeding Base of Eco-Environments and Bio-Resources of the Three Gorges Reservoir Region, Southwest University,Beibei Chongqing 400715,China)
This paper focuses on making a comparative study of resveratrol,paclitaxel and their joint anti-tumor mechanism.CCK-8 assay is used to evaluate the effect on the activity of HepG-2 cell;AO/PI staining for detecting HepG-2 cell’s morphology;JC-1 for detecting the degree of mitochondria polarization of HepG-2 cells;Microplate reader for detecting the activity of Caspase-3/8.The results showed that:both resveratrol and paclitaxel or the combination of the above two drugs could inhibit activity of the HepG-2 cells,in which the effect of the combined treatment group was better.Inhibition rate increased with time,which showed significant time-dependence;AO / PI staining and JC-1 showed that resveratrol,paclitaxel and the combination of the two drugs could induce apoptosis of HepG-2 cell and morphological changes,among which the combined treatment group was more significant.Caspase-3 / 8 activity assay found that Caspase-3 protease and death receptor pathway involved in the apoptosis process.The above results showed that resveratrol,paclitaxel and two drugs in combination can induced HepG-2 apoptosis,the combined treatment is more effective,and the apoptosis is caspase3 dependence.
HepG-2;paclitaxel;resveratrol;Caspase;apoptosis
1673-5072(2016)04-0385-05
2016-04-20
四川省教育厅重大培育项目(13CZ0029);国博士后基金第54批面上一等资助项目(2013M540391)
薛 娅(1991—),女,四川达州市人,硕士研究生,主要从事天然产物抗肿瘤研究。
伍春莲(1976—),女,四川彭州人,教授,博士,主要从事细胞和分子生物学的研究和教学。 E-mail:wcl_xj@163.com
Q291
A
10.16246/j.issn.1673-5072.2016.04.005

