长链非编码RNA MALAT1在肝细胞癌行肝切除患者中的表达及临床意义
刘兴强,王霞,刘超,胡宇
长链非编码RNA MALAT1在肝细胞癌行肝切除患者中的表达及临床意义
刘兴强1,王霞2,刘超3,胡宇4△
目的 探讨长链非编码RNA肺腺癌转移相关转录子1(MALAT1)与肝细胞癌患者预后的关系,为患者的围手术期治疗提供参考。方法收集2008年6月—2014年6月在天津市人民医院治疗的125例原发性肝细胞癌患者癌组织及其对应的癌旁组织标本,采用实时定量聚合酶链式反应(RT-PCR)检测组织中MALAT1的表达水平,分析MALAT1表达水平与肝细胞癌行肝切除患者预后的关系,并筛选影响患者预后的危险因素。结果MALAT1在肝细胞癌组织内的表达上调(P<0.05),MALAT1的表达与患者年龄、有否乙肝、有否肝硬化、肿瘤最大径、肿瘤数目、肿瘤TNM分期、肿瘤有否血管侵犯、病理分化程度以及术前甲胎蛋白(AFP)含量无关(P>0.05)。Kaplan-Meier生存分析显示,MALAT1低表达组患者1、3和5年术后累积生存率分别为85.9%、55.2%和33.8%,MALAT1高表达组分别为66.0%、34.6%和3.9%;2组患者生存率差异有统计学意义(P<0.01)。多因素COX回归模型分析显示,肿瘤有血管侵犯(RR=3.055,95%CI:1.986~4.053,P<0.01)、MALAT1高表达(RR=2.918,95%CI:1.736~3.672,P<0.01)是影响肝细胞癌患者术后生存率的独立危险因素。结论长链非编码RNA MALAT1是肝癌手术后判断患者预后的新型肿瘤标志物,可以用于肝癌的术前及术后评估。
癌,肝细胞;预后;肺腺癌转移相关转录子1
肝细胞癌(hepatocellular carcinoma,HCC)是全球第五大常见的癌症,特别是在中国发病率不断增加[1]。在我国,乙型肝炎病毒(hepatitis B virus,HBV)感染是肝细胞癌的最主要病因。肝细胞癌的复发和转移严重地降低了患者的远期生存率[2]。如何有效地预防和治疗手术后肝细胞癌的复发和转移,已成为肝细胞癌治疗中亟待解决的重要问题[3]。长链非编码RNA(long non-coding RNAs,lncRNA)肺腺癌转移相关转录子1(metastasisassociatedlungadenocarcinomatranscript1,MALAT1)几乎参与到基因调控过程的各个层面[4],其在原发性肝细胞癌发生发展过程中发挥的显著作用受到了更多的关注[5]。本研究通过检测肝细胞癌患者癌和癌旁组织中MALAT1表达情况,旨在探讨MALAT1表达与肝细胞癌复发和预后的关系。
1 资料与方法
1.1 一般资料选取2008年6月—2014年6月在天津市人民医院普通外科行肝癌切除术的患者作为研究对象。收集患者术中切取的癌组织及癌旁组织。患者均签署知情同意书,术后长期随访并建立患者临床病历资料数据库。纳入标准:(1)术后病理诊断为原发性肝细胞癌。(2)汉族。(3)合并肝炎的患者均为单纯乙型肝炎病毒感染。排除标准:(1)临床资料不完整。(2)合并有丙型肝炎病毒或其他类型肝炎病毒感染。最终入选125例,其中男113例,女12例,年龄36~77岁,平均(46.5±6.7)岁;其中单发肿瘤48例,多发肿瘤77例;肿瘤发生血管侵犯者46例,未发生血管侵犯者79例。按肝细胞癌的分期标准:Ⅰ期19例,Ⅱ期34例,Ⅲ期39例,Ⅳ期33例;病理分化程度为中、高分化者69例,低分化者56例。术前甲胎蛋白(AFP)<400 μg/L者31例,≥400 μg/L者94例;复发92例,无复发33例。
1.2 主要试剂及仪器胰蛋白酶、Trizol液购于美国Invitrogen公司;二甲基亚砜(DMSO)购于美国Sigma公司;逆转录试剂盒及Power SYBR Green PCR Master混合试剂盒购于美国赛默飞世尔科技公司。ABI 7500定量PCR仪购于美国BD公司;384孔PCR板购于美国Corning公司;超净工作台购于中国苏净集团安泰公司;超速冷冻离心机购于德国Eppendorf公司;恒温循环水浴箱购于丹麦Heto公司;-80℃低温冰箱购于美国FORMA公司。
1.3 方法
1.3.1 组织保存及病理切片制作术中切下的组织一部分迅速置入液氮中保存,一部分用10%福尔马林缓冲溶液进行固定,经取材、脱水、石蜡包埋、切片、烤片、染色后由病理医师做出诊断。
1.3.2 组织总RNA提取及cDNA合成取50 mg组织粉末提取总RNA,然后取2 μg总RNA经逆转录合成cDNA并置于-80℃冰箱中保存备用。
1.3.3 实时定量聚合酶链式反应(RT-qPCR)检测MALAT1表达(1)引物。引物由上海基康生物工程有限公司合成。上游:5′-GAATTGCGTCATTTAAAGCCTAGTT-3′;下游:5′-GTTTCATCCTACCACTCCCAATTAAT-3′。将GAPDH设为内参,内参引物,上游:5′-GGTCGGAGTCAACGGATTTG⁃GTCG-3′;下游:5′-CCTCCGACGCCTGCTTCACCAC-3′。(2)RT-PCR过程。在384孔PCR板中按下列顺序依次加入Master(2×)5 μL、ROX2 0.2 μL、上游引物0.3 μL、下游引物0.3 μL、cDNA 0.5 μL、DEPC水3.7 μL。按照三步法进行扩增,PCR反应:95℃10 min;95℃10 s,55℃30 s,72℃35 s,共扩增40个循环;95℃1 min,55℃1 min。采集数据,获取每份样品的Ct值结果,依据2-ΔΔCt法对肝细胞癌及癌旁组织中MALAT1的表达水平行相对定量分析。
1.3.4 随访全部125例患者均纳入我院临床随访系统,日常复诊工作由3名不参与本次研究的高年资医生独立完成。患者手术后每隔3个月来院行外周静脉血AFP检测、查胸X线片正侧位、腹部彩超、腹部CT、全身同位素骨扫描检查项目。随访截止日期2015年6月。
1.4 统计学方法采用SPSS 20.0软件进行统计学分析。正态分布的计量资料用均数±标准差表示,组间比较采用独立样本t检验。组间生存率的比较采用Kaplan-Meier生存分析;采用多因素COX回归模型分析筛选影响患者预后的独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 MALAT1在癌组织及癌旁组织内的表达情况MALAT1在肝细胞癌组织内的表达水平明显高于癌旁组织(n=125,2.65±1.32 vs.1.68±1.05,t= 4.354,P=0.012)。
2.2 MALAT1表达水平与各临床参数间的关系以患者存活及死亡作为状态变量,患者的肝细胞癌组织MALAT1表达水平作为检验变量行受试者工作特征(ROC)曲线分析,根据最佳灵敏度及最佳特异度计算Youden’s指数为1.325,选取所对应的cutoff值2.12作为分组依据。结果将患者分为MALAT1高表达组53例和MALAT1低表达组72例。年龄、是否乙肝、是否肝硬化、肿瘤最大径、肿瘤数目、肿瘤TNM分期、肿瘤是否血管侵犯、病理分化程度以及术前AFP水平不同,患者肝癌组织MALAT1表达差异均无统计学意义,不同性别和肿瘤是否复发患者肝癌组织MALAT1表达差异有统计学意义(P<0.05)。见表1。
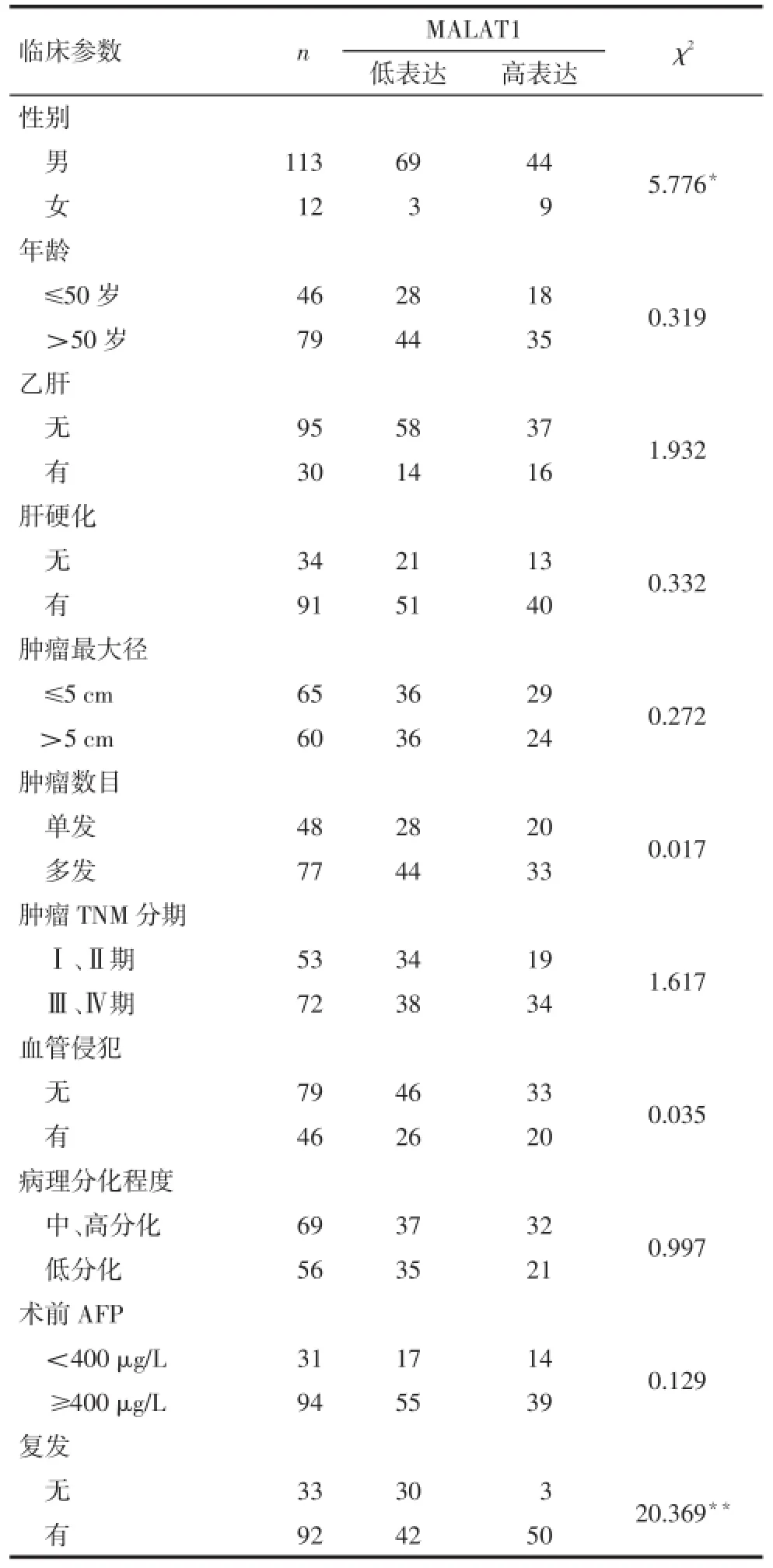
Tab.1 Relationship between MALAT1 expression level and clinical parameters表1 肝癌组织MALAT1表达水平与各临床参数关系(例)
2.3 MALAT1的表达与患者预后的关系Kaplan-Meier生存分析显示,MALAT1低表达组患者1、3和5年术后累积生存率分别为85.9%(61/71)、55.2%(37/67)和33.8%(22/65),MALAT1高表达组分别为66.0%(35/53)、34.6%(18/52)和3.9%(2/51);采用Log-Rank检验对2组患者术后生存率比较差异有统计学意义(χ2=16.090,P<0.01),见图1。

Fig.1 Survival curves of MALAT1 high expression group and low expression group图1 MALAT1高表达组与低表达组患者术后生存曲线
2.4 肝细胞癌肝切除术患者预后相关因素分析以表2中的因素为自变量并给予赋值,以生存时间为因变量行单因素COX回归模型分析。结果显示:肿瘤最大径>5 cm、肿瘤数目多发、肿瘤有血管侵犯、术前AFP≥400 μg/L以及MALAT1高表达为影响肝细胞癌肝切除患者预后的危险因素(P<0.01),见表3。

Tab.2 Independent variable assignment of death related factors after liver resection in patients with hepatocellular carcinoma表2 肝癌患者肝切除术后死亡相关因素赋值表
以表3中单因素COX回归模型分析有统计学意义的变量为自变量,生存时间为因变量进一步行多因素COX回归模型分析,结果显示,肿瘤有血管侵犯和MALAT1高表达是影响肝细胞癌患者肝切除术后预后的独立危险因素(P<0.01)。见表4。
3 讨论
MALAT1是一个长度超过8 000 nt的非编码RNA,定位于染色体11q13.1,在人肺、胰腺及其他正常组织中均显著表达,种族之间高度保守,提示其可能具有重要的生物学功能。
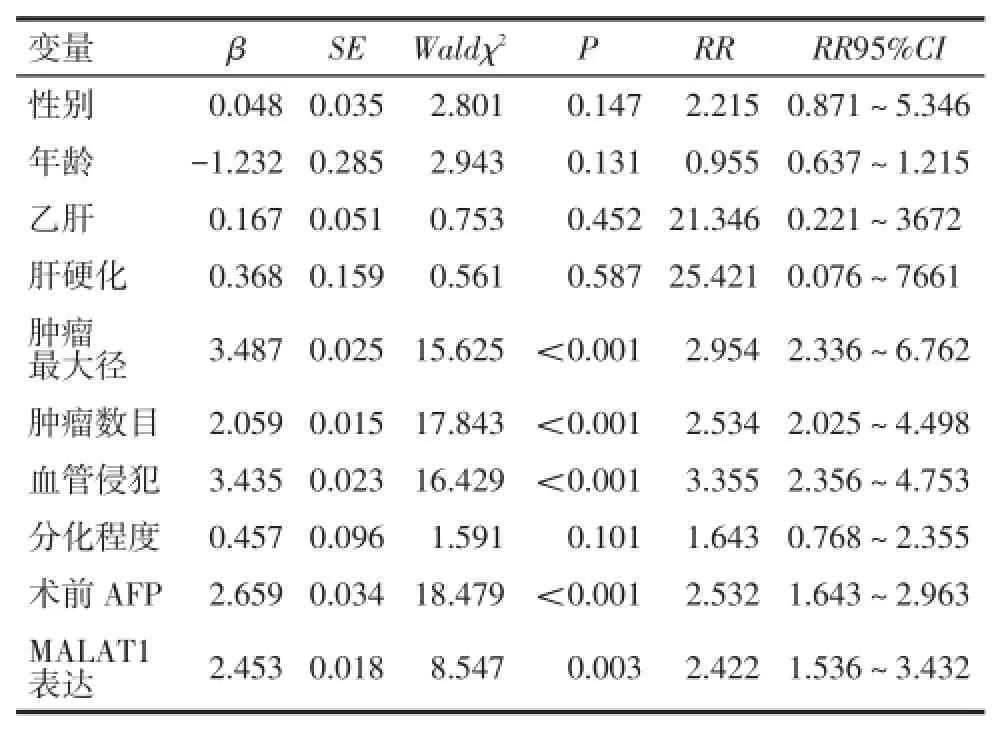
Tab.3 The univariate analysis of COX’s model of risk factors for death after liver resection表3 肝细胞癌患者术后死亡危险因素的单因素COX回归分析

Tab.4 The multivariate analysis of COX’s model of risk factors for death after liver resection表4 肝细胞癌患者术后死亡危险因素的多因素COX回归分析
3.1 长链非编码RNA与肝癌的关系关于长链非编码RNA在肝癌组织中的表达水平和功能之间的关系虽然很早就成为学术研究的热点[6],但取得的研究进展较少。近年来,随着恶性肿瘤转录组基因测序技术的进步,越来越多的研究结果显示在人体的很多恶性肿瘤组织中长链非编码RNA的表达谱存在着显著的差异。有研究表明长链非编码RNA还参与到调控恶性肿瘤细胞的增殖、侵袭和转移等行为过程中,且能够成为潜在的恶性肿瘤诊断的分子标志物以及设计治疗药物所针对的靶点[7]。恶性肿瘤的形成是多个阶段、多种因素发生恶性转化的过程。目前,长链非编码RNA在肝癌发生、发展过程中的作用机制日益成为肝癌研究领域的热点。通过比较人类肝癌长链非编码RNA芯片能够发现长链非编码RNA的表达谱在乙肝病毒相关肝细胞癌形成过程中显示出巨大的改变,长链非编码RNA HEIH检测为高表达组患者的预后明显差于HEIH低表达组[8]。有研究显示,长链非编码RNA-HULC在肝细胞癌组织中明显上调,并且外周血中HULC表达水平也明显高于正常人及肝硬化患者,因此长链非编码RNA-HULC具备作为早期诊断肝细胞癌标志物的可能性,HULC基因的多态性被认为可能是汉族人群乙肝病毒相关性肝癌发生的高危因素[9]。长链非编码RNA HOTTIP与WDR5/MLL复合物相结合后在HOXA基因位点处调控有关基因的表达,HOTTIP高表达与肝细胞癌患者肿瘤的发生、发展和预后显著相关[10]。以上研究提示,长链非编码RNA在原发性肝细胞癌的发生和发展过程中起到十分重要的作用,能够成为潜在恶性肿瘤诊断的分子标志物以及设计治疗药物所针对的靶点。
3.2 MALAT1在肝细胞癌肿瘤复发及预后中的作用有研究者最初在对比肺癌转移瘤和非小细胞肺癌转移瘤过程中发现,长链非编码RNA MALAT1存在表达差异,因此认为MALAT1与肺癌高度侵袭性和肺癌转移特点及患者不良的预后密切相关[11]。后续研究显示,MALAT1在人体各器官组织中均有表达,尤其是乳腺肿瘤、前列腺肿瘤、结肠肿瘤以及肝脏肿瘤等组织中均有高表达[12]。更为重要的是,MALAT1的上调表达能够预测肝癌肝移植手术后较低的存活率,是影响肝癌肝移植手术预后的独立危险因素[13]。功能学研究结果提示,MALAT1在恶性肿瘤的侵袭和转移过程中发挥重要作用,MALAT1的差异表达目前已成为许多恶性肿瘤研究过程中重要的肿瘤生物学标志,在肿瘤的诊断、治疗和预后判断中发挥重要作用[14]。
本研究探讨了MALAT1在肝细胞癌组织标本及癌旁组织内的表达情况,结果显示MALAT1在肝细胞癌组织内的表达水平明显高于相对应的癌旁组织。而Liu等[15]在研究29例肝细胞癌患者MALAT1表达情况时却未发现患者肝癌组织和癌旁组织的MALAT1表达水平存在差异,这可能与该研究的病例数较少有关。以上结果提示MALAT1表达水平能够提示肿瘤复发,为临床随访患者预测肿瘤复发提供依据。
本研究对于肝细胞癌中MALAT1的表达与肝癌临床病理特征之间的关系研究显示:MALAT1的表达与患者年龄大小、有否乙肝、有否肝硬化、肿瘤最大径、肿瘤数目、肿瘤TNM分期、肿瘤有否血管侵犯、病理分化程度以及术前AFP水平等因素均未表现出显著相关性。上述研究结果表明,MALAT1是一个与临床病理特征因素相对独立的指标。
3.3 长链非编码RNA与肝癌复发的关系及其对围术期治疗策略的启示本研究对于肝癌组织中MALAT1的表达水平与肝癌患者手术预后的关系显示:相对于MALAT1低表达组患者,肝癌组织中MALAT1高表达者显示更为不良的预后。MALAT1低表达组患者1年、3年和5年肝癌术后累计生存率分别为85.9%、55.2%和33.8%,而高表达组患者为66.0%、34.6%和3.9%。多因素COX回归模型分析显示,肿瘤有血管侵犯及MALAT1高表达是预测肝癌肝切除术后预后的独立危险因素。以上说明长链非编码RNA MALAT1的过度表达可以提示肝细胞癌的侵袭和复发过程,预测肝细胞癌患者的长期预后。
综上所述,长链非编码RNA MALAT1在肝细胞癌的发生、发展、复发、侵袭的过程中具有明显调控作用,对于因肝癌行肝切除术的患者具有一定的临床应用价值。故而临床医师在围手术期对患者评估中应重视其表达水平对患者预后及转归的影响,术后应通过肝穿刺活检规律监测患者MALAT1表达水平变化,及时选择合理的治疗策略。
[1]Zhou T,Gao Y.Increased expression of LncRNA BANCR and its prognostic significance in human hepatocellular carcinoma[J]. World J Surg Oncol,2015,14(1):1-8.doi:10.1186/s12957-015-0757-5.
[2]Zou H,Shao CX,Zhou QY,et al.The role of lncRNAs in hepatocellularcarcinoma:opportunitiesasnoveltargetsfor pharmacologicalintervention[J].ExpertRevGastroenterol Hepatol,2016,10(3):331-340.doi:10.1586/17474124.2016. 1116382.
[3]Kamel MM,Matboli M,Sallam M,et al.Investigation of long noncoding RNAs expression profile as potential serum biomarkers in patients with hepatocellular carcinoma[J].Transl Res,2016,168:134-145.doi:10.1016/j.trsl.2015.10.002.
[4]Zhang H,Zhu C,Zhao Y,et al.Long non-coding RNA expression profiles of hepatitis C virus-related dysplasia and hepatocellular carcinoma[J].Oncotarget,2015,6(41):43770-43778.doi: 10.18632/oncotarget.6087.
[5]Zhang J,Fan D,Jian Z,et al.Cancer specific long noncoding RNAs show differential expression patterns and competing endogenous RNA potential in hepatocellular carcinoma[J].PLoS One,2015,10(10):e0141042.doi:10.1371/journal.pone.0141042.
[6]Wang J,Wang H,Zhang Y,et al.Mutual inhibition between YAP and SRSF1 maintains long non-coding RNA,Malat1-induced tumourigenesis in liver cancer[J].Cell Signal,2014,26(5):1048-1059.doi:10.1016/j.cellsig.2014.01.022.
[7]Zamani M,Sadeghizadeh M,Behmanesh M,et al.Dendrosomal curcumin increases expression of the long non-coding RNA gene MEG3 via up-regulation of epi-miRs in hepatocellular cancer[J]. Phytomedicine,2015,22(10):961-967.doi:10.1016/j. phymed.2015.05.071.
[8]Jiang X,Yan Y,Hu M.Increased level of H19 long noncoding RNA promotes invasion,angiogenesis,and stemness of glioblastoma cells[J].J Neurosurg,2016,124(1):129-136.doi:10.3171/2014.12. JNS1426.
[9]Lu Z,Xiao Z,Liu F,et al.Long non-coding RNA HULC promotes tumor angiogenesis in liver cancer by up-regulating sphingosine kinase 1(SPHK1)[J].Oncotarget,2016,7(1):241-254.doi: 10.18632/oncotarget.6280.
[10]Feo F,Simile MM,Pascale RM,et al.Focal loss of long noncoding RNA-PRAL,as determinant of cell function and phenotype of hepatocellular carcinoma[J].Ann Transl Med,2016,4(9):183. doi:10.21037/atm.2016.03.47.
[11]Liu F,Xiang G,Jiang D,et al.Ultrasensitive strategy based on PtPd nanodendrite/nano-flower-like GO signal amplification for the detection of long non-coding RNA[J].Biosens Bioelectron,2015,74(12):214-221.doi:10.1016/j.bios.2015.06.021.
[12]George J,Patel T.Noncoding RNA as therapeutic targets for hepatocellular carcinoma[J].Semin Liver Dis,2015,35(1):63-74.doi:10.1055/s-0034-1397350.
[13]Shibata C,Otsuka M,Kishikawa T,et al.Diagnostic and therapeutic application of noncoding RNAs for hepatocellular carcinoma[J].World J Hepatol,2015,7(1):1-6.doi:10.4254/wjh. v7.i1.1.
[14]Heikenwalder M,Protzer U.LINE(1)s of evidence in HBV-driven liver cancer[J].Cell Host Microbe,2014,15(3):249-250. doi:10.1016/j.chom.2014.02.015.
[15]Liu WT,Lu X,Tang GH,et al.LncRNAs expression signatures of hepatocellular carcinoma revealed by microarray[J].World J Gastroenterol,2014,20(20):6314-6321.doi:10.3748/wjg.v20. i20.6314.
(2016-05-11收稿 2016-10-05修回)
(本文编辑 李鹏)
Expression and clinical significance of long chain non-coding MALAT1 RNA in patients with hepatocellular carcinoma
LIU Xingqiang1,WANG Xia2,LIU Chao3,HU Yu4△
1 Department of General Surgery,2 Department of Emergency,Tianjin Unite Medicine Center Hospital,Tianjin 300121,China; 3 Department of Cardiology,Tianjin Chest Hospital;4 Department of Anesthesiology,the 452nd Hospital of PLA△
ObjectiveTo explore the relationship between long chain non-coding RNA metastasis-associated lung adenocarcinoma transcript 1(MALAT1)and prognosis of hepatocellular carcinoma,and to provide evidence for perioperative treatment.MethodsOne hundred and twenty five samples from patients with hepatocellular carcinoma treated in Tianjin Unite Medicine Center Hospital during June 2008 to June 2014 were collected in this study.The expression of MALAT1 was detected by using real-time quantitative PCR(RT-qPCR).The relationship between MALAT1 expression level and prognosis of patients with hepatectomy was analyzed.The risk factors affecting the prognosis of patients were determined.ResultsThe expression level of MALAT1 was significantly higher in hepatocellular carcinoma samples(P<0.05).There was no relationship between the expression of MALAT1 with age,hepatitis B history,cirrhosis history,tumor size,tumor number,tumor TNM stage,vascular invasion,pathological differentiation and preoperative alpha-fetoprotein(AFP)level (P>0.05).The survival rate was calculated with Kaplan-Meier method.The overall 1-,3-and 5-year survival rates in low level MALAT1 group were 85.9%,55.2%and 33.8%.The overall 1-,3-and 5-year survival rates in high level MALAT1 group were 66.0%,34.6%and 3.9%,respectively.There was significant difference in survival rate between the two groups(P<0.01).The multivariate COX regression model analysis showed that the independent risk factors for postoperative survival rate in patients with hepatocellular carcinoma included tumor vascular invasion(RR=3.055,95%CI:1.986-4.053, P<0.01)and over expression of MALAT1(RR=2.918,95%CI:1.736-3.672,P<0.01).ConclusionLong chain non-coding RNA MALAT1 is a novel tumor marker for prognosis of hepatectomy in patients with hepatocellular carcinoma,which can be used for preoperative and postoperative evaluation in patients with hepatocellular carcinoma.
carcinoma,hepatocellular;prognosis;MALAT1
R735.7
A
10.11958/20160403
中国博士后科学基金资助项目(2013M530880,2015M581308)
1天津市人民医院普通外科(邮编300121),2急诊科;3天津市胸科医院心内科;4解放军452医院麻醉科
刘兴强(1966),男,本科,副主任医师,主要从事普通外科研究
△通讯作者E-mail:896221780@qq.com

