抗菌肽对脂多糖导致的仔猪肝脏氧化应激的影响
■ 张海文 施平伟 洪 枫 王学梅 吴科榜 管庆丰*
(1.海南大学农学院,海南海口570228;2.海南大学热带动物繁育与营养学实验室,海南海口570228)
先天免疫反应起始于宿主识别病原菌高度保守的分子结构,又被称为病原模式分子,细菌的脂多糖(LPS)是最具有活性的病原模式分子,其可以促进诱导先天免疫系统激活,进而引发机体炎症的发生[1]。仔猪在由母乳过渡到饲料的过程中,由于饲料组成,环境及自身免疫系统发育尚未成熟等因素,在LPS刺激下,极易导致机体发生免疫及氧化应激反应。肝脏是极其重要的代谢器官之一,由于其耗氧量大,因此会产生较多的氧自由基[2]。LPS作为革兰氏阴性菌细胞壁的结构物质,不仅可促进炎性细胞因子的产生,而且可诱导机体产生大量的自由基,直接导致细胞的氧化损伤[3]。
抗菌肽广泛存在于各种生物体中,具有抗菌、抗病毒、免疫调节、组织修复等功能而得到普遍关注[4],CJH抗菌肽是从爬行动物金环蛇中发现并提取出来的一种Cathelicidin家族抗菌肽,前期研究表面其在抗革兰氏阴性菌方面具有极高的活性,且具有较好的稳定性和安全性[5],因此本试验通过建立LPS致仔猪肝脏氧化应激模型,拟探讨抗菌肽CJH在缓解仔猪肝脏氧化损伤方面的作用,进一步分析其可能的作用途径,为将其应用至保护由细菌感染导致的仔猪肝脏氧化损伤方面奠定理论基础。
1 材料与方法
1.1 试验材料
抗菌肽CJH合成于吉尔生化(上海)有限公司,RP-HPLC检测纯度达到95%以上,细菌脂多糖(Escherichia coliO55∶B5)购于Sigma公司(美国)。
1.2 试验动物
试验所用仔猪购于海南屯昌黑猪养殖合作社,选择个体大小及体重接近[平均体重(6.43±0.79)kg]的21 d断奶的屯昌黑猪18头(28日龄,♂),饲养于海南大学农学基地,预饲7 d,试验期14 d。期间自由饮水和采食。
1.3 试验日粮
试验采用常规的玉米-豆粕型基础日粮,依据NRC(1998)配制成颗粒料,基础日粮配方及营养水平见表1。
1.4 试验分组及设计
于预饲期(7 d)结束后,按照每组平均体重尽量一致的原则,将18头仔猪随机分配为3组,分别为空白对照组,LPS组和CJH+LPS组,其中CJH+LPS组在试验的第2、6、10、14 d腹腔注射0.5 mg/kg单位体重的CJH,注射体积为2ml,对照组和LPS组在同一天注射相同体积的0.9%生理盐水,LPS组和CJH+LPS组在试验第1 d和第14 d腹腔注射100 μg/kg单位体重的LPS,注射体积为1 ml,对照组注射等体积的0.9%生理盐水,所有仔猪于第14 d注射后12 h屠宰,期间正常饮水,禁止采食。
1.5 检测指标
1.5.1 免疫器官指数测定
试验结束后,对每头仔猪进行称重,屠宰,取对应仔猪完整的肝脏、胸腺与脾脏,将其周围脂肪分离干净,称重,计算各自免疫器官指数[免疫器官指数=免疫器官重(g)/仔猪活重(kg)]。
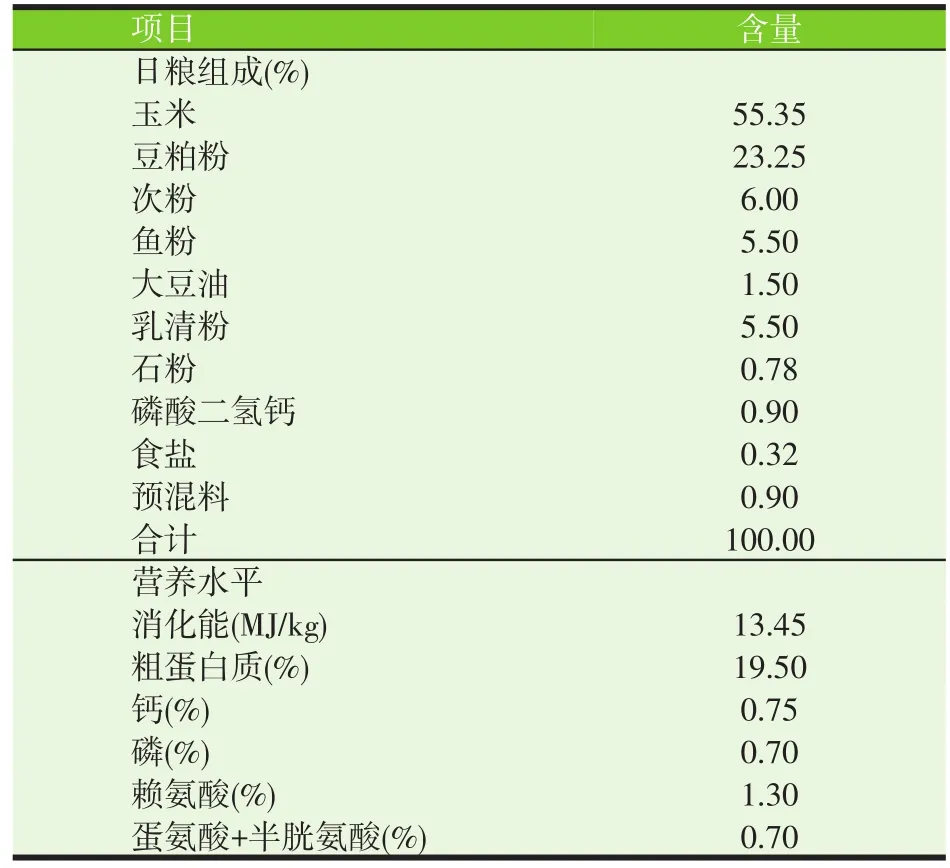
表1 试验日粮配方及营养水平(干物质基础)
1.5.2 肝脏抗氧化指标测定
取出之前冻存的肝脏组织,按照体积比加入9倍体积的生理盐水,进行组织匀浆后低温离心(4℃,8 000 r/min)15 min,取上清。利用BCA蛋白定量试剂盒(凯基,南京)测定上清蛋白浓度,利用GSH-Px、T-SOD、CAT和MDA(建成生物,南京)试剂盒测定上述指标,具体步骤按照试剂盒说明书进行操作。
1.5.3 肝脏炎性细胞因子测定
肝脏炎性细胞因子TNF-α、IL-1β和IL-6指标采用试剂盒(R&D,美国)测定,具体步骤参见试剂盒说明书进行。
1.5.4 肝组织病理学检测
每组选取肝组织中叶三处部位(2 cm×2 cm×2 cm),用提前配制的4%多聚甲醛保存过夜,进行常规石蜡包埋后,切片进行苏木精-伊红(HE)染色,封片后制备组织切片,用Olympus BX41(奥林巴斯,日本)光学显微镜在200×下进行肝组织病理学观察并拍照。
1.6 数据处理
利用SPSS18.0软件ANOVA法对原始试验数据进行统计分析,各组数据以“平均值±标准误”表示,组间差异显著性检验用Duncan's法多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同处理对仔猪免疫器官指数的影响(见表2)
由表2可知,与对照组相比,LPS组显著降低了肝脏、脾脏及胸腺指数(P<0.05),说明LPS刺激抑制了重要免疫器官的发育,尤其中枢免疫器官胸腺的发育与T细胞的分化密切相关,而在LPS刺激的同时定期的通过腹腔注射抗菌肽CJH的组别,其免疫器官指数与对照组相比表现为差异不显著,表明抗菌肽CJH具有保护LPS导致的免疫器官发育受损的功能。

表2 免疫器官指数测定(g/kg)
2.2 不同处理对仔猪肝脏抗氧化功能的影响(见表3)
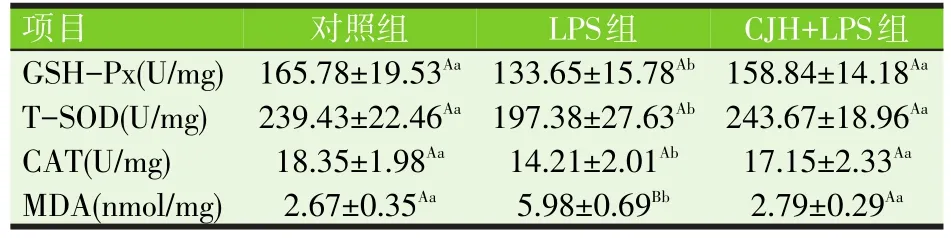
表3 肝脏抗氧化指标测定
由表3可知,与对照组相比,LPS组显著降低了肝组织主要抗氧化酶GSH-Px、T-SOD、CAT的活性(P<0.05),极显著提高了肝组织脂质过氧化主要产物MDA的含量(P<0.01),表明LPS刺激破坏了肝脏的抗氧化酶系统,导致组织氧化损伤的发生,而通过给药抗菌肽CJH后,肝组织抗氧化酶GSH-Px、T-SOD、CAT的活性恢复至接近对照组水平,同时肝组织MDA浓度也明显下调至与对照组水平接近。
2.3 不同处理对仔猪肝组织炎性细胞因子分泌的影响(见表4)

表4 肝脏炎性细胞因子测定(μg/g)
由表4可知,通过测定主要促炎因子TNF-α、IL-1β、IL-6在肝脏组织的分泌水平发现,与对照组相比,LPS组极显著提高了促炎因子TNF-α的分泌水平(P<0.01),显著提高了促炎因子IL-1β和IL-6的浓度(P<0.05),而CJH+LPS组明显缓解了由LPS导致的上述细胞因子的异常升高,与对照组均呈现差异水平不显著。LPS刺激可导致机体免疫反应过度激活,从而引发炎症,而在炎症发生后,抗菌肽CJH的介入可显著下调促炎因子的分泌,表明其具有缓解机体炎症的功能,这可能与其维护肝组织的抗氧化功能有关联。
2.4 不同处理对仔猪肝组织形态的观察(见图1)
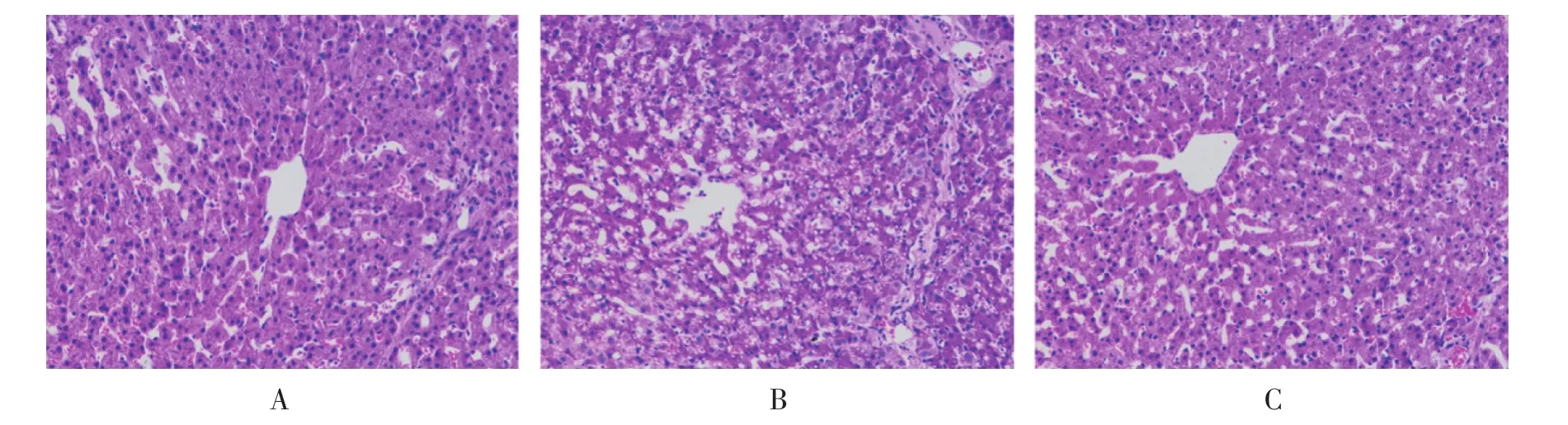
图1 不同处理仔猪肝脏组织病理学切片(A∶对照组,B∶LPS组,C∶CJH+LPS组 200×)
由图1可知,通过肝组织的HE染色切片观察,发现对照组肝小叶分支清楚,肝细胞索排列比较规则,呈放射状分布,肝细胞间连接紧密,而LPS处理组肝脏表现为局部细胞出现明显空泡化变性,部分胞核位于细胞的一侧或消失,部分肝细胞呈点状坏死,肝细胞索排列不规则,界线不清,CJH+LPS组与LPS组相比,肝细胞空泡化变性症状得到显著改善,且肝小叶不同带分支比较清楚,肝脏基本结构清晰完整。表明抗菌肽CJH可能通过缓解肝脏炎症水平,由此降低肝组织氧化损伤。
3 讨论
3.1 不同处理对仔猪免疫器官指数的影响
动物的免疫器官指数是评价机体免疫状态的常用指标,与机体免疫力呈现高度正相关。脾脏内含有大约40%左右的T淋巴细胞和60%的B淋巴细胞,在体液免疫中发挥重要作用,胸腺作为中枢免疫器官,与T细胞的发育及细胞免疫密切相关,肝脏虽然不是典型的免疫器官,但其仍参与到免疫反应环节中[6]。本研究发现LPS刺激导致断奶仔猪肝脏、脾脏、胸腺指数与对照组比较显著下降(P<0.05),表明LPS引发了机体的免疫应激症状,导致免疫器官发育受阻,而抗菌肽CJH的介入有效解除了这一免疫抑制,说明其通过特定途径缓解了机体的应激状态。
3.2 不同处理对仔猪肝脏抗氧化功能的影响
肝脏内若产生过多的自由基积聚,会导致肝脏氧化损伤,引起肝细胞功能紊乱[7]。GSH-Px、T-SOD和CAT是主要分布在细胞器膜上的抗氧化酶,由LPS诱导所产生的过量自由基通过攻击细胞及细胞器的膜结构,不仅会导致细胞器发生功能性障碍,而且还会导致细胞膜结构受损,使得抗氧化酶失去发挥活性的载体,最终导致抗氧化酶活性丧失[8-9]。而MDA浓度升高则表明细胞发生脂质过氧化程度较深。本研究发现,LPS导致肝组织GSH-Px、T-SOD和CAT水平显著降低(P<0.05),且极显著提高了肝脏中MDA的浓度(P<0.01),该结果表明LPS导致肝组织发生了严重的氧化应激,后续的肝脏病理切片也证实了这一结论:肝组织发生明显的病变与损伤。而CJH的介入有效的缓解了氧化应激的程度,肝脏的抗氧酶活性及MDA水平也得到了明显的恢复,目前尚未有报道抗菌肽CJH具有直接参与抗氧化的功能,然而组织炎症水平的升高会导致过量自由基的产生,间接引发氧化损伤,因此,接下来对肝组织炎性细胞因子的分泌水平进行了检测。
3.3 不同处理对仔猪肝组织炎性细胞因子分泌及肝组织形态的影响
肝脏中的免疫细胞如巨噬细胞,枯否氏细胞可以识别病原体相关模式分子,在炎症反应中发挥重要作用[10]。当感染发生时,作为病原模式分子之一的LPS会与免疫细胞表面的受体CD14发生结合,并通过脂多糖结合蛋白(LBP)形成LPS-LBP-CD14三联复合物,激活TLR4启动跨膜信号转导及相关促炎细胞因子的转录与合成,发挥促炎效应[11]。本研究发现LPS刺激极显著提高了强致炎因子TNF-α的分泌(P<0.01),显著提高了致炎因子IL-1β和 IL-6的水平(P<0.05),表明肝组织发生了明显的炎症反应。同时通过对肝组织进行HE染色的病理学观察也证实了这一结论。通过抗菌肽CJH的介入,有效下调了肝组织炎性因子的分泌水平,同时明显改善了肝脏的病理形态,这与此前关于抗菌肽CJH具有缓解炎症的功能的报道保持一致[12]。至于抗菌肽是否能直接参与肝组织损伤修复,还有待进一步的研究。
4 结论
综上所述,本试验发现抗菌肽CJH可通过改善组织炎症水平,缓解由LPS导致的仔猪肝脏氧化应激状态,从而保护肝脏的抗氧化功能以及维持自身结构正常。

