吸烟对COPD患者尿锁链素及肺功能的影响
徐德华++++++陈晓东++++++刘华清++++++唐纪文++++++叶妙琴
[摘要]目的 探讨吸烟对COPD患者尿锁链素水平及肺功能的影响。方法 选择2016年1~6月我院60例处于稳定期的COPD患者作为研究对象,根据是否吸烟将其分为COPD吸烟组30例和COPD非吸烟组30例,选取同期来医院进行健康体检的30例健康人作为健康对照组。采用间接竞争性酶联免疫吸附法测定所有受试者的尿锁链素水平,同时检测受试者的肺功能。结果 COPD吸烟组及COPD非吸烟组尿锁链素水平均显著高于健康对照组(P<0.05),而第1秒用力呼气量占用力肺活量百分率(FEV1%)则显著低于健康对照组(P<0.05);COPD吸烟组尿锁链素水平较COPD非吸烟组高(P<0.05);COPD吸烟组FEV1%低于COPD非吸烟组(P<0.05);COPD吸烟组受试者吸烟指数与尿锁链素水平呈正相关(r=0.435,P<0.05),而与FEV1%呈明显负相关(r=-0.516,P<0.05),尿锁链素水平与FEV1%呈负相关(r=-0.614,P<0.05)。结论 吸烟可引起COPD患者尿锁链素水平升高,FEV1%降低。尿锁链素的变化提示发生肺部损伤的可能性。戒烟是预防和干预COPD的重要措施。
[关键词]慢性阻塞性肺疾病;尿锁链素;肺功能
[中图分类号] R563 [文献标识码] A [文章编号] 1674-4721(2016)10(c)-0023-03
[Abstract]Objective To explore the effect of smoking on the lung function and urine desmosine with chronic obstructive pulmonary disease (COPD).Methods 60 cases of COPD patients in stable phase admitted in our Hospital from January to June 2016 were divided into COPD smoking group(n=30) and COPD nonsmoking group(n=30),and another 30 healthy people underwent physical examination during the same period were selected as the control group.The levels of urine desmosine of all the cases were measured by indirect competitive enzyme-linked immunosorbent assay (IC-ELISA),at the same time their lung function was also tested.Results The levels of urine desmosine in COPD smoking group and COPD nonsmoking group was significantly higher than that of the control group respectively(P<0.05),while FEV1% of the two COPD groups was significantly lower than that of the control group respectively(P<0.05);the level of urine desmosine of COPD smoking group was significantly higher than that of COPD nonsmoking group(P<0.05),and FEV1% of COPD smoking group was significantly lower than that of COPD nonsmoking group(P<0.05).Smoking index was positively correlated with the levels of urine desmosine(r=0.435,P<0.05),and smoking index negatively correlated with FEV1% and the levels of urine desmosine (r1=-0.516,r2=-0.614,P<0.05).Conclusion Smoking can lead to the rise of the levels of urine desmosine and the reduce of FEV1%.Changes in urine desmosine suggest the possibility of lung injury.Smoking cessation is an important measure to prevent and interfere with COPD.
[Key words]Chronic obstructive pulmonary disease;Urine desmosine;Lung function
长期吸烟是现在已知慢性阻塞性肺疾病(COPD)的最重要诱因。吸烟可以引起多种炎症细胞聚集在肺中,蛋白水解酶-抗蛋白水解酶体系失衡、氧化应激以及凋亡机制,导致慢性气道炎症[1]。有研究认为COPD病因可能与肺脏吸入烟草、烟雾等有毒、有害气体或颗粒产生的异常炎症反应有关。程显声等[2]研究证实,在我国导致COPD的最主要因素也是吸烟。近年研究发现,锁链素(desmosine,DES)是弹性蛋白的特征性产物和肺损伤的生物标志物[3]。相关研究结果表明,DES在尿中排泄量的多少能够准确反映COPD患者肺组织损伤的程度。本研究通过测定COPD患者在吸烟和非吸烟和健康人群中尿DES水平以及肺功能的变化,旨在探讨尿DES与吸烟相关COPD发病的关联性。
1资料与方法
1.1一般资料
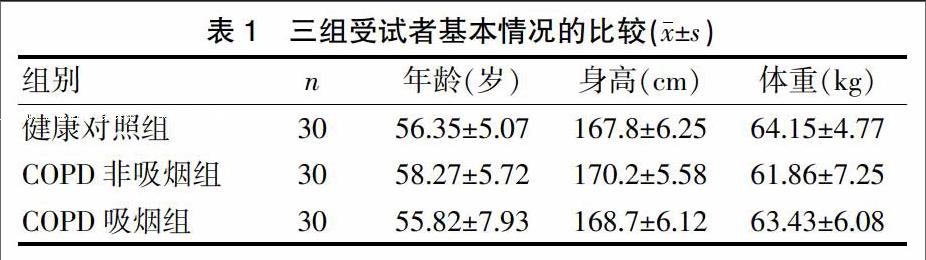
选择2016年1~6月于惠州市中医医院呼吸科门诊就诊的处于稳定期的COPD患者60例。COPD纳入标准:符合2011年修订的《慢性阻塞性肺疾病诊治指南》诊断标准。排除标准:合并与DES相关的系统疾病,如大动脉血管及皮肤损伤性疾病者;呼吸衰竭肺源性心脏病、肺结核、肺癌、间质性肺疾病、糖尿病、冠心病、高血压、慢性肾衰竭者以及糖皮质激素使用者。根据受试者有无吸烟史将其分为COPD吸烟组与COPD非吸烟组,每组30例;健康对照组选择同期健康体检者30例。入选标准:既往无心肺系统疾病,无高血压、冠心病、糖尿病等慢性疾病,肺功能、血常规、肝肾功能、胸部X线片、心电图检查均正常者,且均无吸烟史。三组患者在年龄、身高、体重方而比较,差异无统计学意义(P>0.05)(表1),具有可比性。
1.2方法
1.2.1吸烟情况 吸烟指有规律地每天吸1支以上,持续1年以上。不吸烟指一生中从不吸烟,或累计吸烟量<20包。吸烟指数=每日吸烟支数×吸烟年数。
1.2.2肺功能测定 采用意大利Cosmed肺功能仪对所有实验者均测定第1秒用力呼气容积(forced expiratory volume in first second,FEV1)占预计值百分比(FEV1%)。
1.2.3尿中DES的测定 应用间接竞争性酶联免疫吸附法(indirect competitive enzyme-linked immunosorbent assay,IC-ELISA)测定DES[4]。DES ELISA检测试剂盒为美国进口分装药盒(美国Cusabio公司),购自上海希美化学有限公司。
将兔抗DES-血蓝蛋白结合物的血清与不同浓度梯度的DES标准品(0~1 ng)进行混合孵育;同时将96孔板用DES-白蛋白结合物进行包被;包被后的96孔板用含0.05%Tween 20和1%BSA进行封闭;向96孔板中加入孵育的DES标准品混合液进行竞争性结合反应;继之按ELISA的常规方法操作完成。收集患者夜间12 h尿液,测定尿肌酐浓度,测量体积后在6N HCl 110CC下酸解24 h,在层流间里加热蒸发浓缩尿液,在预测尿肌酐浓度在100 μg/ml范围内检测浓缩尿液中DES的含量。
1.3统计学方法
采用SPSS 13.0统计软件对数据进行分析,计量资料以均数±标准差(x±s)表示,多组间的比较采用成组设计的单因素方差分析,两两比较采用SNK-q检验,两变量的相关性分析采用Pearson直线相关分析,以P<0.05为差异有统计学意义。
2结果
2.1三组受试者尿DES水平以及肺功能指标FEV1%的比较
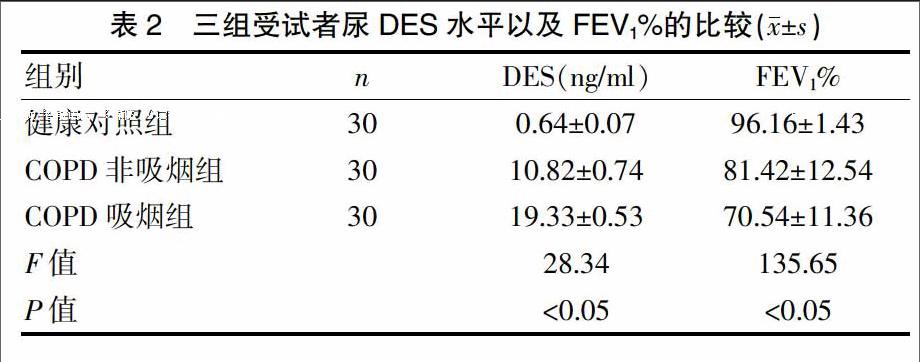
三组受试者尿DES水平以及FEV1%比较,差异有统计学意义(P<0.05);COPD吸烟组及COPD非吸烟组中的尿DES水平均显著高于健康对照组(q=-7.524,P<0.01),而FEV1%则显著低于健康对照组(q=8.352,P<0.01);COPD吸烟组尿DES水平较COPD非吸烟组显著增高(q=3.459,P<0.01),COPD吸烟组FEV1%低于非吸烟组(q=-5.248,P<0.01)(表2)。
2.2 COPD吸烟组中吸烟指数与尿DES的相关分析
COPD吸烟组受试者的吸烟指数与尿DES水平呈正相关(r=0.435,P<0.05),与FEV1%呈负相关(r=-0.526,P<0.05)。尿DES水平与FEV1%呈负相关(r=-0.614,P<0.05)。
3讨论
COPD是呈进行性发展的不完全可逆的气流受限的肺部疾病。吸烟是引起COPD的确定性环境因素,其可以引起多种炎症细胞聚集在肺中,通过烟草中的毒性物质焦油、尼古丁和氢氰酸直接损伤,炎性细胞(中性粒细胞、巨噬细胞、T淋巴细胞)、蛋白酶和抗蛋白酶失衡,氧化和抗氧化失衡等机制对肺组织结构造成破坏,从而导致COPD。烟草烟雾中有害物质对呼吸道黏膜的损害与时间、数量的增加有显著相关性。因此,随着吸烟年限与数量的增加,肺功能的损害越严重[5]。
DES是弹性蛋白中的特有结构,弹性蛋白是成熟弹性纤维的主要成分,在肺部含量丰富。DES是成熟弹性蛋白特有的交联氨基酸,游离DES结构稳定,不易分解,不参与机体代谢。体液中的DES只能够来自弹性蛋白的分解。DES具有以下特点:①不能从饮食中吸收;②血中的DES只经肾脏从尿液中排泄。由此可见,尿中DES水平的高低能够直接反映体内病变组织中弹性蛋白降解的多少,可作为反映富含弹性蛋白组织受累程度的重要参数和指标。Memtsoudis等[6]研究发现,DES是COPD患者、吸烟者和ARDS患者肺损伤的可靠标志物。Stockley[7]提出,DES可以作为COPD疾病发展的生物标志物。
Stone等[8]发现,COPD患者和吸烟者尿液DES含量均高于不吸烟者,且COPD患者高于吸烟者。Luisetti等[9]发现,用弹性蛋自酶抑制剂治疗COPD病史较短患者后,尿液中DES含量明显下降。有研究发现吸烟者FEV1较非吸烟者下降更快。吸烟者较不吸烟者相比,肺功能更差,每年FEV1下降速度更快[10]。有研究结果表明,吸烟可使COPD患者病情加重[11]。
本研究结果显示,COPD吸烟组受试者的FEV1%显著低于COPD非吸烟组,且COPD吸烟组患者的FEV1%与吸烟指数呈显著负相关,说明吸烟者气流受限的发生早于非吸烟组。更凸显早期戒烟以阻止COPD患者肺功能的进一步下降的重要性。本试验结果尿中DES水平与FEV1%呈负相关,与Engstrim等[12-13]的研究结果一致。
本研究结果显示,COPD吸烟患者尿液DES水平高于COPD非吸烟患者,尿液中DES含量变化与吸烟指数呈正相关。吸烟通过各种机制损伤破坏肺组织,可能加剧肺部弹性蛋白的分解,导致尿液中游离DES水平升高。
综上所述,COPD是一种复杂的慢性气道炎性疾病,吸烟可通过多种途径和机制破坏肺脏组织结构,加剧肺部弹性蛋白的分解。吸烟是单一、可以控制的因素。目前比较明确的是戒烟能够减缓COPD患者FEV1下降趋势[14-15]。因此戒烟是吸烟COPD治疗的关键措施。
[参考文献]
[1]Di Stefano A,Caramori G,Ricciardolo FL,et al.Cellular and molecular mechanisms in chronic obstructive pulmonary disease:an overview[J].Clin Exp Allergy,2004,34(2):1156-1167.
[2]程显声,徐希胜,张珍祥,等.1992-1999年慢性阻塞性肺疾病、肺心病社区人群综合干预结果[J].中华结核和呼吸杂志,2001,24(10):579-583.
[3]徐骥,方以群,袁恒荣,等.锁链素作为肺损伤生物标记物的研究现状与展望[J].海军医学杂志,2011,32(5):357-359.
[4]Cocci F,Miniati M,Monti S,et al.Urinary desmosine excretion is inversely correlated with the extent of emphysema in patients with chronic obstructive pulmonary desease[J].Int J Biochem Cell Biol,2002,34(2):594-604.
[5]王伟民,王宾,范女,等.吸烟对肺功能的影响[J].四川医学,2006,27(l0):1032-1033.
[6]Memtsoudis SG,Starcher B,Ma Y,et al.The utility of urine desmosine as a marker of lung injury in spine surgery[J].HSS J,2010,6(2):160-163.
[7]Stockley RA.Biomarkers in COPD:time for a deep breath[J].Thorax,2007,62(8):657-660.
[8]Stone PJ,Gottlieb DJ,O′Connor GT,et al.Elastin and collagen degradation products in urine of smokers with and without chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,1995,151(4):952-959.
[9]Luisetti M,Sturani C,Sella D,et al.MR889,a neutrophil elastase inhibitor in patients with chronic obstructive pulmonary disease:a double-blind,randomized,placebo-controlled clinical trial[J].Eur Respir J,1996,9(7):1482-1486.
[10]John M,Lange A,Hoeming S,et al.Prevalence of anemia in chronic pulmonary disease:comparison to other chronic disease[J].Int J Cardiol,2006,111(3):365-370.
[11]Zhou Y,Wang C,Yao W,et al.COPD in Chinese nonsmokers[J].Eur Respir J,2009,33(3):509-518.
[12]Engstrm G,Lindberg C,Gerhardsson de Verdier M,et al.Blood biomarkers and measures of pulmonary function-a study from the Swedish twin registry[J].Respir Med,2012, 106(9):1250-1257.
[13]Lindberg CA,Engstrom G,de Verdier MG,et al.Total des-mosines in plasma and urine correlate with lung function[J].Eur Respir J,2012,39(4):839-845.
[14]Kohansal R,Martinez-Camblor P,Agustí A,et al.The natural history of chronic airflowo bstruction revisited:an anaiysis of the Framingham offspring cohort[J].Am J Respir Crit Care Med,2009,180(9):3-10.
[15]Kohansal R,Soriano JB,Agusti A.Investigating the natural history of lung function:facts,pitfalls,and opportunities[J].Chest,2009,135(12):1330-1341.

