血清粒细胞集落刺激因子与鳞状细胞癌相关抗原辅助诊断宫颈鳞状细胞癌的意义
舒丽红,丁显平
1.四川大学 生命科学学院(成都 610041);2.成都市第七人民医院 检验科(成都 610041)
·论 著·
血清粒细胞集落刺激因子与鳞状细胞癌相关抗原辅助诊断宫颈鳞状细胞癌的意义
舒丽红1,2,丁显平1△
1.四川大学 生命科学学院(成都 610041);2.成都市第七人民医院 检验科(成都 610041)
目的 通过分析血清中粒细胞集落刺激因子(G-CSF)和鳞状细胞癌相关抗原(SCC)的表达水平,探索G-CSF、SCC对辅助诊断宫颈癌的意义。方法 收集2011年4月至2016年2月在成都市第七人民医院行G-CSF、 SCC、癌胚抗原(CEA)、甲胎蛋白(AFP)检测的临床资料共1 250例。其中,经病理确诊的宫颈鳞癌患者358例(宫颈癌组),宫颈良性病变患者425例(宫颈良性病变组),健康体检者467例(健康对照组)。收集其G-CSF、 SCC、CEA和AFP检测值。采用方差分析组间各检测值差异,回归分析检测值在恶性肿瘤中的表达意义,SROC曲线分析SCC和G-CSF在诊断宫颈癌中的意义。结果 方差分析结果显示:宫颈癌组各检测值水平、检测值升高百分率均高于宫颈良性病变组和健康对照组,差异有统计学意义(P<0.05);G-CSF诊断宫颈癌SROC曲线下面积AUC=0.994,具有较高诊断准确性;SCC诊断宫颈癌SROC曲线下面积AUC=0.745,具有一定诊断准确性。STATA软件回归分析结果显示:G-CSF、SCC水平在良恶性肿瘤患者中比较,差异有统计学意义(P<0.05),其余指标比较,差异无统计学意义(P>0.05)。结论 宫颈癌患者G-CSF、SCC水平高于宫颈良性病变患者或健康人群,G-CSF、SCC可作为宫颈癌的辅助诊断指标。
G-CSF;SCC;宫颈癌;辅助诊断
宫颈癌是女性常见的恶性肿瘤之一,其发病率位居女性生殖系统恶性肿瘤首位[1-2]。流行病学研究显示,近年来宫颈癌发病率呈上升趋势,且倾向于年轻化[3]。早期筛选、预测和诊断宫颈癌是目前关注的热点。早期发现和诊断宫颈癌可降低患者死亡率,早期行手术根治宫颈癌患者可延长其生存期。目前,用于筛查和辅助诊断宫颈癌的方法较多,血清肿瘤标志物检测是一种较简便且重要的方法[4]。粒细胞集落刺激因子(G-CSF)在正常情况下主要由白细胞介素(IL-1)和肿瘤坏死因子(TNF-α)刺激后的纤维母细胞、淋巴细胞、巨噬细胞等产生[5]。研究[6-7]报道,恶性肿瘤细胞也可以产生G-CSF,但有关宫颈癌与G-CSF之间关系的研究尚少,且样本较少。本研究通过探讨宫颈癌患者、宫颈良性病变患者和健康体检者血清G-CSF、鳞状细胞癌相关抗原(SCC)及其他肿瘤标志物如癌胚抗原(CEA)、甲胎蛋白(AFP)与宫颈癌的相关性,分析其对宫颈癌辅助诊断的意义。
1 资料与方法
1.1 临床资料
收集2011年4月至2016年2月于成都市第七人民医院妇科就诊,且经病理确诊的宫颈鳞癌患者358例(宫颈癌组),宫颈良性病变者425例(宫颈良性病变组),健康体检者467例(健康对照组)。纳入标准:1)宫颈癌组:宫腔镜及病理学检查证实诊断为宫颈癌,并确诊其恶性程度,局部淋巴结转移情况,未行手术及放化疗治疗。2)宫颈良性病变组:既往无妇科及其他恶性肿瘤病史,宫腔镜及病理学检查证实为宫颈良性病变如宫颈糜烂、上皮内瘤变等。3)健康体检者:既往无宫颈癌及宫颈良性疾病病史,无合并其他肿瘤病史;宫腔镜及宫颈刮片检查未见异常组织。排除标准:1)合并子宫内膜癌、卵巢癌、外阴癌等其他妇科恶性病变的患者;2)合并食道、肺等其他鳞状细胞癌的患者;3)合并皮肤炎性病变患者;4)合并肝肾功能不全者;5)已行放化疗治疗者。 3组平均年龄依次为(47.6±9.8)岁、(47.3±10.2)岁、(42.0±11.7)岁。宫颈癌组:214例宫颈癌患者行宫颈癌根治性手术,144例不宜手术行放化疗治疗;其中非角化鳞癌234例、角化鳞癌124例;高分化49例、中分化172例、低分化137例;淋巴结转移120例、无转移238例。宫颈良性病变组:156例宫颈良性病变患者行宫颈环形锥切术,269例行保守治疗。所有入组患者均行肿瘤标志物、血常规、血生化、肝肾功能及心电图等常规检查,测定血清G-CSF浓度、SCC-Ag浓度及行HPV检测、宫颈刮片检查。入组手术患者术后均行病理检查。
1.2 仪器与试剂
G-CSF、SCC、CEA、AFP 均采用美国雅培公司ARCHITECT i2000化学发光免疫分析仪及其配套试剂进行检测。
1.3 血清肿瘤标志物的检测
3组患者均采集5 mL静脉血于促凝管中,于离心机中以1 370×g的相对离心力离心5 min,吸取样本血清检测G-CSF、SCC、CEA、AFP值。
1.4 HPV检测及宫颈涂片检测
1.4.1 HPV检测 以专用取材器材置于宫颈口处逆时针转 3圈, 停留 10 s左右,将棉签置于专用培养试管中送 HPV检测。
1.4.2 宫颈涂片检测 用 1次性木制宫颈刮板刮取宫颈鳞柱上皮交界处细胞, 均匀涂抹于刮片上, 送细胞室做巴氏分级。
1.5 统计学方法
采用SPSS 17.0和STATA统计软件对数据进行分析。所有连续型变量采用中位数(四分位数)表示,计量资料两组比较采用t检验,组间比较采用非参数检验(Kolmogorow-Smirnov);各组率的比较采用2检验;回归分析G-CSF、SCC、CEA、AFP因子在辅助诊断宫颈良恶性病变中的意义;SROC曲线分析G-CSF和SCC诊断宫颈癌的准确性;回归方法筛选与宫颈癌相关的血清肿瘤标志物。检验水准α设定为0.05。
2 结果
2.1 血清肿瘤标志物
结果显示:宫颈癌组血清G-CSF、SCC、CEA、AFP水平较宫颈良性病变组和健康对照组高,差异有统计学意义(P<0.05);宫颈癌组G-CSF、SCC、CEA、AFP值升高率大于宫颈良性病变组和健康对照组,差异有统计学意义(P<0.05);宫颈癌组较子宫良性病变组及健康对照组HPV感染率高,差异有统计学意义(P<0.05)(表1、表2)。
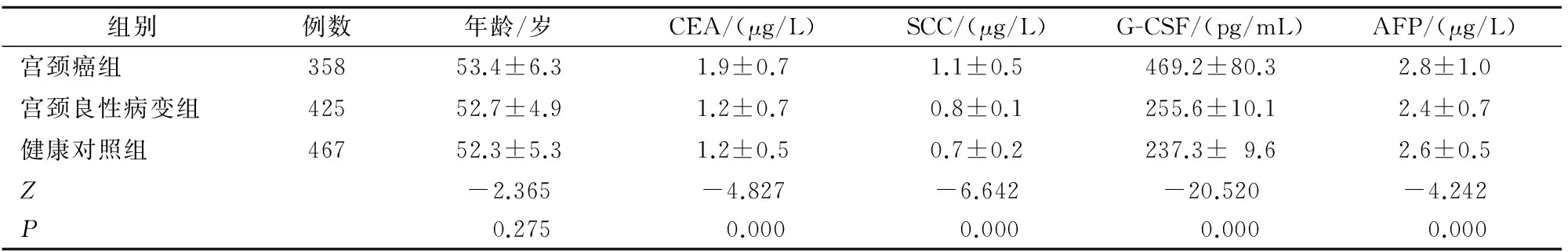
表1 3组肿瘤标志物水平比较
注:G-CSF:颗粒细胞集落刺激因子;AFP:甲胎蛋白;CEA:癌胚抗原; SCC:鳞状上皮细胞癌相关抗原
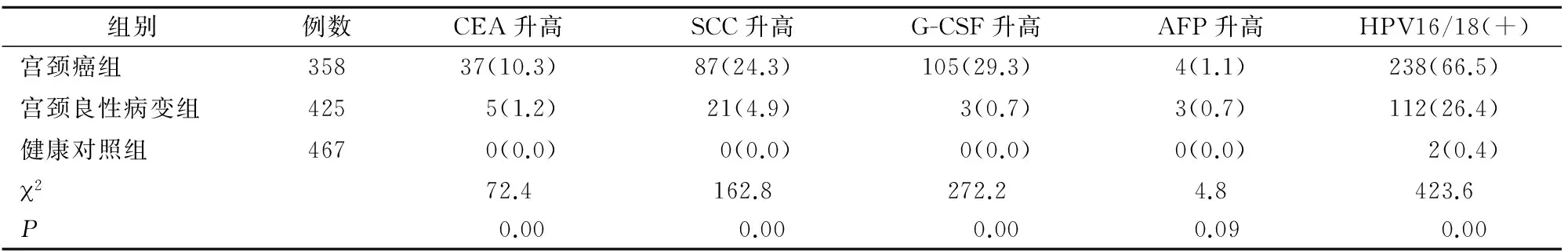
表2 不同肿瘤标志物升高百分比及HPV感染率[n(%)]
注:G-CSF:颗粒细胞集落刺激因子;AFP:甲胎蛋白;CEA:癌胚抗原; SCC:鳞状上皮细胞癌相关抗原;HPV:人乳头状瘤病毒
2.2 血G-CSF和SCC表达与宫颈病变恶性程度的关系
卡方检验结果显示:随着肿瘤分化程度降低,患者血G-CSF阳性率增高,差异有统计学意义(P<0.05)。当伴有淋巴结转移时会增加G-CSF表达的阳性率,角化鳞癌与非角化鳞癌G-CSF表达的阳性率比较,差异有统计学意义(P<0.05);检验结果显示:SCC表达阳性率与肿瘤分化程度有关,中分化时阳性率最高,高分化时最低,差异有统计学意义(P<0.05);淋巴结转移患者SCC表达高于未转移患者,差异有统计学意义(P<0.05);角化与非角化鳞癌二者比较,差异无统计学意义(P>0.05)(表3)。

表3 G-CSF与SCC在不同恶性程度宫颈癌中的表达情况[n(%)]
注:G-CSF:颗粒细胞集落刺激因子;SCC:鳞状上皮细胞癌相关抗原;高:高分化;中:中分化;低:低分化
2.3 回归分析结果
回归分析显示:血清G-CSF值与宫颈癌发生存在相关性,差异有统计学意义(P=0.000);血清SCC值与宫颈癌发生存在相关性,差异有统计学意义(P=0.000);肿瘤标志物CEA、AFP值显示相关性不显著,不建议作为宫颈癌的辅助诊断指标(表4)。2.4 SROC曲线评价G-CSF及SCC诊断准确性结果
G-CSF诊断宫颈癌SROC曲线下面积AUC=0.994(95%CI,0.000~1.000),具有较高诊断准确性;SCC诊断宫颈癌SROC曲线下面积AUC=0.745(95%CI,0.670~0.821),具有一定诊断准确性(图1)。

表4 血清肿瘤标志物回归分析结果
模型:yi=β0+β1x1+β2x2+β3x3+β4x4+εi,其中εi表示随机误差项。
注:Coef:常数项,控制变量系数;Std.Err:标准误;G-CSF:颗粒细胞集落刺激因子;AFP:甲胎蛋白;CEA:癌胚抗原; SCC:鳞状上皮细胞癌相关抗原
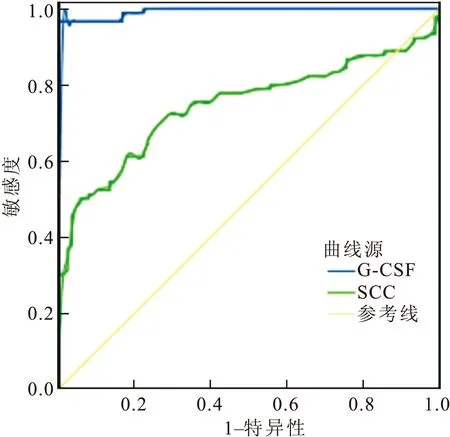
图1 G-CSF与SCC诊断准确性的SROC曲线
注:G-CSF:颗粒细胞集落刺激因子; SCC:鳞状上皮细胞癌相关抗原
3 讨论
宫颈癌发病率在女性易发恶性肿瘤中排第2位,仅次于乳腺癌。宫颈癌目前的治疗方式主要包括手术及放化疗,早期多以手术根治切除为主,中晚期则行同步放化疗。近年来,流行病学数据显示宫颈癌的发病呈年轻化上升趋势,如何在彻底清除病灶前提下保留阴道和卵巢功能的矛盾日益突出。因此,如何选择合适的方法对宫颈癌进行早期筛查和诊断至关重要[8]。血清肿瘤标志物检测是恶性肿瘤筛查与辅助诊断的重要工具之一。目前常用的血清肿瘤标志物主要包括CEA、CA125、CA199、AFP及SCC。报道[4,9]显示,仅SCC水平与宫颈鳞癌的侵袭转移相关。基础研究发现,G-CSF在乳腺癌、宫颈癌等恶性肿瘤中的水平异常升高,提示血清中的G-CSF值可能成为这些肿瘤的分子标记物。本研究通过收集检测宫颈癌患者、宫颈良性病变患者及健康体检者血清SCC、G-CSF值,分析其与宫颈癌的关系,且预测作为宫颈癌辅助诊断指标的意义。
本研究结果显示,宫颈癌组血清SCC值高于子宫良性病变组及健康对照组,差异存在统计学意义,且血清SCC升高比例大于宫颈良性病变组及健康对照组,差异有统计学意义。回归分析结果显示,SCC值与宫颈癌发生有关,具有统计学意义。宫颈癌病变多发生于宫颈鳞状上皮与柱状上皮交接移行处,SCC易在宫颈鳞癌类患者的血清和组织提取物中升高,其阳性率与宫颈癌分期相关,中晚期患者SCC水平较高。Arbyn等[10]研究认为Ⅰ期阳性率约为29%,Ⅳ期约为89%。张彦娜等[11]回归分析认为SCC对于宫颈癌患者具有较好的诊断价值,可作为宫颈癌辅助诊断的首选指标,此结果与本研究回归分析结果一致。研究认为血清中SCC水平与肿瘤体积也存在相关性,肿瘤体积越大其产生并释放到血液中癌抗原的概率也随之增加。Brioschi等[12]研究指出肿瘤体积>10 mL者约有92.6%的宫颈癌患者其SCC-Ag水平>2 ng/mL。本研究回顾性分析了血清G-CSF、SCC表达与宫颈癌恶性程度的关系,研究认为恶性程度越高上述两种指标阳性率越高,由此可见宫颈癌恶性程度与上述两种指标存在正相关趋势的联系。恶性程度越高的癌细胞,其增殖迁移性更强,局部异型鳞状上皮导致了SCC升高;而更强的迁移性癌细胞引起了G-CSF高表达。SROC曲线分析了G-CSF诊断宫颈癌的准确性,结果认为以病理结果为金标准,AUC=0.994(95%CI,0.000~1.000),具有较高诊断准确性;SCC诊断宫颈癌SROC曲线下面积AUC=0.745(95%CI,0.670~0.821),具有一定诊断准确性。此结果认为G-CSF与SCC对于诊断宫颈良恶性病变具有较高准确性。
本研究结果显示,宫颈癌组血清G-CSF值高于子宫良性病变组及健康对照组,差异有统计学意义,且血清G-CSF升高比例大于宫颈良性病变组及健康对照组,差异有统计学意义;回归分析结果显示,SCC值与宫颈癌发生有关,具有统计学意义。近年来,研究发现部分类型的肿瘤细胞也可分泌G-CSF, Ichiishi等[13]发现肺鳞癌可分泌表达G-CSF,此后相继有研究对伴外周血粒细胞计数增高的宫颈癌患者进行G-CSF血清学检测,结果发现血清中G-CSF水平升高,并与粒细胞计数成线性相关。血清中G-CSF表达水平与癌组织中粒细胞浸润相关。Strachan等[14]研究结果显示,宫颈癌组织可检测出G-CSF,表明宫颈癌细胞可产生G-CSF,并对粒细胞有趋化作用。由此说明宫颈癌组血清G-CSF增高的原因是因为癌细胞分泌产生了更多的G-CSF,而宫颈良性病变及健康宫颈细胞产生G-CSF量较小,与本次临床分析结果相符。研究[15]表明,G-CSF还可影响肿瘤血管生成,G-CSF的表达可作用于单核细胞在转录水平升高血管内皮生长因子(VEGF) mRNA,增加VEGF蛋白表达量,促使肿瘤新生血管形成[16]。因此,G-CSF高表达还会影响肿瘤的生长及转移,而肿瘤细胞又会进一步分泌G-CSF,故G-CSF水平与宫颈癌相关,可作为宫颈癌患者的筛查和辅助诊断指标。
综上所述,血清肿瘤标志物中G-CSF、SCC值可一定程度反应宫颈病变的良恶性,可作为宫颈癌的筛查和辅助诊断指标。由于本研究未对宫颈癌组病例进行临床分期讨论,病例间未能避免异质性,存在一定的局限性,部分病例未能同时检测G-CSF与SCC、未能分析联合检测两种指标对宫颈癌的阳性率,还需要进一步的研究和探讨。
[1]Jemal A, Bray F, Center M M,etal. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2]陈竺. 全国第三次死因回顾抽样调查报告[M]. 北京:中国协和医科大学出版社, 2008:1-214.
[3]Duffy M J. Tumor markers in clinical practice: a review focusing on common solid cancers[J]. Med Princ Pract, 2013, 22(1): 4-11.
[4]栾晓梅, 张瑶, 王诗卓, 等. 检测血清鳞状细胞癌抗原对宫颈鳞状细胞癌诊治及预后的临床意义[J]. 中华医学杂志, 2012, 92(19): 1330-1333.
[5]Demetri G D, Zenzie B W, Rheinwald J G,etal. Expression of colony-stimulating factor genes by normal human mesothelial cells and human malignant mesothelioma cells lines in vitro[J]. Blood, 1989, 74(3): 940-946.
[6]Groblewska M, Mroczko B, Wereszczyńska-Siemiatkowska U,etal. Serum levels of granulocyte colony-stimulating factor (G-CSF) and macrophage colony-stimulating factor (M-CSF) in pancreatic cancer patients[J]. Clin Chem Lab Med, 2007, 45(1): 30-34.
[7]Gutschalk C M, Herold-Mende C C, Fusenig N E,etal. Granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor promote malignant growth of cells from head and neck squamous cell carcinomas in vivo[J]. Cancer Res, 2006, 66(16): 8026-8036.
[8]DeNardo D G, Brennan D J, Rexhepaj E,etal. Leukocyte complexity predicts breast cancer survival and functionally regulates response to chemotherapy[J]. Cancer Discov, 2011, 1(1): 54-67.
[9]van de Lande J, Davelaar E M, von Mensdorff-Pouilly S,etal. SCC-Ag, lymph node metastases and sentinel node procedure in early stage squamous cell cervical cancer[J]. Gynecol Oncol, 2009, 112(1): 119-125.
[10] Arbyn M, Antoine J, Mägi M,etal. Trends in cervical cancer incidence and mortality in the Baltic countries, Bulgaria and Romania[J]. Int J Cancer, 2011, 128(8): 1899-1907.
[11] 张彦娜, 张昌卿,王骅,等.宫颈癌患者中联合检测血清VEGF及Scc-Ag的意义[J].中国癌症杂志,2002,12(3):231-233.
[12] Brioschi P A, Bischof P, Delafosse C,etal. Squamous-cell carcinoma antigen (SCC-A) values related to clinical outcome of pre-invasive and invasive cervical carcinoma[J]. Int J Cancer, 1991, 47(3): 376-379.
[13] Ichiishi E. Possible paracrine growth of adenocarcinoma of the stomach induced by granulocyte colony stimulating factor produced by squamous cell carcinoma of the oesophagus[J]. Gut, 2000, 46(3): 432-434.
[14] Strachan D C, Ruffell B, Oei Y,etal. CSF1R inhibition delays cervical and mammary tumor growth in murine models by attenuating the turnover of tumor-associated macrophages and enhancing infiltration by CD8(+) T cells[J]. Oncoimmunology, 2013, 2(12): e26968.
[15] Urdinguio R G, Fernandez A F, Moncada-Pazos A,etal. Immune-dependent and independent antitumor activity of GM-CSF aberrantly expressed by mouse and human colorectal tumors[J]. Cancer Res, 2013, 73(1): 395-405.
[16] Baldwin G C, Gasson J C, Kaufman S E,etal. Nonhematopoietic tumor cells express functional GM-CSF receptors[J]. Blood, 1989, 73(4): 1033-1037.
Clinical Significance of Granulocyte Serum Colony Stimulating Factor and Squamous Cell Carcinoma Antigen in the Diagnosis, Treatment and Prognosis of Cervical Cancer
ShuLihong1,2,DingXianping1△.
1.SchoolofLifeScience,SichuanUniversity,Chengdu610041,China; 2.ChengduSeventhPeople′sHospitalTheSeventhPeople′sHospitalofChengducity,Chengdu610041,China
Objective To explore the clinical significance of serum granulocyte colony stimulating factor (G-CSF) and squamous cell carcinoma antigen (SCC-Ag) in the diagnosis, treatment and prognosis of cervical cancer. Methods The clinical data of the serum G-CSF, SCC-Ag, carcinoembryonic antigen (CEA), and alpha-fetoprotein (AFP) were collected from 1250 cases who were tested between April of 2011 and February of 2016 in Chengdu Seventh People′s Hospital. Among those cases, 358 cases were diagnosed with cervical cancer, 425 cases were with cervical benign neoplasm, and 467 cases were healthy. The statistical variance analysis was used to analyze the differences in the data of the serum G-CSF, SCC-Ag, CEA and AFP, the regression analysis was adopted to explore the expression significance of the detection values in the malignant tumor, and the SROC curve analysis was used to evaluate the accuracy of SCC and G-CSF in the diagnosis of cervical cancer. Results The results of the statistical variance analysis showed that the levels of detection values and the percentage rises of those values in patients with cervical cancer were significantly higher than those in patients with cervical benign neoplasm and the healthy cases (P<0.05). The area under the curve (AUC) in the G-CSF diagnosis was 0.994 with high accuracy of diagnosing cervical cancer, and the AUC in the SCC diagnosis was 0.745 with moderate accuracy. The results of the regression analysis showed that the levels of G-CSF and SCC were significantly correlated with both benign and malignant cervical cancer and the other tumor markers were not significantly correlated with cervical cancer. Conclusion The levels of G-CSF and SCC in patients with cervical cancer are higher than those in patients with cervical benign neoplasm and healthy women, so they can be applied as auxiliary diagnosis indexes in the diagnosis, follow-up evaluation, treatment and prognosis of cervical cancer.
G-CSF; SCC; Cervical cancer; Auxiliary diagnosis
http://www.cnki.net/kcms/detail/51.1705.R.20161202.1622.002.html
10.3969/j.issn.1674-2257.2016.06.010
R737.33
A
△通信作者:丁显平,E-mail :2438075801@qq.com

