ER、PR、CD34、P16在乳腺叶状肿瘤中的表达及预后相关性分析
贾 翠,韩邦彩,何 飞,张录顺△
1.成都医学院 病理学教研室(成都 610500);2.成都医学院 临床医学院(成都 610500))
·论 著·
ER、PR、CD34、P16在乳腺叶状肿瘤中的表达及预后相关性分析
贾 翠1,韩邦彩2,何 飞2,张录顺1△
1.成都医学院 病理学教研室(成都 610500);2.成都医学院 临床医学院(成都 610500))
目的 通过分析常规组织学、免疫组织化学蛋白表达,探讨有助于乳腺叶状肿瘤(phyllodes tumors,PTs)预后判断的指标。 方法 回顾性分析79例乳腺PTs病例的组织学特点,以59例乳腺富细胞型纤维腺瘤病例作为对照,免疫组织化学检测ER、PR、CD34、P16表达,并随访,统计学分析其相关性。结果 79例乳腺PTs按半定量指标进行分级,良性、交界性和恶性PTs分别占58.2%、29.1%和12.7%。随访结果表明,乳腺PTs病例的局部复发率为20.0%(14/70),中位复发时间为24个月。乳腺富细胞型纤维腺瘤的局部复发率为9.8%(5/51),中位复发时间为45个月。ER、PR在乳腺PTs和富细胞型纤维腺瘤的间叶性肿瘤细胞中均未见表达。CD34在乳腺PTs和富细胞型纤维腺瘤中的阳性率分别为57.0%、89.8%;P16在乳腺PTs和富细胞型纤维腺瘤中的阳性率分别为53.1%、23.7%。差异均有统计学意义(P<0.05)。预后分析显示,CD34阳性率与乳腺PTs病例局部复发有显著相关性(P=0.001)。结论 CD34和P16有助于乳腺PTs和乳腺富细胞型纤维腺瘤的鉴别诊断,CD34是预测乳腺PTs预后有价值的指标。
乳腺肿瘤; 叶状肿瘤; 纤维腺瘤; 预后
乳腺纤维上皮性肿瘤包括一组从良性到恶性的乳腺双相性肿瘤,基于组织学特征分为:乳腺成人型纤维腺瘤、幼年型纤维腺瘤、复杂型纤维腺瘤和乳腺叶状肿瘤(phyllodes tumors,PTs)。幼年型纤维腺瘤多见于青春期女性,其中少数(<5%)体积巨大的肿瘤也称为巨大纤维腺瘤,组织学上间质细胞较丰富,常见导管内上皮增生,研究[1]将此类肿瘤命名为细胞型纤维腺瘤。乳腺PTs较为少见,占乳腺原发肿瘤的0.3%~1.5%,占乳腺纤维上皮性肿瘤的2.5%[2]。乳腺PTs很难和纤维腺瘤相鉴别,尤其是管内型纤维腺瘤和细胞型纤维腺瘤,二者的临床处理方式和预后也不一致,因此需要准确鉴别。有关乳腺PTs和纤维腺瘤的起源和相关性一直是研究人员关注的热点,但目前有关这方面的研究报道不多[3-4]。乳腺PTs的正确诊断非常重要,其预后判断也是临床关注的重点。复发是乳腺PTs的主要问题之一,目前对于PTs复发的相关因素从肿瘤大小、手术方式、免疫组化、分子遗传学等多方面的研究[5-6]报道结果不一,甚至互相矛盾。本研究收集了79例乳腺PTs和59例富细胞型纤维腺瘤病例,通过观察组织学特点、免疫组化检测蛋白表达,旨在找出二者的鉴别诊断指标;并通过随访寻找乳腺PTs潜在的预后指标,同时通过对二者的对比分析,进一步认识乳腺双相性肿瘤。
1 资料与方法
1.1 临床资料
收集2001-2014年在四川省肿瘤医院进行手术切除的乳腺PTs病例,经两位乳腺病理医师复核阅片,最终确定诊断79例,其中良性、交界性和恶性分别为46例(58.2%)、23例(29.1%)和10例(12.7%)。通过四川省人民医院伦理委员会同意,查阅患者的临床病理资料并随访。患者均为女性。乳腺PTs患者平均年龄40岁,乳腺富细胞型纤维腺瘤患者平均年龄27岁。两组患者病程从数天至30年,大部分病程在2年内。大体上,良性、交界性和恶性PTs差异不明显,大多数肿瘤呈结节状生长,界限清楚,良性和交界性PTs常见宽大的裂隙或舌状突起形成的典型叶状结构。就诊时乳腺PTs和乳腺富细胞型纤维腺瘤病例肿瘤平均大小分别为4.4、3.1 cm,二者比较,差异无统计学意义,具有可比性(P=0.066)。
1.2 方法
1.2.1 组织学乳腺PTs分级指标 2012年第四版WHO乳腺肿瘤病理诊断蓝皮书[7]提供了6个组织学指标[1]:肿瘤边界状况、间叶细胞的丰富程度、间叶细胞的异型性、间叶细胞的核分裂象、有无间质过度增生以及有无恶性异源性成分。
1.2.2 免疫组织化学 根据常规HE染色切片,所有病例均挑选有代表性的蜡块做免疫组化分析,并确保选取的组织中有正常乳腺组织作为内对照。各块石蜡包埋组织切取4 μM厚的免疫组化空白切片。切片经二甲苯脱蜡,梯度酒精水化,3%过氧化氢封闭内源性过氧化物酶10 min,高压修复2 min,加入一抗ER-α(SP1,1∶200)、PR(PgR636,1∶300)、CD34(QBEnd/10,1∶200)和P16(16P04/J02,1∶100), 均购自Dako公司,修复液EDTA-Tris缓冲液pH9.0,于4 ℃孵育过夜,EnVision二抗(Dako,工作液)37 ℃孵育30 min,DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。以 TBS 缓冲液代替一抗作为空白对照。判定染色的标准为:ER和PR阳性信号位于胞核,CD34阳性信号位于胞浆,P16阳性信号位于胞核或胞浆。上述抗体的阳性对照染色强度均记为2+;待测肿瘤细胞无信号记为0,弱于对照记为1+,等于记为2+, 强于记为3+;估算阳性区域的百分比:0和1+判为阴性,≥20% 2+或3+判为阳性。
1.3 统计学方法
采用SPSS 16.0统计软件进行Mann-Whitney U检验分析组间差异,用Cox比例风险回归模型进行单因素的RFS生存分析,无复发生存期(recurrence-free survival,RFS)定义为从术后诊断PTs到第1次复发的间隔时间。检验水准ɑ设定为0.05。
2 结果
2.1 免疫组化结果
免疫组化标记共138例,乳腺良性、交界性和恶性PTs病例分别为46、23和10例(图1A)。乳腺细胞型纤维腺瘤病例59例(图1B)。对10例恶性PTs的病例进行上皮和肌上皮标记结果:间质细胞的CK5/6、CK混、34βE12、Desmin及P63均为阴性,确定乳腺恶性PTs的诊断。
2.1.1 CD34 CD34阳性信号在乳腺PTs和富细胞型纤维腺瘤内均呈条带状分布(图2A~2D)。乳腺PTs组的CD34阳性率为57.0%,富细胞型纤维腺瘤为89.8%,U检验结果显示,二者差异有统计学意义(Z=18.246,P<0.001)。乳腺良性PTs和富细胞型纤维腺瘤比较,差异无统计学意义(Z=5.413,P=0.128)。而乳腺恶性PTs中阳性率为30%,多为弱到中阳性,阳性表达明显低于良性和交界性PTs,但在乳腺交界性和恶性PTs中CD34表达比较,差异无统计学意义(Z=6.470,P=0.045)(表1)。
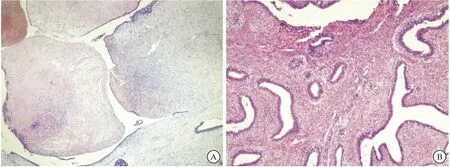
图1 乳腺PTs和富细胞型纤维腺瘤的组织学表达
注:A:良性PTs,细胞密度不一(40×); B:富细胞型纤维腺瘤,可见类似叶状结构(200×)

图2 CD34在乳腺PTs和富细胞型纤维腺瘤中的表达
注:A:良性PTs,间质细胞胞浆可见CD34阳性表达(100×);B:交界性PTs,上皮周围的间质细胞胞浆可见CD34阳性表达(100×);C:恶性PTs,间质细胞胞浆CD34未表达(200×);D:乳腺富细胞型纤维腺瘤,间质细胞胞浆CD34阳性表达(100×)

表1 CD34在乳腺PTs和富细胞型纤维腺瘤中的表达和分布情况比较[n(%)]
2.1.2 P16 P16主要表达于乳腺PTs上皮下间质肿瘤细胞阳性明显(图3A~3C)。乳腺PTs组P16阳性率为53.1%,多为中~强阳性表达;富细胞型纤维腺瘤组阳性率为23.7%,多为弱~中阳性(图2D)。U检验结果显示,乳腺PTs组和富细胞型纤维腺瘤组间比较,差异有统计学意义(Z=16.405,P=0.001);富细胞型纤维腺瘤和良性、交界性PTs间比较,差异有统计学意义(Z=13.934、11.500,P=0.003、0.005)(表2)。
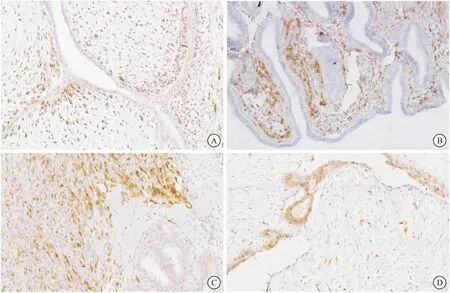
图3 P16在乳腺PTs和富细胞型纤维腺瘤中的表达
注:A:良性PTs,间质细胞可见细胞核P16阳性表达(200×); B:交界性PTs,上皮周围的间质细胞可见细胞核P16阳性表达(200×);C:恶性PTs,间质细胞可见细胞核P16阳性表达(200×);D:富细胞型纤维腺瘤,间质细胞可见个别P16阳性表达细胞(200×)

表2 P16在乳腺PTs和富细胞型纤维腺瘤中的表达和分布情况比较[n(%)]
2.1.3 ER-α,PR ER-α,PR上皮阳性常见,间质肿瘤细胞未见阳性。
2.2 随访和预后
通过电话或信件随访。乳腺PTs病例共79例, 70例获得随访结果,9例失访,回访率为88.6%;随访时间21~168个月,中位随访期为65个月。富细胞型纤维腺瘤病例共59例,随访51例,8例失访,回访率86.4%,随访时间24~72个月。
诊断为乳腺PTs后,患者的局部复发率为20.0%(14/70例),其中良性7/41例(17.1%),交界性4/19例(21.1%),恶性3/10例(30.0%),复发时间7~78个月,中位复发时间为24个月,65%病例术后3年内复发。不同分级的乳腺PTs复发率比较,差异无统计学意义(P>0.05)。乳腺富细胞型纤维腺瘤组复发率为9.8%(5/51例),与乳腺PTs组比较,差异有统计学意义(Z=6.534,P=0.011)。中位复发时间为47个月。
单因素生存分析结果显示,CD34与乳腺PTs病例的RFS有关(P<0.01)(图4)。P16未见有预后提示意义。

图4 CD34在乳腺PTs中的表达与患者预后(RFS)的关系
3 讨论
目前,乳腺PTs分级诊断是基于WHO推荐的6个组织学指标的综合评估。不同文献报道的乳腺PTs病例比例略有差异,良性、交界性和恶性PTs占比分别为60%~75%、13%~26%、10%~20%[7]。本组病例中,良性、交界性和恶性PTs占比分别为58.2%、29.1%和12.7%,与文献报道相仿[7]。乳腺富细胞型纤维腺瘤和PTs都是由上皮和间质组成的双相性肿瘤,其组织学起源于小叶内和导管周围间质。在进行乳腺PTs分级诊断时,对于细胞丰富而边界清楚的一类肿瘤究竟纳入乳腺PTs还是富于细胞性纤维腺瘤或幼年型纤维腺瘤,非常困难。因此,笔者从免疫组化的角度出发,试图找出有助于乳腺PTs和富细胞型纤维腺瘤鉴别诊断的辅助指标。
本研究数据显示,89.8%的乳腺富细胞型纤维腺瘤病例CD34阳性,乳腺PTs病例表达降低,恶性PTs阳性率仅为30.0%,明显低于良性和交界性(63.0%和56.5%)。Lee等[8]汇总了100例乳腺梭形细胞癌、纤维瘤病和PTs的间质梭形细胞CD34表达情况, CD34在乳腺正常小叶内间质表达,恶性PTs的间质肿瘤细胞表达明显降低(25.0%),良性和交界性为80.0%,梭型细胞癌和纤维瘤病间质不表达。另外对33例乳腺PTs研究发现,CD34在良性PTs中阳性率为85.7%(18/21),恶性PTs阳性率为16.7%(1/6),交界性PTs阳性率为100%。笔者认为CD34可作为鉴别乳腺PTs和富细胞型纤维腺瘤的指标,同时也是鉴别良、恶性PTs的有效辅助指标,但并不能鉴别良性和交界性PTs。CD34在乳腺纤维上皮性肿瘤中的高表达也提示其间质的梭形细胞可能起源于乳腺小叶内或导管周围间质。乳腺PTs中CD34的表达低于富细胞型纤维腺瘤,恶性PTs中CD34表达明显减少,可能与这种成纤维细胞样细胞的分化程度降低或有其他方向的转化有关。少量乳腺富细胞型纤维腺瘤病例P16阳性表达,在乳腺PTs间质的肿瘤细胞中P16阳性率为53.1%,高于富细胞型纤维腺瘤(23.7%),但良、恶性PTs并未见差异。乳腺PTs中P16表达上调的机制尚不清楚。
乳腺富细胞型纤维腺瘤的局部复发率为9.8%,乳腺PTs局部复发率为20.0%,良性、交界性和恶性PTs复发率分别为17.1%、21.1%、30.0%,与文献报道一致[9],65%的病例术后3年内复发。既往研究显示,肿瘤大小(>5 cm)、手术方式、切缘阳性[10]、间质过度增生[11]、核分裂像(≥15/10HPF)[12]、肿瘤细胞异型性[13]、肿瘤性坏死以及浸润性边界[14]等可能是与乳腺PTs复发转移相关的临床和组织学特点。CD34和预后的关系鲜有文献报道,本研究结果显示,CD34阴性的乳腺PTs病例更易发生局部复发,但其具体机制有待进一步研究。
[1]Tan P H, Ellis I O. Myoepithelial and epithelial-myoepithelial, mesenchymal and fibroepithelial breast lesions: updates from the WHO Classification of Tumours of the Breast 2012[J]. J Clin Pathol, 2013, 66(6): 465-470.
[2]Tse G M, Niu Y, Shi H J. Phyllodes tumor of the breast: an update[J]. Breast Cancer, 2010, 17(1): 29-34.
[3]Hodges K B, Abdul-Karim F W, Wang M,etal. Evidence for transformation of fibroadenoma of the breast to malignant phyllodes tumor[J]. Appl Immunohistochem Mol Morphol, 2009, 17(4): 345-350.
[4]Mishima C, Kagara N, Tanei T,etal. Mutational analysis of MED12 in fibroadenomas and phyllodes tumors of the breast by means of targeted next-generation sequencing[J]. Breast Cancer Res Treat, 2015, 152(2): 305-312.
[5]Ben Hassouna J, Damak T, Gamoudi A,etal. Phyllodes tumors of the breast: a case series of 106 patients[J]. Am J Surg, 2006, 192(2): 141-147.
[6]Chen W H, Cheng S P, Tzen C Y,etal. Surgical treatment of phyllodes tumors of the breast: retrospective review of 172 cases[J]. J Surg Oncol, 2005, 91(3): 185-194.
[7]Lakhani S R, Ellis I O, Schnitt S J,etal. Van de Vijver MJ eds. World Health Organization classification of tumours of the breast [M].Lyon:1ARC Press, 2012: 13-59.
[8]Lee A H. Recent developments in the histological diagnosis of spindle cell carcinoma, fibromatosis and phyllodes tumour of the breast[J]. Histopathology, 2008, 52(1): 45-57.
[9]Tan B Y, Acs G, Apple S K,etal. Phyllodes tumours of the breast: a consensus review[J]. Histopathology, 2016, 68(1): 5-21.
[10] Pimiento J M, Gadgil P V, Santillan A A,etal. Phyllodes tumors: race-related differences[J]. J Am Coll Surg, 2011, 213(4): 537-542.
[11] Foxcroft L M, Evans E B, Porter A J. Difficulties in the pre-operative diagnosis of phyllodes tumours of the breast: a study of 84 cases[J]. Breast, 2007, 16(1): 27-37.
[12] Tan P H, Thike A A, Tan W J,etal. Predicting clinical behaviour of breast phyllodes tumours: a nomogram based on histological criteria and surgical margins[J]. J Clin Pathol, 2012, 65(1): 69-76.
[13] Tay T K, Chang K T, Thike A A,etal. Paediatric fibroepithelial lesions revisited: pathological insights[J]. J Clin Pathol, 2015, 68(8): 633-641.
[14] Lawton T J, Acs G, Argani P,etal. Interobserver variability by pathologists in the distinction between cellular fibroadenomas and phyllodes tumors[J]. Int J Surg Pathol, 2014, 22(8): 695-698.
网络出版地址:http://www.cnki.net/kcms/detail/51.1705.R.20161027.1702.046.html
A Study on the Expression of ER, PR, CD34, P16 in Breast Phyllodes Tumors and their Correlation with Prognosis
JiaCui1,HanBangcai2,HeFei2,ZhangLushun1△.
1.DepartmentofPathology,ChengduMedicalCollege,Chengdu610500,China; 2.SchoolofClinicalMedicine,ChengduMedicalCollege,Chengdu610500,China
Objective To analyze the characteristics of protein expressions by the histological and immunohistochemical methods respectively and explore the indexes to evaluate the prognosis of breast phyllodes tumors (PTs). Methods The histological characteristics of 70 cases with breast PTs were reviewed retrospectively and compared with those of the other 59 cases with cellular fibroadenoma. The immunehistochemical staining was used to assess the expressions of ER, PR, CD34 and P16, and the follow-ups were conducted. Then the analyses were made statistically. Results According to the semi-quantitative index recommended by WHO, 58.2% of PTs in the 79 cases were benign tumors, 29.1% were borderline tumors, and 12.7% were malignant tumors. The results of the follow-ups showed that the recurrence rates of 70 cases with PTs and 59 cases with cellular fibroadenoma were 20.0% (14/70) and 9.8% (5/51) respectively, and their median time of recurrence was 24 months and 45 months respectively. There were no positive expressions of ER and PR in the PTs and the mesenchymal tumors of cellular fibroadenoma. The positive rates of CD34 in PTs and cellular fibroadenoma were 57.0% and 89.8% respectively, and those of P16 were 53.1% and 23.7% respectively. The statistical analysis showed that the differences were significant between the two groups (P<0.05). The prognostic analysis showed that the positive rate of CD34 was correlated significantly with the recurrence of breast PTs (P=0.001). Conclusion CD34 and P16 are helpful for the differential diagnosis of breast PTs and cellular fibroadenoma, and CD34 is a valuable index to evaluate the prognosis of PTs.
Breast tumor; Phyllodes tumor; Fibroadenoma; Prognosis
http://www.cnki.net/kcms/detail/51.1705.R.20161207.1048.006.html
10.3969/j.issn.1674-2257.2016.06.002
国家自然科学基金资助项目(No:81401161);成都医学院校基金项目((No:13Z094)
R737.9
A
△通信作者:张录顺,E-mail: 45194424@qq.com

