爬地柏枯梢病病原菌鉴定1)
陈洁 祝文博 苏越 郑妍婕 刘雪峰
(东北林业大学,哈尔滨,150000)
爬地柏枯梢病病原菌鉴定1)
陈洁 祝文博 苏越 郑妍婕 刘雪峰
(东北林业大学,哈尔滨,150000)
在黑龙江省内采集病植物标本,对爬地柏枯梢病病原菌进行形态学和分子生物学鉴定。根据形态学初步鉴定爬地柏枯梢病病原物为微色二孢属(Microdiplodiasp.)。通过对该病原菌rDNA进行PCR扩增和序列测定,得出该序列与GenBank中微色二孢属的同源性为99%。从爬地柏枯梢病症状、病原菌、病菌生物学特性和防治技术4个方面描述爬地柏枯梢病,为该病害的防治提供借鉴。
爬地柏;枯梢病;微色二孢属;症状
Journal of Northeast Forestry University,2016,44(12):68-70.
Sabinadavurica(Pall.) Ant. Shoot Blight Pathogen in Heilongjiang Province was identified asMicrodiplodiasp. based on morphological characteristics and ITS sequence analysis. By the rDNA PCR amplification and sequencing, the pathogen was 99% identity withMicrodiplodiasp. sequence from GenBank. We studied the symptoms of the disease, pathogens, biological characteristics of bacteria and control to introduceS.davuricaShoot Blight.
爬地柏(Sabinadavurica(Pall.) Ant.)又名兴安圆柏,为柏科圆柏属的一种,喜光,也比较耐荫,生于多石山地或山峰岩缝处,产于黑龙江大兴安岭海拔400~1 400 m地带,匍匐灌木,为常绿树种,其部分枝条斜立而显得姿态优美,比较有气势,而且具有寿命长、耐修剪、适应性强等特点,是园林绿化、水土保持及防沙治沙的优势品种。20世纪七八十年代黑龙江省防护林研究所引进了该树种,它生长良好,表现了极强的适应性,但长期以来未引起重视和开发利用。近几年由于生态建设、治沙及园林绿化的需要才逐渐引起关注,但在黑龙江省发现了一种新的病害,即爬地柏枯梢病,该病已经表现出现蔓延的趋势,有关其病原学的研究对病害虫防治有重要意义。
目前,关于爬地柏枯梢病病原以及防治技术的研究在国内还未见报道。爬地柏常见的病虫害,包括梨桧柏锈病、苹果锈病、茎叶腐烂型立枯病、小地老虎和蛴螬等[1]。有资料表明圆柏枯梢病(Diplodiapinea)在呼和浩特地区一些苗圃发生严重,发病率为82%,影响了圆柏的绿化效果,同时也给生产单位造成很大的经济损失[2]。
1 材料与方法
1.1 材料
2014年先后从黑龙江省中医药大学校园花坛采集50株,双鸭山市农垦红星隆管理局苗圃50株,齐齐哈尔市动植物园采集20株病叶、病枝标本,作为爬地柏枯梢病形态学分离和鉴定材料。
1.2 方法
1.2.1 症状观察
观察植株的危害部位及危害症状。取爬地柏枯梢病发病枝干,借助手持扩大镜或实体解剖镜观察病症特征,确认是否有病原菌的繁殖体或营养体。
1.2.2 病原菌分离培养
按发病部位分类(枝、叶)分别切取各部分3~5 mm,先用75%酒精消毒2~3 s,再用石灰水消毒1~2 min之后,用无菌水洗3~4遍。在超净工作台下,接种于PDA平板培养基,放入培养箱中25 ℃恒温培养。将不同的菌落分离纯化到平板上,放入培养箱中28 ℃培养。观察各种子实体的形态特征,了解植物上可能引起不同病害的病原。
采用单胞分离法对材料上的分生孢子器进行挑取单胞,放在PDA平板培养基上,培养箱中28 ℃培养。分离纯化后得到纯菌落,挑取菌丝于斜面培养基上培养获得病原菌纯菌落并保存。
1.2.3 致病性测定
按照柯赫氏法则,采用有伤和无伤接种方法对健康的爬地柏叶和梢接种,对其分离物进行致病性测定。
从阿城区玉泉龙达苗圃购买的健康爬地柏种苗。利用纯菌种配制孢子悬浮液(数量大致为100×镜视野下200个)。涂抹于针叶(50株)和梢(50株)上进行伤口(无菌针刺伤)和无伤口接种,并设对照实验组。接种后套袋用湿纱布保湿48 h,以套袋保湿不接种为对照。常温条件下观察发病症状变化及发病率。
1.2.4 病原菌再分离
从已经发病的植株上,分离培养病原菌,进行分离、纯化。徒手切片,用水作承载剂镜检病害标本的分生孢子器、分生孢子等形态特征、大小、颜色等,与最初的接种分离物进行比较。
1.2.5 病原菌形态鉴定
取新鲜发病叶片,在实体显微镜下切取分生孢子器,徒手切片,用水作承载剂制成简易玻片标本,然后在显微镜下观察病原菌的分生孢子器、分生孢子、分生孢子梗的形态,利用电子显微镜拍摄照片,并用工具测量其大小。
将病原菌接种于PDA上进行培养,观察其形态特征。
①生长速率:在28 ℃条件下察观各阶段生长形态变化。
②孢子形态:8 d左右在显微镜下观察其分生孢子器,产孢细胞,孢子大小,并照相记录其形态。
1.2.6 病原菌分子鉴定
用真菌的通用引物ITS1/ITS4对病原菌进行PCR扩增,对获得的扩增产物进行测序,将得到的序列进行对比,通过同源性分析对病原菌进行分子水平鉴定。
①DNA的提取:采用冷冻液氮研磨CTAB法提取病原菌DNA[3]。
②PCR扩增:使用的引物是核糖体ITS区段通用序列ITS1(5′-TCCGTAGGT-GAACCTGCGG-3′)和ITS4(5′-TCCGCTTATT-GATATGC-3′),进行20 μL体系扩增后,再做琼脂糖凝胶电泳检测。
③DNA测序:将PCR产物送入上海生工测序公司测序。
④测序与对比:将PCR测序获得的DNA序列与NCBI数据库进行序列对比分析,做病原菌的同源性分析,并与形态学鉴定相结合确定病原菌分类地位。
2 结果与分析
2.1 爬地柏枯梢病症状
爬地柏的叶、枝均受此病害的危害。针叶受害时,初期梢部针叶从叶尖向叶基逐渐变黄枯死,出现埋生的小黑点;后期枯死的针叶呈黄棕色,枯梢向下蔓延,直立不脱落。病叶上形成半埋生的表面光滑球状小黑点,枯死枯枝成灰褐色。枝干部受害时逐渐褪绿,由淡褐色变为褐色,最后变为灰褐色。病枝上形成半埋生的表面光滑球状小黑点,即病菌的分生孢子器。受害感病植株易产生倒伏现象(见图1)。

图1 爬地柏枯梢病病害症状
2.2 病原菌形态特征
暗处的条件下在PDA培养基上培养3~5 d后接种点长出白色绒毛状菌落,呈圆形,边缘整齐,长满培养皿。未见色素产生情况,未见分生孢子器。自然光培养5~8 d逐渐在白色菌落背面产生呈灰色同心圆的波纹,菌落背面波纹从中央依次向边缘加深,边缘颜色最深。8~10 d后逐渐变为黑色,菌落正面边缘长出的黑色表面光滑小点为病原菌的分生孢子器。
分生孢子器球形,单生,初埋生后外露,呈半埋生于表皮下,有孔口。分生孢子器外壁是暗色的,内壁是无色的。内壁上连接有无色的分生孢子梗,分生孢子梗形式为全壁芽生单生式。分生孢子初期无色单胞,中期淡色双胞,横隔逐渐变宽,颜色加深。成熟后为淡褐色双胞、椭圆形或卵形,横隔颜色深于孢子壁颜色。尺寸为(16.0~22.5)μm×(8.5~13.0)μm,平均19.35 μm×9.90 μm。标本号:MD.01。
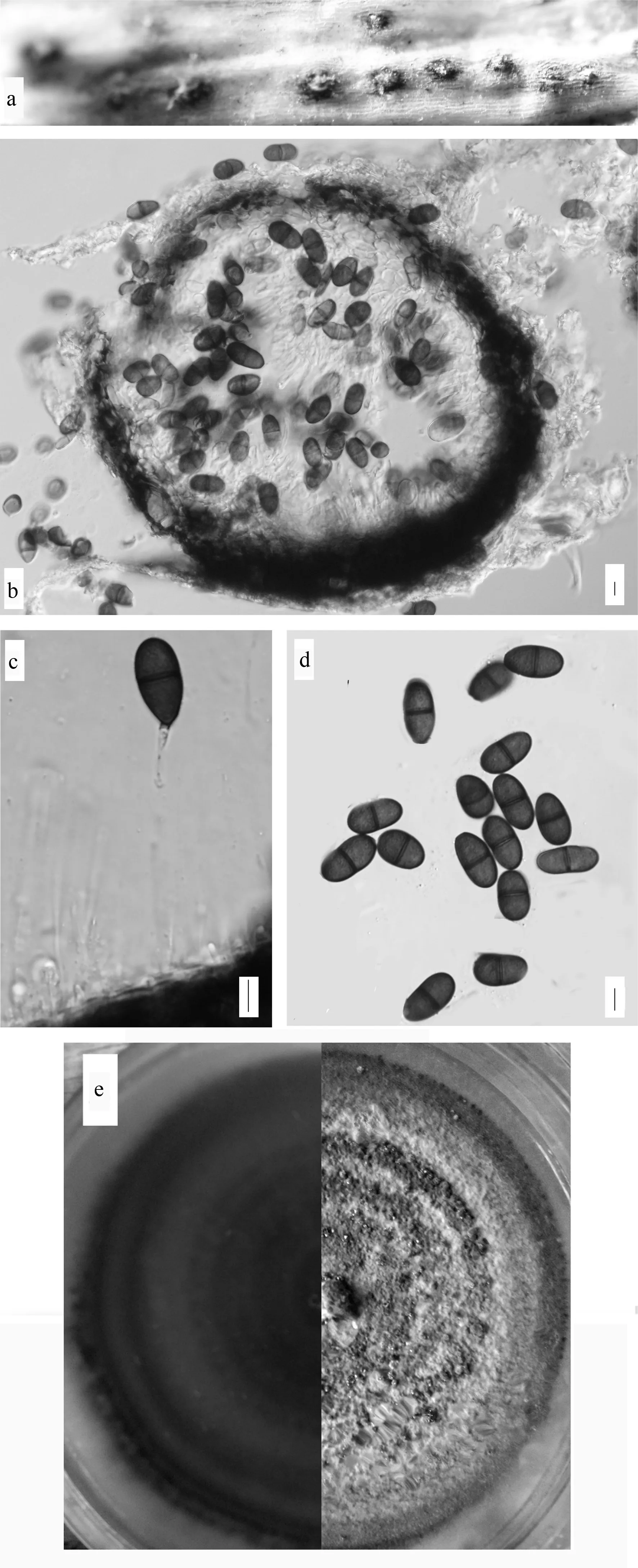
a.分生孢子器;b.分生孢子器横截面;c.分生孢子梗及产孢方式;d.分生孢子;e.菌落正反面宏观形态特征;标尺=10 μm。
图2 微色二孢(Microdiplodiasp.)
2.3 致病性测定结果
用从红星隆管理局苗圃采集到的病梢组织中分离得到菌株01接种健康植株。48 h后进行拆袋症状观察,接种7~10 d后,伤口接种的枝和叶有38株和40株有感病情况,无伤口接种枝叶共3株有感病情况,对照组均无感病情况。21 d左右感染了伤口接种组内接种部位及接种的整株植株,并可见黑色半埋生的分生孢子器。伤口接种病害发病率78%~80%。
2.4 病原物分子生物学测定
根据DNA测序结果与NCBI数据库数据对比,得出病原菌分类地位与Microdiplodiasp.(登记号:KF010841.1)的相似度为99%,病原菌分类地位与Diplodiapinea(登记号:JHUM01000052.1)的相似度为94%。同时该病原菌DNA测序结果已提交NCBI数据库(登记号:KX034227.1)。
3 结论与讨论
从哈尔滨市中医药大学、双鸭山市农垦红星隆管理局、齐齐哈尔市动植物园采集大量发病的病叶、病枝,经过对其分离、纯化,根据菌落生长速度、菌落形态、色素产生情况、孢子及分生孢子器的基本形态相似度和分子鉴定,得出该菌种序列与Microdiplodiasp.相似度为99%,而与Diplodiapinea相似度仅为94%,共同确定爬地柏枯梢病的病原为Microdiplodiasp.微色二孢属。
色二孢属与微色二孢属病症基本相同,都是变黄枯死,在发病部位产生半埋生的小黑点。成熟分生孢子均为淡褐色双胞,但分生孢子成熟过程稍有差别,色二孢属孢子成熟后产生横隔,微色二孢属孢子未成熟就产生横隔。
已有资料表示1969年10月在Gulab Gardens的荔枝上发现一种严重的叶部病害,叶部受害处从黄褐色至砖红色,出现黑色点状物体。在真菌学文献中,该属种已被描述并认为是不同的,考虑其宿主特异性的,被命名为Microdiplodialitchi.。2005年8月W. Gams & Y. Degawa,在Sophorachrysophylla上发现并命名为MicrodiplodiaAllesch.[4]。针对这微色二孢属国内外研究过少,需要我们进一步研究讨论。
[1] 兰丽萍.园林绿化树种圆柏的病虫害防治[J].中国园艺文摘,2013(4):97-98.
[2] 袁秀英,韩艳洁.圆柏枯梢病病原菌的研究[J].内蒙古林学院学报(自然科学版),1997,12(4):37-40.
[3] 庄彩云,李潞滨,胡陶,等.适用于rDNA的ITS分析的兰属菌根真菌培养及DNA提取方法[J].北京农学院学报,2007,22(3):4-6.
[4] CROUS P W. Groenewald Johannes Z.MicrodiplodiahawaiiensisCrous, sp. nov.[EB/OL]. Fungal Planet, 2006:7(2006-08-20)[2016-10-31].(http://www.fungalplanet.org/content/descriptions/descriptions_001.htm).
Identification ofSabinadavurica(Pall.) Ant. Shoot Blight Pathogens Human
Chen Jie, Zhu Wenbo, Su Yue, Zheng Yanjie, Liu Xuefeng
(Northeast Forestry University, Harbin 150040, P. R. China)
Sabinadavurica(Pall.) Ant.; Shoot blight;Microdiplodiasp.; Symptom
1)国家级大学生创新训练项目。
陈洁,女,1994年8月生,东北林业大学林学院,本科生。E-mail:1256985001@qq.com。
刘雪峰,东北林业大学林学院,研究员。E-mail:757489401@qq.com。
2016年3月16日。
S763.15
责任编辑:戴芳天。

