曲妥珠单抗对人表皮生长因子受体2阳性晚期胃癌患者的疗效观察
李新,孙光斌
(1天津市北辰医院,天津300400;2天津市第五中心医院)
曲妥珠单抗对人表皮生长因子受体2阳性晚期胃癌患者的疗效观察
李新1,孙光斌2
(1天津市北辰医院,天津300400;2天津市第五中心医院)
目的 观察曲妥珠单抗对人表皮生长因子受体2(HER2)阳性晚期胃癌患者的临床效果。方法 选取晚期胃癌患者90例,其中HER2阳性30例(观察组)、阴性60例(对照组)。观察组给予曲妥珠单抗+FOLFIRI方案治疗,对照组给予单纯FOLFIRI方案治疗,两组均治疗2个疗程。疗程结束2周时评价治疗效果,计算总有效率及疾病控制率;治疗前及疗程结束2周时分别采用KPS生活质量手册评价生存质量;统计治疗期间两组不良反应发生情况;治疗前及疗程结束后2周时检测血清末端脑钠肽原(NT-proBNP)、AST、ALT、尿素氮(BUN)、肌酐(Cr)。结果 观察组总有效率为60.0%、疾病控制率为83.3%,均高于对照组的40.0%、60.0%(P均<0.05)。观察组治疗后生活质量改善率为53.3%,高于对照组的40.0%(P<0.05)。治疗期间两组均出现食欲减退、恶心、腹胀、白细胞减少、血小板减少等不良反应,组间比较P均>0.05;两组治疗前后血清NT-proBNP、AST、ALT、BUN、Cr水平均无明显变化,组间比较P均>0.05。结论 曲妥珠单抗治疗HER2阳性晚期胃癌患者安全、有效。
胃癌;曲妥珠单抗;人表皮生长因子受体2
胃癌患者早期缺乏特异性临床症状,部分患者确诊时已处于中晚期,丧失手术治疗时机,化疗是中晚期胃癌的主要治疗方法[1,2]。人表皮生长因子受体2(HER2)通常只在胎儿时期表达,成年以后只在极少数组织中低水平表达。研究发现,30%以上的人类肿瘤组织存在HER2过度表达,如乳腺癌、卵巢癌、子宫内膜癌等[3,4],并参与肿瘤的发生、发展。曲妥珠单抗是针对HER2的生物靶向化疗药物,最早被应用于乳腺癌的生物靶向治疗,效果较好[5,6];但其对胃癌的靶向治疗效果报道较少。本研究观察曲妥珠单抗对晚期HER2阳性胃癌患者的临床效果。
1 资料与方法
1.1 临床资料 选取2013年6月~2015年6月天津市北辰医院收治的胃癌患者90例,均经组织病理检查确诊,临床分期均为Ⅲ期。其中男37例、女23例,年龄42~68(53.5±8.4)岁,体质量45~67(51±2.4)kg,肝转移22例、肺转移12例、腹腔淋巴结转移16例、全身多发转移10例。排除标准:①激素替代治疗超过1个月;②治疗依从性差;③合并糖尿病、高血压、心脏病、脑血管病、慢性肾脏病、慢性肝病;④KPS生活质量评分<60分。研究对象入院时均完善血常规、心电图、生化、心脏彩超等常规检查,均无化疗禁忌证。患者入院后均经胃镜取肿瘤组织,采用免疫组化SP法检测HER2,HER2阳性判定参照Hofmann标准[7]。其中HER2阳性30例(观察组),阴性60例(对照组),两组性别、年龄均具有可比性。
1.2 治疗方案 观察组给予曲妥珠单抗+FOLFIRI方案(伊立替康+5-氟尿嘧啶/亚叶酸钙)治疗,对照组仅给予FOLFIRI方案治疗。两组均予FOLFIRI方案化疗:伊立替康160 mg/m2,静滴2 h,第1天;亚叶酸钙200 mg/m2,静滴2 h,第1、2天;5-氟尿嘧啶先给予400 mg/m2静滴2 h,后续600 mg/m2持续微量泵泵入,第1、2天;每2周重复上述治疗1次,2次为1个疗程。在此基础上观察组应用曲妥珠单抗,首剂量为8 mg/kg,静滴90 min,第1周;此后每21天静滴6 mg/kg(维持量)。两组均治疗2个疗程。
1.3 相关指标观察 ①临床疗效:两组疗程结束2周时采用WHO规定的标准评价治疗效果。完全缓解(CR):病灶完全消失>1个月;部分缓解(PR):病灶缩小≥50%持续28天;稳定(SD):病灶缩小<50%或增大<25%,且无新的病灶出现,持续>28天;进展(PD):病灶增大≥25%或出现新的病灶。CR、PR均记为有效,计算总有效率;CR、PR、SD均记为疾病控制,计算疾病控制率。②生活质量:治疗前及疗程结束2周时分别采用KPS生活质量手册评价生存质量。改善:治疗后KPS评分较治疗前提高>10分;稳定:治疗后KPS评分较治疗前提高≤10分;下降:治疗后KPS评分较治疗前下降。③不良反应:观察治疗期间两组不良反应[消化道反应(恶心、呕吐、腹胀及食欲不振等),血液系统毒性反应(白细胞减少、中性粒细胞减少、血小板减少及贫血等)]发生情况。④安全性指标:治疗前及疗程结束后2周时分别抽取静脉血,提取血清,采用ELISA法检测血清末端脑钠肽原(NT-proBNP),全自动生化仪检测AST、ALT、尿素氮(BUN)、肌酐(Cr)。
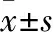
2 结果
2.1 两组疗效比较 观察组CR6例、PR12例、SD7例、PD5例,总有效率为60.0%,疾病控制率为83.3%;对照组CR6例、PR18例、SD12例、PD24例,总有效率为40.0%,疾病控制率为60.0%;两组总有效率、疾病控制率比较P均<0.05。
2.2 两组生活质量比较 观察组治疗后生活质量改善16例、稳定9例、下降7例,对照组分别为24、22、14例,观察组生活质量改善率高于对照组(53.3% vs 40.0%,P<0.05)。见表1。
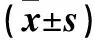
表1 两组治疗前后KPS评分比较
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。
2.3 两组不良反应比较 治疗期间两组均出现食欲减退、恶心腹胀、白细胞减少、血小板减少等不良反应,均给予常规对症治疗后缓解,两组不良反应发生情况比较P均>0.05。
2.4 两组安全性指标比较 两组治疗前后血清NT-proBNP、AST、ALT、BUN、Cr水平均无明显变化,组间比较P均>0.05。见表2。
3 讨论
HER2是表皮生长因子受体家族成员之一,由922个腺嘌呤、1 382个胞嘧啶、1 346个鸟嘌呤和880个胸腺嘧啶组成,人类该基因定位于染色体17q21,属于原癌基因。HER2具有酪氨酸蛋白激酶活性,可与其特异性受体结合调节细胞分裂、分化、增殖。研究发现,HER2过表达参与乳腺癌、食管癌等的发生、发展,作用机制主要为抑制细胞凋亡、促进细胞增殖,增加肿瘤细胞的侵袭力,促进肿瘤血管和淋巴管新生等[8,9]。HER2在胃癌组织表达增加,与患者预后相关,HER2阳性胃癌患者预后较HER2阴性患者差。曲妥珠单抗是一种从组DNA衍生的人源化单克隆抗体,属于IgG抗体,选择性作用于HER2阳性细胞的细胞外部分,抑制HER2活性,进而抑制HER2的促进肿瘤生长、发育的生物功能[10,11]。曲妥珠单抗作为生物靶向治疗药物最早应用于HER2阳性乳腺癌的治疗,临床缓解率可达50%[12,13]。但是,曲妥珠单抗治疗晚期胃癌的相关报道较少。
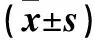
表2 两组治疗前后血清NT-proBNP、AST、ALT、BUN、Cr水平
本研究两组均为晚期(Ⅲ期)胃癌患者,观察组治疗总有效率和疾病控制率均明显高于对照组,提示曲妥珠单抗对HER2阳性晚期胃癌患者治疗效果好。晚期癌症患者生活质量明显下降,提高生活质量是主要治疗方向。KPS评分是临床常用的评价生活质量的方法[14]。本研究结果显示,观察组治疗后KPS评分明显高于对照组,生活质量改善患者的比例明显大于对照组,提示曲妥珠单抗可改善HER2阳性的晚期胃癌患者生活质量。化疗药物在治疗肿瘤的同时会导致明显的毒副作用,以消化道症状和血液系统毒性最为显著,如恶性、呕吐、腹胀及白细胞、粒细胞、血小板减少等[15]。本研究观察组、对照组在化疗过程中均出现上述不良反应,但患者均能耐受,且组间比较差异无统计学意义,提示曲妥珠单抗并未增加化疗药物的毒副作用。有临床研究报道,曲妥珠单抗有一定的心脏毒性,曲妥珠单抗使用过程中可能导致心力衰竭,约5%的患者可出现中重度心功能不全[16]。本研究两组均排除心功能衰竭及合并其他慢性脏器功能障碍者,并于治疗前后分别检测反映心功能的指标NT-proBNP,反映肝功能的指标ALT、AST,反映肾功能的指标Cr、BUN,结果显示两组治疗前后上述指标均无明显变化,组间比较差异均无统计学意义,提示曲妥珠单抗未增加心、肝、肾功能损伤。
综上所述,曲妥珠单抗治疗HER2阳性晚期胃癌患者安全、有效;但是,曲妥珠单抗价格昂贵,目前尚不能广泛应用于晚期胃癌患者;此外,曲妥珠单抗对晚期胃癌患者预后的影响及其不良反应有待进一步增加样本量、长期随访观察。
[1] 毛新彦,张克伟.腹腔镜、开腹胃癌根治术患者术后恢复情况及免疫功能比较[J].山东医药,2009,49(38):77-78.
[2] 王昆龄,陈凡,王晓莉,等.胃癌根治术后不同放疗的疗效及预后评价[J].中国老年学杂志,2015(1):57-59.
[3] 武鸿美,刘艳辉,林锋,等.中国胃癌患者HER2蛋白表达与临床病理学参数及预后的关系[J].中华病理学杂志,2011,40(5):296-299.
[4] 孙杰,潘赛英,陈倩琪,等.曲妥珠单抗联合FOLFIRI治疗HER2阳性晚期胃癌的疗效观察[J].南方医科大学学报,2011,31(8):1458-1460.
[5] 马磊,马雯,陈文晟,等.曲妥珠单抗联合多西他赛/S-1二线治疗进展期胃癌的初步研究[J].海南医学,2015(15):2209-2211.
[6] 赵恩昊.曲妥珠单抗治疗胃癌的作用及机制的研究进展[J].中国普通外科杂志,2011,20(8):873-876.
[7] Hofmann M, Stoss O, Shi D, et al. Assessmentofa HER2 scoring system forgastric cancer: results from avalidation study[J]. Histopathology, 2008,52(7):797-805.
[8] 王红兵,陈卫昌.胃癌患者外周血与胃癌组织中ERCC1基因甲基化的关系及其意义[J].中国癌症杂志,2013(11):900-903.
[9] 王竞,杨春春,李凤春,等.白介素6、白介素8与胃癌患者幽门螺杆菌关系研究[J].中国生化药物杂志,2015(5):143-145,149.
[10] 章娟,吴洪斌,翟青,等.曲妥珠单抗在Her-2高表达胃癌治疗中的研究近况[J].中国医院用药评价与分析,2010,10(5):390-393.
[11] 李明新,于忠和.Her-2与胃癌的分子靶向治疗[J].国际肿瘤学杂志,2011,38(9):687-690.
[12] 闫振宇,买春阳,高鹏,等.Her2在乳腺癌和胃癌中表达的临床意义[J].中国免疫学杂志,2016,32(6):858-862.
[13] 《乳腺癌HER2检测指南(2014版)》编写组.乳腺癌HER2检测指南(2014版)[J].中华病理学杂志,2014,43(4):262-267.
[14] 胡欣,文世民,李爽,等.卡培他滨维持化疗治疗晚期胃癌和术后复发转移胃癌效果观察[J].山东医药,2012,52(43):70-72.
[15] 雷素扬,郭领.胃癌患者术后生活质量调查及影响因素分析[J].中国实用护理杂志,2012,28(12):9-11.
[16] 杨菲,陈勇,张西志,等.超声心动图评价乳腺癌患者曲妥珠单抗靶向药物治疗后早期心脏毒性的价值[J].实用临床医药杂志,2016,20(11):99-101.
天津市高等学校科技发展计划项目(20140112)。
孙光斌(E-mail: zihong36@163.com)
10.3969/j.issn.1002-266X.2016.44.024
R735.2
B
1002-266X(2016)44-0067-03
2016-06-22)

