江西省9810例医疗器械不良事件数据统计分析
贾秀才,汤少梁
南京中医药大学 经贸管理学院,江苏 南京 210023
江西省9810例医疗器械不良事件数据统计分析
贾秀才,汤少梁
南京中医药大学 经贸管理学院,江苏 南京 210023
目的了解江西省医疗器械不良事件发生概况和特点,为进一步及时有效报告和制定防控措施提供参考。方法选取2014年1月~2015年6月江西省医疗器械不良事件数据进行描述性统计和分析。结果医疗器械不良事件报告主要来源于医疗器械经营企业和使用单位;涉及Ⅱ类和Ⅲ类医疗器械的不良事件是医疗器械不良事件的构成主体。结论健全不良事件监管法规,完善报告制度;加强生产企业专业培训,强化报告意识;改进监测报告系统功能,提高报告质量。
医疗器械不良事件;质量评估;统计分析;监测报告系统;风险预警
医疗器械不良事件是指获准上市的质量合格的医疗器械在正常使用情况下发生的、导致或可能导致人体伤害的各种有害事件[1]。医疗器械不良事件报告制度可以减少或避免同类不良事件的发生,降低患者、医务人员和其他人员的使用风险,保障广大群众的用械安全[2]。为进一步建立健全医疗器械不良事件报告制度,国家食品药品监督管理总局决定自2010年1月1日起,要求医疗器械生产、经营企业和使用单位统一使用医疗器械不良事件监测系统报告医疗器械不良事件,江西省也在此时启用了该系统,本文选取2014年1月1日~2015年6月30日江西省医疗器械不良事件数据进行描述性统计,旨在分析江西省医疗器械不良事件发生概况及特点,为进一步及时有效报告和制定防控对策提供参考。
1 资料与方法
1.1 资料来源
本文所涉及的数据来源于国家医疗器械不良事件监测系统和江西省食品药品监督管理局医疗器械不良事件监测工作简报。该系统较为全面地涵盖医疗器械不良事件的信息,既有事件基本信息:事件主要表现、事件发生日期、事件结果、事件陈述,事件涉及医疗器械情况(产品名称、商品名称、注册证号)、事件初步原因分析、事件初步处理情况、事件报告状态,也有不良事件评价情况(省级监测技术机构评价意见、国家监测技术机构评价意见),其统计分类也有较多方式,如按报告地区、报告来源、涉及的事件后果、医疗器械管理类别等方式进行快速统计归纳,功能强大,并均上传具体详尽的《医疗器械不良事件报告表》。
1.2 研究方法
将事件的相关信息转录入Excel表格,并进行分类、汇总、统计。通过实证辅以文献研究,分析事件发生概况及主要特点,以期为有效报告和制定防控对策提供参考[3-4]。
2 结果
2.1 基本情况
统计期内江西省累计上报事件9810例。按事件级别统计:一般事件7549例(76.95%)、严重事件2261例(23.05%);按区域统计排名前5的依次是上饶市、赣州市、宜春市、吉安市和南昌市。具体分布情况,见表1。
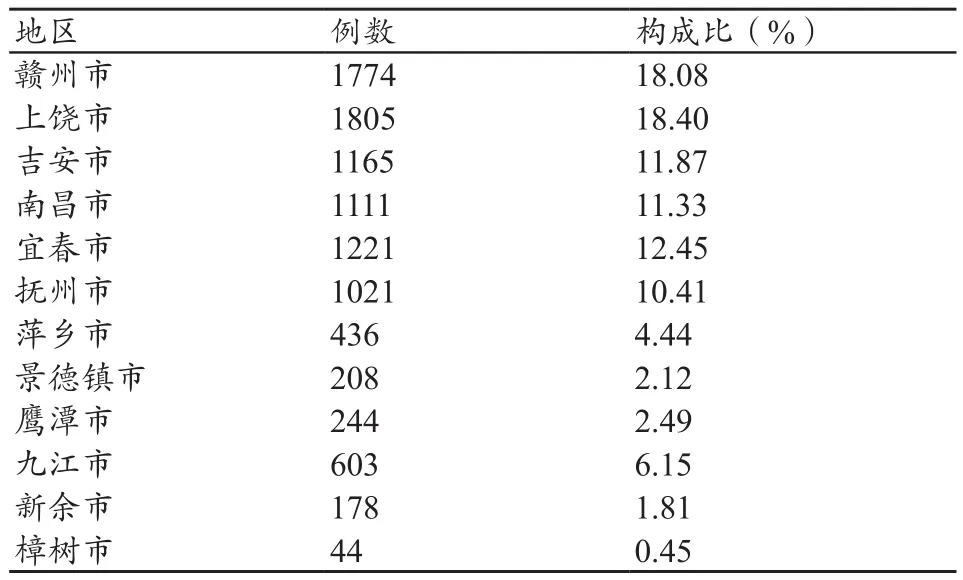
表1 上报事件地区分布情况
2.2 报告来源
按事件报告来源统计,使用单位上报7535例(76.81%);生产企业上报21例(0.21%);经营企业上报2252例(22.96%);此外还有个人上报2例(0.02%)。
2.3 医疗器械管理类别
按医疗器械管理类别统计,涉及Ⅲ类医疗器械的最多,有4143例(42.23%);涉及Ⅱ类医疗器械的有3106例(31.66%);涉及Ⅰ类医疗器械的最少,有2403例(24.50%);此外,涉及医疗器械管理类别不详的有158例(1.61%)。由此可见,涉及Ⅱ类、Ⅲ类医疗器械的不良事件7249例是事件的构成主体,这与医疗器械风险程度高低相吻合。
3 讨论
3.1 各地对报告制度的执行情况不一
通过对9810例医疗器械不良事件数据分析发现,江西省各地报告执行情况不同,报告工作发展不平衡。上饶市、赣州市和宜春市上报数超过1000例,报告完成率分别为30.25%、29.78%和28.31%;新余市和樟树市上报数没有超过200例,报告完成率仅为5.23%和2.54%。主要有以下3个方面原因:① 没有制订相应的机构建设制度,各市局医疗器械处负责多数医疗器械不良事件上报工作,由医疗器械处工作人员兼职,报告专业能力不能及时跟进,阻碍了报告工作的健康发展[5];② 医疗器械监管部门没有定期对报告工作开展情况、报告进度进行检查、调度和通报,部分医疗器械使用单位存在瞒报、漏报和迟报现象;③ 管理办法没有对医疗机构如何开展不良事件报告做出具体明确规定,导致报告主体对报告医疗器械不良事件存在侥幸心理,上报态度不积极。
3.2 报告数量和质量有待进一步提高
根据上文的统计,医疗器械生产企业上报数仅占0.21%。这表明,医疗器械生产企业对医疗器械不良事件报告工作认知度较低。从江西省食品药品监督管理局了解到,该省已经初步建成医疗器械不良事件报告体系,总体报告数量、涉及器械的种类、报告单位数量均在稳步上升,但是,部分报告在报告信息完整性、规范性、上报时效性方面尚有缺陷:医疗器械生产企业信息缺失;报告单位、报告人信息上报不准确;事件陈述过于简单以及对不良事件发生的原因分析不够深入等,极大地降低了报告价值,影响了进一步的分析评价[6]。
3.3 报告系统存在缺陷
《医疗器械不良事件报告制度规范》规定了需要上报的范围、报告程序和时限。但是由于目前系统只能对上报数据进行简单的数量统计,缺少分析、评价和预警功能[7]。现有报告系统仅能够通过检索实现简单的、单项目的数量方面的分析,不具备复杂、分类别分析功能,如可以对特定时段、特定地区、特定生产、经营企业、特定使用单位的不良事件情况进行检索,对于不同时段报告情况统计、涉及医疗器械不同管理类别的不良事件报告情况统计也不能实现。此外,缺少报告评价功能,如可以针对关联性评价、错误判断、重复判断、数据完整性检查、专家评价设置等做出补充材料要求、辅助评价信息和评价提醒。
4 建议
4.1 健全不良事件监管法规,完善报告制度
从数据统计结果来看,江西省353家医疗器械生产企业仅上报21例,说明大部分医疗器械生产企业对报告工作不够重视,均是“零报告”,这与其他省市医疗器械生产企业设立专人或部门收集并上报相差甚远。因此,必须严格按照新修订的《医疗器械监督管理条例》有关规定,建立健全医疗器械不良事件报告奖惩机制,加大对医疗器械企业的不报或隐瞒行为的处罚力度和对主动上报行为的激励措施。同时,落实好报告系统执行情况监督制度,各级卫生计生部门主动对医疗机构报告工作开展监督检查,督促各级医疗机构认真开展报告工作。
4.2 加强对生产企业的宣传培训,强化报告意识
各级医疗器械监管部门要主动作为,加大对医疗器械生产企业开展报告工作的宣传和培训力度,提高医疗器械生产企业上报积极性和自觉性。主动开展医疗器械监测报告知识的企业宣传活动,强化企业上报意识,引导企业报送新的、严重的、利用价值高的病例报告。继续采用联合发文、联合办会等多元化办法,形成食药监、卫计委、司法等多部门共同对医疗器械生产企业质量管理、注册人员业务培训的新模式,增强生产企业报告人员业务能力,使全省报告数量和质量不断提高。
4.3 改进监测报告系统功能,提高报告质量
进一步改进监测报告系统的功能,在原有报告系统中增加风险预警功能,有效挖掘风险预警信号,并及时对风险预警信息进行提取和分析评价,确保报告的准确性和及时性,提升全省风险信号提取和产品质量问题控制能力,为医疗器械安全监管工作提供可靠的信息依据[8]。增加质量评估管理功能,通过采用评估工具,对多次事件数据库进行筛选,对事件发生模式描述报告、事件发生频率测量报告、事件发生原因分析报告和事件发生趋势预测报告质量进行评估,确保其真实性和有效性,促进企业和监管部门科学、正确地分析不良事件的性质,并做出决策。
[1] 范雯怡,胥雪冬.可疑医疗器械不良事件上报管理的实践探索[J].中国医院管理,2013,33(12):53-54.
[2] 国家食品药品监督管理局.关于印发《医疗器械不良事件监测和再评价管理办法(试行)》的通知(国食药监械[2008]766号)[S].2008.
[3] 肖久庆,王良钢.植入类医疗器械医疗机构的法律责任探讨[J].中国医院管理,2015,35(5):60-62.
[4] 田月洁,李泮海,谢彦军,等.医疗不良事件报告质量控制的实践与探索[J].中国药物警戒,2011,8(11):651-653.
[5] 汪娴.江苏省医疗器械不良事件监测现状分析[D].苏州:苏州大学,2012.
[6] 陈宏军.我院医疗器械不良事件检测认知度调查分析[J].中国医疗设备,2015,30(10):167-169.
[7] 夏益,田侃.江苏省2589例医疗质量安全事件数据统计分析—兼评医疗质量安全事件报告制度[J].中国医院管理,2015, 35(8):29-31.
[8] 蔡爱萍.浅谈医院医疗器械不良事件监测现状和监测体系的有效建立[J].医疗装备,2011,23(11):48-50.
Statistic Analysis of 9810 Cases of Medical Device Adverse Events in Jiangxi Province
JIA Xiu-cai, TANG Shao-liang
School of Economics and Management, Nanjing University of Сhinese Medicine, Nanjing Jiangsu 210023, Сhina
ObjectiveTo study the general situation and characteristics of medical device adverse events in Jiangxi province to provide references for timely and effective reporting and further development of prevention and control measures.MethodsIn empirical study, the data of medical device adverse events in Jiangxi province from January 2014 to June 2015 were analyzed.ResultsEnterprises and medical devices unit were the main source of medical device adverse event reporting; СlassⅡand СlassⅢ medical devices adverse events related to medical equipment management category constituted the main body of the medical device adverse events.ConclusionIt is important to improve adverse events regulatory system and reporting system; it is also essential to strengthen professional training in enterprises and the active reporting consciousness; it is necessary to improve the monitoring function of the reporting system and to enhance the quality of reporting.
medical device adverse events; quality assessment; statistic analysis; monitoring report system; risk precaution
R197.3
С
10.3969/j.issn.1674-1633.2016.05.044
1674-1633(2016)05-0146-03
2015-10-08
2015-11-28
汤少梁,教授,博士生导师。
通讯作者邮箱:tangshaoliang@126.com

