阿替普酶联合丁苯酞治疗急性缺血性脑卒中的临床观察
赵 晶,赵 辉,孔文基,张艳国(.齐齐哈尔医学院附属第三医院药剂科,黑龙江齐齐哈尔 60;.齐齐哈尔医学院附属第三医院营养科,黑龙江齐齐哈尔 60;3.齐齐哈尔医学院附属第三医院神经外科,黑龙江齐齐哈尔 60)
阿替普酶联合丁苯酞治疗急性缺血性脑卒中的临床观察
赵 晶1*,赵 辉1,孔文基2,张艳国3#(1.齐齐哈尔医学院附属第三医院药剂科,黑龙江齐齐哈尔 161021;2.齐齐哈尔医学院附属第三医院营养科,黑龙江齐齐哈尔 161021;3.齐齐哈尔医学院附属第三医院神经外科,黑龙江齐齐哈尔 161021)
目的:探讨阿替普酶联合丁苯酞治疗急性缺血性脑卒中的临床疗效及安全性。方法:选取我院收治的急性缺血性脑卒中患者98例,按照随机数字表法分为观察组和对照组,各49例。对照组患者在控制血糖、血压等常规治疗基础上给予丁苯酞氯化钠注射液100 ml,ivgtt,bid;观察组患者在对照组基础上给予注射用阿替普酶5 mg加入0.9%氯化钠注射液(NS)10 ml中,iv+注射用阿替普酶45 mg加入NS 100 ml中,ivgtt,qd。两组患者治疗时间均为2周。观察两组患者临床疗效及治疗前后脑梗死面积、美国国立卫生研究院卒中量表(NIHSS)评分、生活能力评分、白细胞介素(IL)-6、IL-8、IL-10、C反应蛋白(CRP)、24 h尿蛋白定量、血肌酐(Scr)和肌酐清除率水平,并记录不良反应发生情况。结果:观察组患者1例、对照组患者2例因重度出血而退出本研究。观察组患者治疗总有效率(95.83%)明显高于对照组(80.85%),差异有统计学意义(P<0.05)。治疗前,两组患者上述指标比较,差异均无统计学意义(P>0.05)。治疗后,观察组患者脑梗死面积、NIHSS评分明显缩小或降低,生活能力评分明显升高,且观察组改善程度均明显优于对照组,差异均有统计学意义(P<0.05);观察组患者24 h尿蛋白定量、Scr均明显低于对照组,差异均有统计学意义(P<0.05);观察组患者治疗1周后IL-6水平及治疗2周后IL-6、IL-8、IL-10和CRP水平明显低于对照组,差异均有统计学意义(P<0.05)。两组患者的总不良反应发生率比较,差异无统计学意义(P>0.05)。结论:阿替普酶联合丁苯酞治疗急性缺血性脑卒中疗效显著,能有效降低患者的血清炎症因子水平,控制脑组织缺血和梗死面积,改善患者神经功能,并保护其肾功能。
阿替普酶;丁苯酞;急性缺血性脑卒中;血清炎症因子;肾功能
随着我国社会老龄化进程的加快,人们生活水平的提高,由生活、饮食因素导致的心脑血管疾病发病率逐年递增,已成为威胁中老年人群健康的一类主要疾病。缺血性脑卒中是一种常见的心脑血管疾病,是患者脑组织局部血液供应障碍导致的缺血缺氧性脑组织坏死和软化[1],发病时机体可产生一系列复杂的病理反应,其中血清炎症因子的释放和血流动力学指标的改变是早期最直接的病理改变[2]。卒中后,患者血清炎症因子水平的改变可导致脑动脉、全身血管内皮功能的进一步损伤,肾功能的降低可导致机体代谢异常,加重急性缺血性脑卒中的临床治疗难度[3]。急性缺血性脑卒中的治疗时间窗短暂,有效的临床治疗方法为及时恢复闭塞血管的再通。本研究探讨了阿替普酶联合丁苯酞对急性缺血性脑卒中患者血清炎症因子和肾功能等指标的影响及安全性,现报道如下。
1 资料与方法
1.1 纳入、排除与脱落标准
纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2014》中的诊断标准[4]者;(2)经影像学、实验室检查确诊为急性缺血性脑卒中;(3)美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分≥3分。
排除标准:(1)出血性脑卒中患者;(2)合并恶性肿瘤者;(3)陈旧性脑梗死患者;(4)原发性心、肝、肾功能不全者;(5)妊娠期或哺乳期女性;(6)对本研究药物过敏者。
脱落标准:治疗期间出现严重的不良反应而退出本研究者。
1.2 研究对象
选取我院2014年1月-2015年6月收治的急性缺血性脑卒中患者98例,按照随机数字表法分为观察组和对照组,各49例。两组患者一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1(1 mm Hg=0.133 kPa)。本研究方案经医院医学伦理委员会审核通过,患者均知情同意并签署知情同意书。
表1 两组患者临床资料比较(±s)Tab 1 Comparison of clinical information of patients between 2 groups(±s)
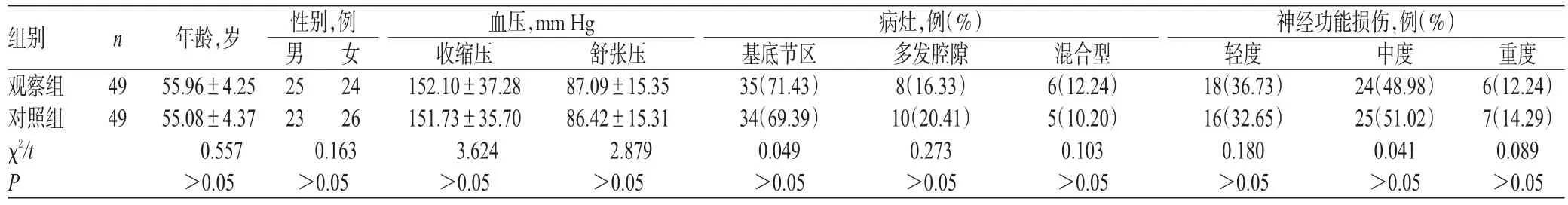
表1 两组患者临床资料比较(±s)Tab 1 Comparison of clinical information of patients between 2 groups(±s)
组别观察组对照组χ2/t P n 49 49年龄,岁55.96±4.25 55.08±4.37 0.557>0.05病灶,例(%)性别,例男25 23 0.163>0.05女24 26血压,mm Hg收缩压152.10±37.28 151.73±35.70 3.624>0.05舒张压87.09±15.35 86.42±15.31 2.879>0.05基底节区35(71.43)34(69.39)0.049>0.05多发腔隙8(16.33)10(20.41)0.273>0.05混合型6(12.24)5(10.20)0.103>0.05神经功能损伤,例(%)轻度18(36.73)16(32.65)0.180>0.05中度24(48.98)25(51.02)0.041>0.05重度6(12.24)7(14.29)0.089>0.05
1.3 治疗方法
两组患者均接受控制血压、血糖、血脂,降低颅内压和抑制血小板聚集等常规治疗。对照组患者在常规治疗基础上给予丁苯酞氯化钠注射液(石药集团恩比普药业有限公司,批准文号:国药准字H20100041,规格:每100 ml含丁苯酞25 mg与氯化钠0.9 g)100 ml,ivgtt(滴注时间约60 min),bid(两次滴注间隔>6 h);观察组患者在对照组基础上给予注射用阿替普酶(德国Boehringer Ingelheim Pharma GmbH&Co.kG,注册证号S20110052,规格:50 mg/支)5 mg加入0.9%氯化钠注射液(NS)10 ml中,iv(推注时间<10 s)+注射用阿替普酶45 mg加入NS 100 ml中,ivgtt(滴注时间<60 min),qd(与丁苯酞氯化钠给药时间间隔>6 h)。两组患者治疗时间均为2周。
1.4 疗效判定标准与观察指标
(1)临床疗效评价标准[4]——显效:NIHSS评分降低>90%,无病残;有效:NIHSS评分降低50%~90%,病残程度<3级;无效:NIHSS评分降低<50%或上升,病残程度≥3级。总有效=显效+有效。(2)采用CT平扫观察两组患者脑梗死面积。(3)采用NIHSS评分评估两组患者神经功能损伤程度。(4)采用Barthel指数评估量表评估患者日常生活能力。(5)晨起空腹抽取两组患者外周静脉血,采用酶联免疫吸附法检测患者血清炎症因子白细胞介素(IL)-6、IL-8、IL-10和C反应蛋白(CRP)水平。(6)观察患者24 h尿蛋白定量、血肌酐(Scr)和肌酐清除率水平。(7)记录相关不良反应发生情况。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料以率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 脱落情况
观察组患者1例、对照组患者2例因重度出血而退出本研究,最终纳入统计的病例数为观察组48例、对照组47例。
2.2 两组患者临床疗效比较
观察组患者治疗总有效率(95.83%)明显高于对照组(80.85%),差异有统计学意义(P<0.05),详见表2。

表2 两组患者临床疗效比较[例(%%)]Tab 2 Comparison of clinical efficacies between 2 groups [case(%%)]
2.3 两组患者治疗前后脑梗死面积、NIHSS评分和生活能力评分比较
治疗前,两组患者脑梗死面积、NIHSS评分和生活能力评分比较,差异均无统计学意义(P>0.05)。治疗后,两组患者脑梗死面积和NIHSS评分较治疗前明显缩小或降低,观察组患者生活能力评分较治疗前明显升高,且观察组改善程度均明显优于同期对照组,差异有统计学意义(P<0.05),详见表3。
2.4 两组患者治疗前后血清炎症因子水平比较
治疗前,两组患者IL-6、IL-8、IL-10和CRP水平比较,差异无统计学意义(P>0.05)。治疗后,两组患者上述指标均明显降低,且观察组患者治疗1周后IL-6水平及治疗2周后的IL-6、IL-8、IL-10和CRP水平明显低于对照组,差异均有统计学意义(P<0.05),详见表4。
2.5 两组患者治疗前后肾功能指标水平比较
治疗前,两组患者的24 h尿蛋白定量、Scr和肌酐清除率水平比较,差异均无统计学意义(P>0.05)。治疗后,对照组患者的24 h尿蛋白定量逐渐升高,观察组患者逐渐降低,且组间比较差异有统计学意义(P<0.05);两组患者Scr水平均逐渐降低,且观察组明显低于对照组,差异有统计学意义(P<0.05);两组患者的肌酐清除率变化比较,差异无统计学意义(P>0.05),详见表5。
2.6 不良反应
两组患者治疗期间的轻度出血和中度出血患者在维持本研究治疗方案的同时,给予相应的止血处理后均得到控制。两组患者的总不良反应发生率比较,差异无统计学意义(P> 0.05),详见表6。
表3 两组患者治疗前后脑梗死面积、NIHSS评分和生活能力评分比较(±s)Tab 3 Comparison of cerebral infarction area,NIHSS score and ability score of daily living between 2 groups before and after treatment(±s)

表3 两组患者治疗前后脑梗死面积、NIHSS评分和生活能力评分比较(±s)Tab 3 Comparison of cerebral infarction area,NIHSS score and ability score of daily living between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组观察组脑梗死面积,cm2NIHSS评分,分n生活能力评分,分治疗后2周62.29±11.38 73.86±15.70*#47 48治疗前16.41±2.66 16.52±2.81治疗1周后14.60±1.52*13.18±1.64*#治疗2周后13.05±1.14*11.12±1.97*#治疗前7.44±2.52 7.35±2.76治疗后1周6.65±2.38*6.09±2.32*#治疗后2周5.41±1.95*4.08±1.14*#治疗前58.21±14.13 56.20±12.28治疗后1周58.63±9.25 63.34±13.85*#
表4 两组患者治疗前后血清炎症因子水平比较(±s)Tab 4 Comparison of serum inflammation factors levels between 2 groups before and after treatment(±s)

表4 两组患者治疗前后血清炎症因子水平比较(±s)Tab 4 Comparison of serum inflammation factors levels between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组观察组n IL-6,ng/L IL-8,ng/L IL-10,ng/L CRP,mg/L 47 48治疗前58.96±1.32 59.11±1.58治疗1周后33.92±2.13*21.53±1.08*#治疗2周后27.19±1.98*12.05±1.20*#治疗前43.25±2.35 43.97±2.69治疗1周后35.10±1.55*33.17±1.49*治疗2周后30.84±1.54*24.98±1.10*#治疗前13.98±1.25 13.99±1.35治疗1周后12.09±1.09*11.08±1.13*治疗2周后10.97±0.85*9.34±0.98*#治疗前23.84±1.95 23.01±1.29治疗1周后17.33±1.29*16.05±1.33*治疗2周后13.84±1.38*7.41±1.06*#
表5 两组患者治疗前后肾功能指标水平比较(±s)Tab 5 Comparison of renal function indexes between 2 groups before and after treatment(±s)
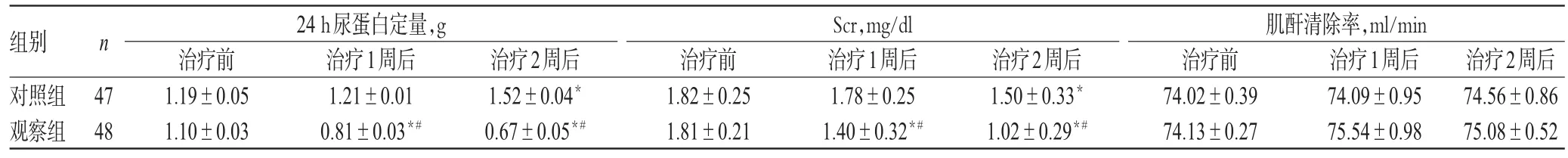
表5 两组患者治疗前后肾功能指标水平比较(±s)Tab 5 Comparison of renal function indexes between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组观察组24 h尿蛋白定量,g Scr,mg/dl n治疗2周后74.56±0.86 75.08±0.52 47 48治疗前1.19±0.05 1.10±0.03治疗1周后1.21±0.01 0.81±0.03*#治疗2周后1.52±0.04*0.67±0.05*#治疗前1.82±0.25 1.81±0.21治疗1周后1.78±0.25 1.40±0.32*#治疗2周后1.50±0.33*1.02±0.29*#肌酐清除率,ml/min治疗前74.02±0.39 74.13±0.27治疗1周后74.09±0.95 75.54±0.98
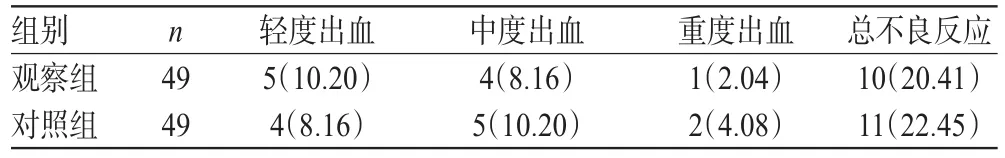
表6 两组患者不良反应发生率比较[例(%%)]Tab 6 Comparison of the incidence of ADR between 2 groups[case(%%)]
3 讨论
急性缺血性脑卒中是临床常见的脑血管疾病,患者预后较差,病死率、致残率均较高。病理生理学研究显示,神经功能损伤以及卒中的并发症是导致患者死亡、残疾等不良临床结局的主要原因,其中血清炎症因子对患者脑组织的继发性损伤以及血管内皮功能的破坏是导致急性缺血性脑卒中病情进展、恶化的主要原因之一[5],而血清炎症因子对患者机体的损伤表现在全身各器官和系统中,且对肾功能的影响最大。由于患者脑组织、神经功能损伤后可导致循环系统、体液免疫和中枢神经系统等发生不同变化,血流动力学指数和凝血机制等异常,血液中Scr水平升高,可导致患者肾功能发生不同程度的损伤,若不及时治疗则可导致肾功能衰竭的发生[6]。因此,缺血性脑卒中的临床治疗不应只考虑对患者脑组织、神经功能的保护与修复,还更应注重对全身多器官的保护和并发症的预防。
本研究结果显示,观察组患者治疗总有效率明显高于对照组,且其脑梗死面积、NIHSS评分和生活能力评分的改善程度均明显优于对照组,观察组患者治疗后2周的IL-6、IL-8、IL-10、CRP、24 h尿蛋白定量和Scr水平的改善程度均明显优于对照组,差异均有统计学意义(P<0.05)。可见,丁苯酞氯化钠注射液具有明显改善血清炎症因子水平的作用,可加快局部血流微循环速度,扩张血管直径[7],同时具有改善患者能量代谢、增强抗氧化应激等多方面的作用[8]。Govindarajan P等[9]的研究显示,丁苯酞氯化钠注射液具有显著的神经元保护作用以及神经功能修复作用,且其临床应用可不受患者溶栓治疗时间窗的影响与限制,在治疗早期急性缺血性脑卒中时具有明显优势[9]。
阿替普酶是一种新型的溶栓药物,其在激活纤溶酶原的特异性、药物半衰期以及溶栓效果等方面具有优势。临床研究表明,急性缺血性脑卒中后患者机体释放大量的炎症因子,可直接导致脑组织、神经功能的继发性损伤[7-9],进而加剧了脑组织局部的供血障碍,同时对患者肾小球滤过功能具有严重影响,导致患者肾功能受损,进而导致机体代谢功能障碍,加重神经功能损伤,形成恶性循环[2]。阿替普酶可有效改善患者血液黏度和凝固特性,抑制血小板聚集,可通过减少侧支循环阻力达到改善局部微循环的作用,对患者缺血损伤的脑组织半暗带细胞功能具有明显的促进修复作用。但阿替普酶对血管的扩张作用效果较差,通过联用丁苯酞可弥补血管扩张效果不佳这一缺点;而丁苯酞对神经元的保护作用较阿替普酶差,因而单纯应用丁苯酞对患者神经功能修复作用有限。二者联用可在促进脑组织梗死面积缩小的同时,进一步抑制氧自由基释放,减轻脑血管损伤,明显改善患者炎症因子表达,促进神经功能恢复,避免患者肾功能损伤,对其生活自理能力的提高与预后质量的改善均具有显著作用。
综上所述,阿替普酶联合丁苯酞治疗急性缺血性脑卒中疗效显著,能有效降低患者的血清炎症因子水平,控制脑组织缺血和梗死面积,改善患者神经功能,并保护其肾功能。但本研究样本量较小,需进一步进行大样本的临床研究加以证实。
[1] Kim SO,Han SY,Beak YH,et al.Splenic infarction associated with sorafenib use in a hepatocellular carcinoma patient[J].World J Gastroentero,2011,17(2):267.
[2] 常红,许亚红,陈琳.缺血性脑卒中患者阿替普酶静脉溶栓出血并发症的研究进展[J].中华护理杂志,2015,50(4):459.
[3] 牛慧艳,张占强,王海,等.丁苯酞氯化钠注射液联合尿激酶治疗急性缺血性卒中疗效观察[J].中国现代神经疾病杂志,2014,14(9):820.
[4] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南:2014[J].中华神经科杂志,2015,48(4):246.
[5] 周鹏.阿替普酶溶栓后抗凝治疗对急性脑梗死患者的疗效及安全性研究[J].中国现代医生,2011,49(31):42.
[6] Gooneratne IK,Gamage R,Gunarathne KS.Internal carotid artery dissection:an unusual cause of occipital infarction[J].Ann Indian Aiad Neurol,2010,13(2):148.
[7] Minnerup J,Sutherland BA,Buchan AM,et al.Neuroprotection for stroke:current status and future perspectives [J].Int J Mol Sci,2012,13(9):11 753.
[8] 梁华峰,王宏,张云霞,等.阿替普酶治疗急性脑梗死的临床疗效及安全性[J].当代医学,2011,17(16):144.
[9] Govindarajan P,Ghilarducci D,McCulloch C,et al.Comparative evaluation of stroke triage algorithms for emergency medical dispatchers(MeDS):prospective cohort study protocol[J].BMC Neurol,2011,doi:10.1186/1471-2377-11-14.
(编辑:陶婷婷)
Clinical Observation of Alteplase Combined with Butylphthalide in the Treatment ofAcute Ischemic Stroke
ZHAO Jing1,ZHAO Hui1,KONG Wenji2,ZHANG Yanguo3(1.Dept.of Pharmacy,Third Affiliated Hospital of Qiqihar Medical University,Heilongjiang Qiqihar 161021,China;2.Dept.of Nutrition,Third Affiliated Hospital of Qiqihar Medical University,Heilongjiang Qiqihar 161021,China;3.Dept.of Neurosurgery,Third Affiliated Hospital of Qiqihar Medical University,Heilongjiang Qiqihar 161021,China)
OBJECTIVE:To discuss clinical efficacy and safety of alteplase combined with butylphthalide to the patients with acute ischemic stroke.METHODS:98 patients with acute ischemic stroke in our hospital were selected and divided into observation group and control group according to random number table,with 49 patients in each group.Control group was additionally given Butylphthalide and sodium chloride injection 100 ml,ivgtt,bid,on the basis of routine treatment as controlling blood glucose,blood pressure,etc.;observation group additionally received Alteplase for injection 5 mg added into NS 10 ml,iv+Alteplase for injection 45 mg added into NS 100 ml,ivgtt,qd,on the basis of control group.Both groups were treated for 2 weeks.Clinical efficacies of 2 groups were compared as well as cerebral infarction area,NIHSS score,ability score of daily living,the levels of IL-6,IL-8,IL-10,CRP,24 h urine protein,Scr and creatinine clearance rate before and after treatment.The occurrence of ADR was also recorded.RESULTS:1 patient of observation group and 2 patients of control group withdrew from the study due to severe hemorrhage.Total effective rate of observation group(95.83%)was significantly higher than that of control group(80.85%),with statistical significance(P<0.05).Before treatment,there was no statistical significance in above indexes between 2 groups(P>0.05).The cerebral infarction area and NIHSS score were reduced significantly in observation group after treatment,ability score of daily living were increased significantly in observation group after treatment,and the improvement of observation group was significantly better than control group,with statistical significance(P<0.05).24 h urine protein and Scr of observation group was significantly lower than those of control group,with statistical significance(P<0.05). the level of IL-6 in observation group 1 week after treatment and the levels of IL-6,IL-8,IL-10 and CRP 2 weeks after treatment were significantly lower than in control group,with statistical significance(P<0.05).There was no statistical significance in the incidence of ADR between 2 groups(P>0.05).CONCLUSIONS:Alteplase combined with butylphthalide show significant therapeutic efficacy,can effectively reduce the level of serum inflammatory factors,control brain tissue ischemia and cerebral infarction area,and improve neurologic function and protect renal function in patients with acute ischemic stroke.
Alteplase;Butylphthalide;Acute ischemic stroke;Serum inflammatory factors;Renal function
R743.3
A
1001-0408(2016)35-4962-04
2016-01-13
2016-10-24)
*主管药师。研究方向:缺血性脑卒中血清因子的药物研究及分析。电话:0452-2697272。E-mail:zhaojing8208@126.com
#通信作者:副主任医师。研究方向:缺血性脑卒中的药物治疗与治疗时间窗选择。电话:0452-2697350。E-mail:yangguo203@sohu. com
DOI10.6039/j.issn.1001-0408.2016.35.21

