银杏二萜内酯对缺血/再灌注大鼠脑组织中神经递质的影响
张 雯,宋俊科,何国荣,张 雪,周启蒙,王振中,萧 伟,肖智勇,周文霞,杜冠华
(1.中国医学科学院北京协和医学院药物研究所,北京市药物靶点研究与新药筛选重点实验室,北京 100050;2.中药制药过程新技术国家重点实验室,江苏康缘药业股份有限公司,江苏 连云港 222001;3.军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
◇论 著◇
银杏二萜内酯对缺血/再灌注大鼠脑组织中神经递质的影响
张 雯1,宋俊科1,何国荣1,张 雪1,周启蒙1,王振中2,萧 伟2,肖智勇3,周文霞3,杜冠华1
(1.中国医学科学院北京协和医学院药物研究所,北京市药物靶点研究与新药筛选重点实验室,北京 100050;2.中药制药过程新技术国家重点实验室,江苏康缘药业股份有限公司,江苏 连云港 222001;3.军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
目的 探讨银杏二萜内酯葡胺注射液对缺血/再灌注大鼠脑内氨基酸类和单胺类神经递质的影响。方法 采用线栓法制备大鼠脑缺血/再灌注模型,缺血1.5 h,再灌注24 h,尾静脉给予不同剂量银杏二萜内酯葡胺注射液后,用高效液相色谱串联电化学检测器(HPLC-ECD)测定脑内氨基酸类和单胺类神经递质含量。结果 银杏二萜内酯葡胺注射液可以抑制缺血/再灌注导致的脑内天冬氨酸、谷氨酸、甘氨酸和γ-氨基丁酸的升高;降低缺血脑区皮层和海马内去甲肾上腺素、二羟苯乙酸、5-羟色胺、5-羟吲哚乙酸的浓度,抑制皮层内肾上腺素的减少。结论 银杏二萜内酯葡胺注射液可以通过调节脑内氨基酸类和单胺类神经递质的水平,对大鼠脑缺血/再灌注引起的损伤发挥治疗作用。
银杏二萜内酯葡胺注射液;脑缺血/再灌注;氨基酸类递质;单胺类递质;HPLC-ECD;代谢组学
脑血管疾病是我国中老年人死亡的头号杀手,在脑血管疾病中,急性缺血性疾病的发病率居于首位,严重威胁着人类健康。神经递质包括氨基酸类神经递质和单胺类神经递质,是维持中枢神经功能的重要物质[1-2]。中枢神经递质的含量和比例决定了中枢神经功能,在脑缺血过程中发挥重要作用。
氨基酸类神经递质广泛存在于大脑各个区域,兴奋性氨基酸(EAA)和抑制性氨基酸(IAA)在脑内维持兴奋-抑制平衡,对认知、运动等功能具有重要的调节作用。脑缺血状态下,兴奋与抑制性氨基酸类神经递质的平衡被破坏[3-5],影响中枢神经功能;单胺类神经递质也发生明显变化,并能够通过促进自由基产生、促进EAA释放和细胞内钙超载等多种途径,引发一系列病理生理效应,最终导致细胞凋亡或坏死,成为影响脑缺血/再灌注(CIR)损伤的重要因素[6-7]。因此,调节氨基酸类神经递质的平衡和单胺类神经递质的释放是防治CIR的重要途径。
银杏叶的治疗作用在我国古代医书中早有记载,现代研究证明,银杏提取物具有抑制血小板聚集、抗过敏、抗炎、抗休克,以及保护心脑血管、促进学习记忆、防治老年痴呆等作用。银杏二萜内酯葡胺注射液(DGMI)主要成分为银杏内酯A(35%)、银杏内酯B(60%)、银杏内酯C(2%)、银杏内酯K(2%)等,辅料为葡甲胺、柠檬酸、氯化钠,临床用于脑梗死的治疗[8]。DGMI对神经元保护作用[9]及其防治脑血管疾病的研究虽已有报道[10-12],但确切机制以及该药对CIR脑组织中神经递质的影响尚需进一步研究。
1 材料与方法
1.1 药品与试剂 银杏二萜内酯葡胺注射液(简称银杏二萜内酯,缩写为DGMI),江苏康缘药业股份有限公司产品;金纳多(EGb761),购自台湾济生化学制药厂股份有限公司;多巴胺(DA)、二羟苯乙酸(DOPAC)、5-羟色胺(5-HT)、5-羟吲哚乙酸(5-HIAA)、去甲肾上腺素(NE)、肾上腺素(E)、异丙肾上腺素(IP)、天冬氨酸(Asp)、谷氨酸(Glu)、谷氨酰胺(Gln)、甘氨酸(Gly)、牛磺酸(Tau)、γ-氨基丁酸(GABA)、丝氨酸(Ser)、辛烷磺酸钠(OSA)均购自Sigma-Aldrich。
1.2 实验仪器 HR-120电子天平,日本AND公司;BeckMan Allegra X-22R冷冻离心机,美国Beckman公司;HPLC-ECD 5300高效液相色谱库仑电化学分析系统,美国ESA公司。
1.3 实验动物 SPF级♂ SD大鼠,体质量240 g~260 g,购自北京维通利华动物技术有限公司,合格证号:SCXK(京)2014-0001。
1.4 动物模型建立 采用线栓法制备大脑中动脉闭塞/再灌注(MCAO/R)模型。380 mg·kg-110%水合氯醛腹腔注射麻醉大鼠,仰卧位固定,颈正中线切口,钝性分离,沿胸锁乳突肌内缘分离肌肉和筋膜,分离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。用1号缝合线勒紧CCA近心端及ICA,结扎ECA远心端,并于ECA下埋线用于固定线栓,ECA上剪出斜行切口,插入线栓,进入18 mm左右,固定线栓。缺血1.5 h后,拔出线栓,实现再灌注,同时尾静脉注射给药。银杏二萜内酯葡胺注射液:低剂量(1 mg·kg-1)、中剂量(3 mg·kg-1)、高剂量(10 mg·kg-1);阳性对照组金纳多:5 mg·kg-1。逐层缝合伤口,大鼠归笼饲养。
1.5 药效学评价 再灌注24 h,处死动物前采用Bederson’s标准进行神经行为学评分。断头处死大鼠,迅速取出脑组织冻于-20℃冰箱20 min,然后进行冠状切片,将脑切片置于0.5% TTC溶液中,于37℃避光孵育20 min,之后置于4%多聚甲醛溶液中固定。拍照,采用Image J图像分析软件计算脑组织梗死体积。另取大鼠断头处死后取脑,称湿重,然后将脑组织置于100℃恒温干燥箱中,烘干24 h至恒重,称重即为干重,按下式计算水肿百分比:水肿百分比/%=(湿重-干重)/湿重×100%。
1.6 氨基酸类递质含量检测
1.6.1 溶液配制 0.1 mol·L-1四硼酸钠(Na2B4O7·10H2O)溶液,调节pH至9.3;OPA/β-Me贮存液的配制:称取邻苯二甲醛(OPA)27 mg,溶于1 mL甲醇中,再加入5 μL β-巯基乙醇(β-Me)及9 mL 0.1 mol·L-1四硼酸钠,贮于棕色瓶中。用时1 mL贮存液加3 mL 0.1 mol·L-1四硼酸钠稀释即可;标准品储备液的配制:称取各标准品适量,溶于1 mL双蒸水:甲醇=1 ∶1(V∶V)溶液中贮存;内标液的配制:0.05 mol·L-1高氯酸,含Ser 40 μg·mL-1。
1.6.2 色谱条件 流动相:0.1 mol·L-1Na2HPO4水溶液含0.13 mmol·L-1EDTA.Na2和28%甲醇,用浓磷酸调pH至6.00,0.22 μm微孔滤膜抽滤脱气;固定相:Column MD-150,3 μm填充不锈钢柱。工作电压400 mV,柱温40℃,流速0.6 mL·min-1。
1.6.3 氨基酸类递质标准曲线 分别配制Asp、Glu、Gln、Gly、Tau、GABA系列浓度标准品,以Ser为内标,在相应色谱条件下进行测定,分别以Asp、Glu、Gln、Gly、Tau、GABA峰面积与Ser的比值对Ser浓度作线性回归,考察其线性情况。
1.6.4 动物取材 大鼠行为学检测结束后,颈椎脱臼处死,迅速取全脑冰上分离皮层、海马,存于液氮备用。
1.6.5 样品的处理 取脑组织精确称重,每100 mg加入200 μL的0.2 mol·L-1高氯酸,超声粉碎60 s,4℃ 12 000 r·min-1离心30 min取上清液,即为样品溶液。
1.6.6 衍生化反应 20 μL标准品溶液或样品溶液加入20 μL内标液,混匀后取20 μL加入40 μL衍生化工作液(OPA/β-Me工作液),冰上反应2 min,取30 μL进样,用于检测。
1.7 单胺类递质含量检测
1.7.1 溶液配制 称取DA、DOPAC、5-HT、5-HIAA、NE、E6种待检测递质,溶解于0.05 mol·L-1的高氯酸中,得终浓度为0.2 g·L-1的标准储备溶液;配制0.02 mol·L-1高氯酸(含IP 1.0 μmol·L-1, EDTA 0.5 mmol·L-1)作为匀浆液。
1.7.2 色谱条件 流动相:0.1 mol·L-1NaH2PO4水溶液含0.85 mmol·L-1OSA、0.5 mmol·L-1EDTA.Na2和11%甲醇,用浓磷酸调pH至3.25,0.22 μm微孔滤膜抽滤脱气;固定相:Column MD-150,3 μm填充不锈钢柱。工作电压400 mV,柱温35℃,流速0.6 mL·min-1,进样量30 μL。
1.7.3 单胺类递质的标准曲线 分别配制DA、DOPAC、5-HT、5-HIAA、NE、E浓度为2 500、1 000、500、250、100、50、25、10 ng·g-1的系列标准品,以IP为内标,在相应色谱条件下进行测定,分别以DA、DOPAC、5-HT、5-HIAA、NE、E峰面积与IP的比值对IP浓度作线性回归,考察其线性情况。
1.7.4 动物取材 方法同“1.6.4”。
1.7.5 样品的处理 取冻存组织,每100 mg加入200 μL预冷匀浆缓冲液,超声40 s,4℃ 12 000 r·min-1离心30 min,取上清液30 μL进样,进行检测。
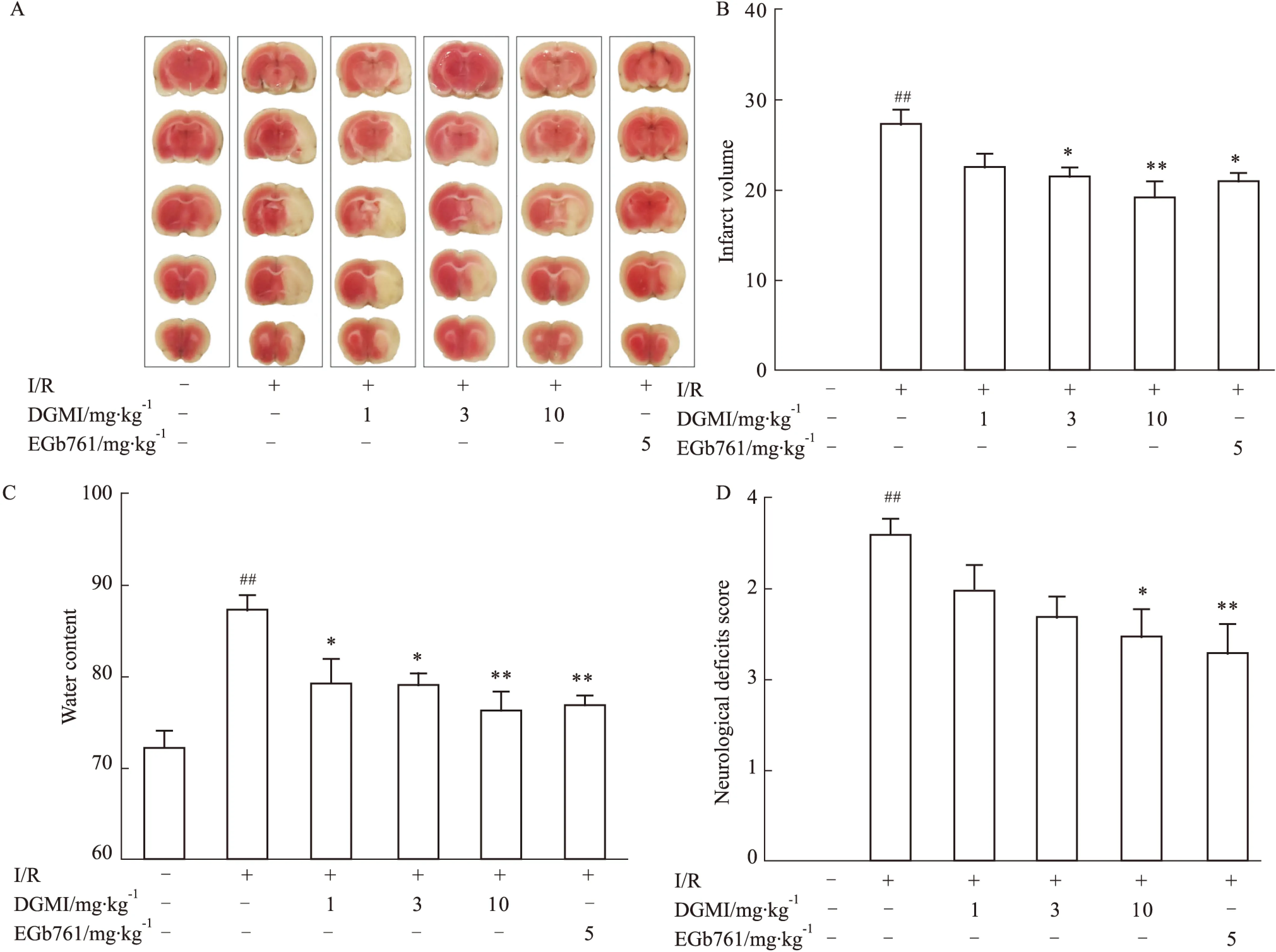
Fig 1 DGMI protects against MACO/R induced brain injury in rats
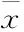
2 结果
2.1 DGMI对MCAO/R大鼠脑损伤的治疗作用 大鼠脑缺血1.5 h,再灌注24 h,缺血侧半球出现大面积梗死(梗死体积达28%)。DGMI中高剂量组和5 mg·kg-1EGb761均可减小脑梗死体积,与模型组相比,分别降低22%、32%和25%(Fig 1A 和Fig 1B);DGMI可以剂量依赖的减轻MCAO/R引起的脑水肿,与模型组比较,3个剂量组的水肿程度分别降低9%、10%和12%,5 mg·kg-1EGb761可降低脑水肿11%(Fig 1C);高剂量DGMI和5 mg·kg-1EGb761治疗组能够明显降低MCAO/R引起的大鼠神经行为学缺损评分(Fig 1D)。
2.2 DGMI对MCAO/R大鼠脑组织内氨基酸类递质含量的影响
2.2.1 氨基酸类递质专属性考察 如Fig 2所示,在实验所采用的HPLC条件下,Asp、Glu、Gln、Gly、Tau、GABA与Ser保留时间分别为1.8、3.0、5.4、8.9、14.8、22.6和4.7 min,各组分间可以完全分离,并且脑组织中内源性物质对测定没有干扰。

Fig 2 Chromatographic peak of Asp,Glu,Gln,Gly,Tau,GABA and Ser
2.2.2 HPLC法测定氨基酸类递质的标准曲线 如Tab 1所示,Asp、Glu、Gln、Gly、Tau、GABA在25~1 000 μg·g-1范围内拟合校正曲线(权重:1/X)相关系数(r2)大于0.99。

Tab 1 Calibration curve of Asp, Glu,Gln,Gly,Tau,GABA in rat brain
2.2.3 DGMI对MCAO/R大鼠脑组织内兴奋性氨基酸类递质的影响 如Fig 3所示,与正常对照组相比,模型组缺血侧皮层和海马兴奋性氨基酸类递质Asp、Glu、Gln的含量都明显升高;与模型组相比,DGMI中、高剂量组可以明显降低皮层和海马中Glu的含量(Fig 3B),高剂量组可以明显降低皮层和海马中Gln的含量(Fig 3C),但对于Asp含量却无明显影响(Fig 3A)。2.2.4 DGMI对MCAO/R大鼠脑组织内抑制性氨基酸类递质的影响 如Fig 4所示,与正常对照组相比,模型组缺血侧皮层和海马抑制性氨基酸GABA和皮层中的Gly含量有所上升,皮层和海马内的Tau以及海马中的Gly没有明显变化;与模型组相比,DGMI各剂量均可明显降低皮层中Gly的含量,中、高剂量的DGMI可以降低GABA的含量,但对于其他氨基酸含量无明显影响。
2.2.5 脑组织中氨基酸类神经递质变化特征 对各组大鼠脑组织皮层和海马中氨基酸类神经递质进行PCA分析,依据两个主成分采用SIMCA-P做出平面图,直观表现原始数据代表的样本状态[13-16]。PCA分析得到的图谱如Fig 5所示,皮层(Fig 5A)和海马(Fig 5B)中每一个样本在PCA图上的位置由氨基酸含量的定量数值决定。正常对照组、MCAO/R组以及DGMI治疗组各自出现在PCA图谱的相近位置,由此表示各组内样本含有的氨基酸浓度相近,具有相似生理状态。从图中可以看出,MCAO/R组样品点远离正常对照组,说明MCAO/R引起了皮层和海马中氨基酸含量变化。与MCAO/R组相比,DGMI治疗组降低了与正常对照组样品点的离散程度,样品点不同程度向正常对照组聚集。
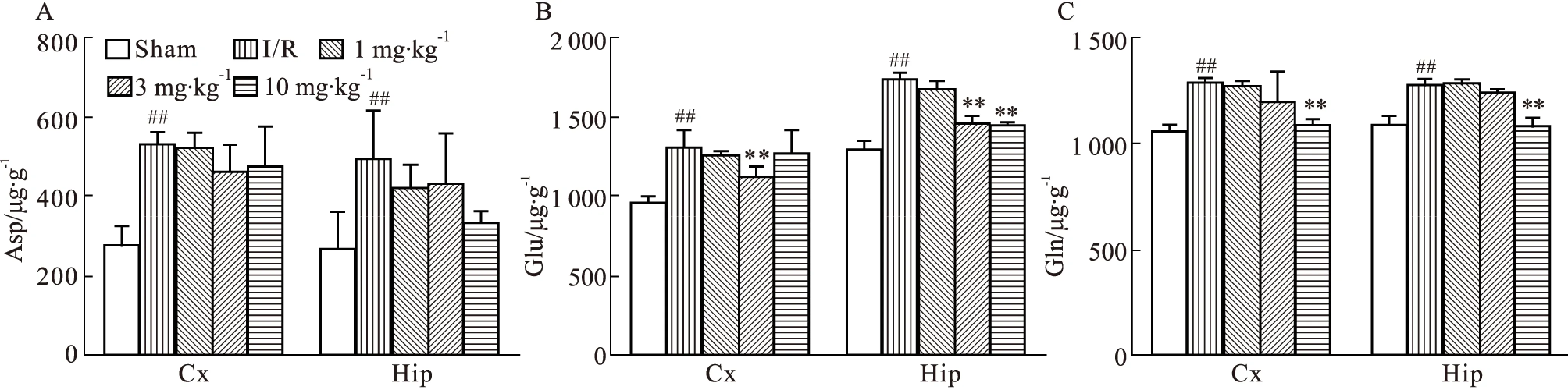
Fig 3 Effects of DGMI treatment on levels of Asp (A); Glu (B) and Gln (C) in cortex and hippocampus after 1.5 h of MCAO followed by 24 h reperfusion

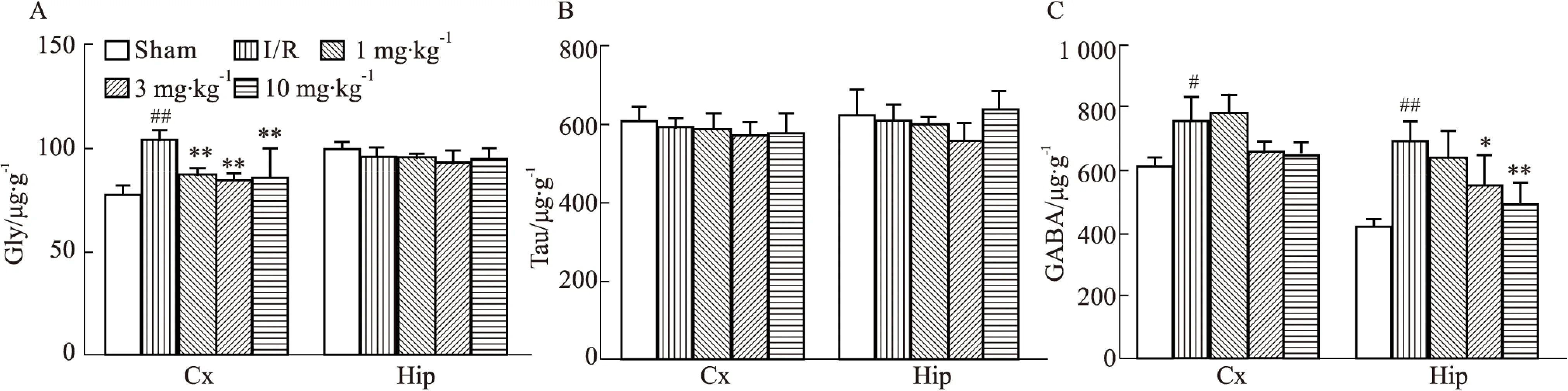
Fig 4 Effects of DGMI treatment on levels of Gly (A); Tau (B) and GABA(C) in cortex and hippocampus after 1.5 h of MCAO followed by 24 h reperfusion

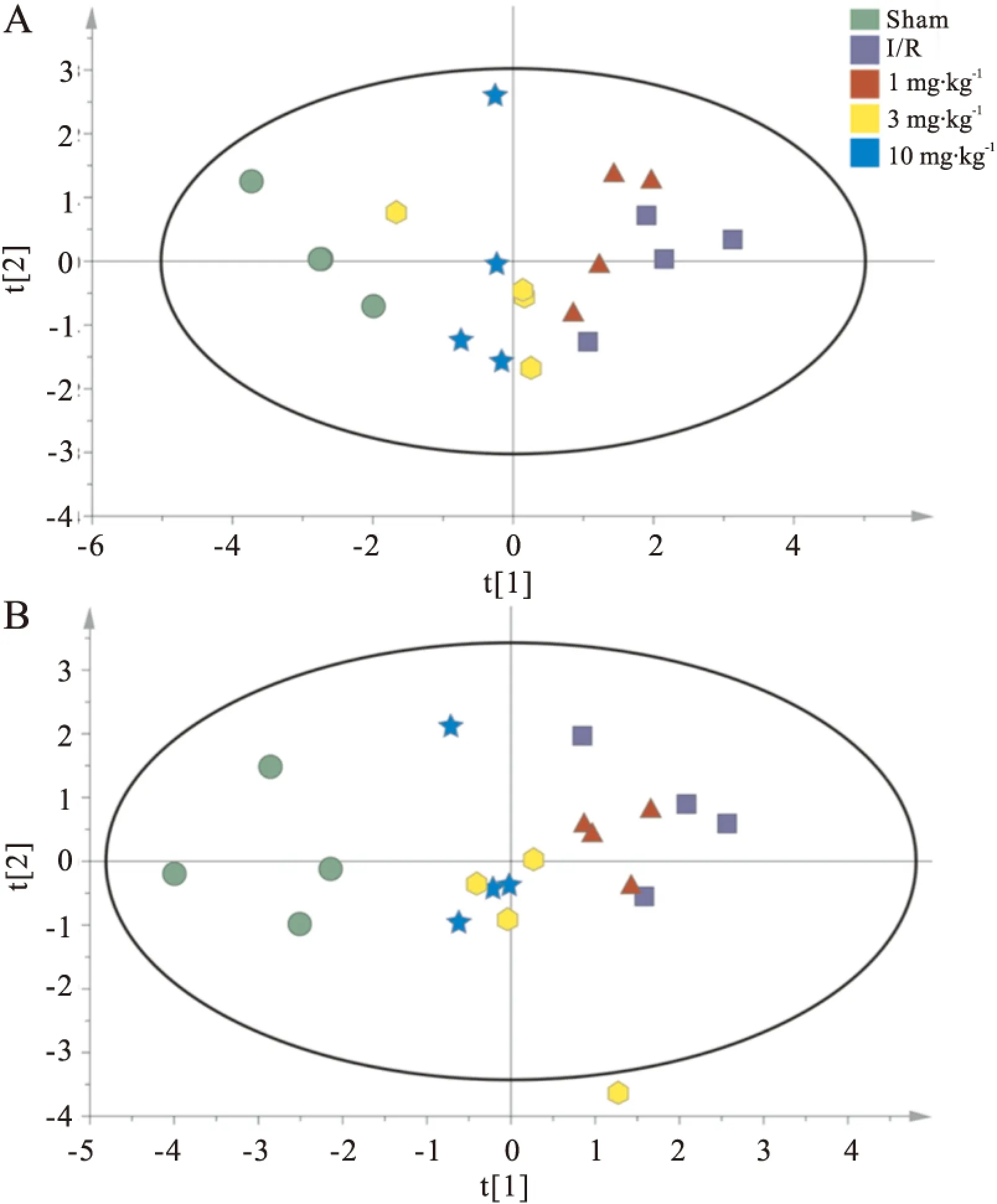
Fig 5 PCA for effects of DGMI on levels of amino acid neurotransmitters in cortex (A) and hippocampus (B) after 1.5 h of MCAO followed by 24 h reperfusion
2.3 DGMI对MACO/R大鼠脑组织单胺类递质含量的影响
2.3.1 单胺类递质专属性考察 如Fig 6所示,在实验所采用的HPLC条件下,NE、E、DOPAC、DA、5-HIAA、5-HT与IP保留时间分别为1.8、2.4、4.1、5.3、7.2、14.6、和8.9 min,各组分之间可以完全分离,并且脑组织中内源性物质对测定没有干扰。
2.3.2 HPLC法测定单胺类递质的标准曲线 如Tab 2所示,NE、E、DOPAC、DA、5-HIAA、5-HT在10~2 500 ng·g-1范围内拟合校正曲线(权重:1/X)相关系数(r2)大于0.99。
2.3.3 DGMI对MCAO/R大鼠脑组织内多巴胺类递质含量的影响 如Fig 7所示,结果表明,与正常对照组相比,模型组大鼠受损脑区皮层中DA水平有所降低;而海马中DA水平略有升高。与模型组相比,DGMI治疗后,能够升高缺血侧大脑皮层DA水平(Fig 7A)。脑缺血1.5 h再灌注24 h,缺血侧皮层和海马DOPAC含量均明显升高,与模型组相比,DGMI各剂量组都能够降低DOPAC含量(Fig 7B)。另外,对各组大鼠皮层、海马中的DOPAC/DA的值进行了计算和比较。结果显示,与正常对照组相比,模型组DOPAC/DA水平明显升高;与模型组相比,DGMI高剂量治疗组可以降低海马中DOPAC/DA水平(Fig 7C)。

Tab 2 Calibration curve of NE,E,DOPAC, DA,5-HIAA,5-HT in rat brain

Fig 6 Chromatographic peak of NE,E,DOPAC,DA,5-HIAA,5-HT and IP
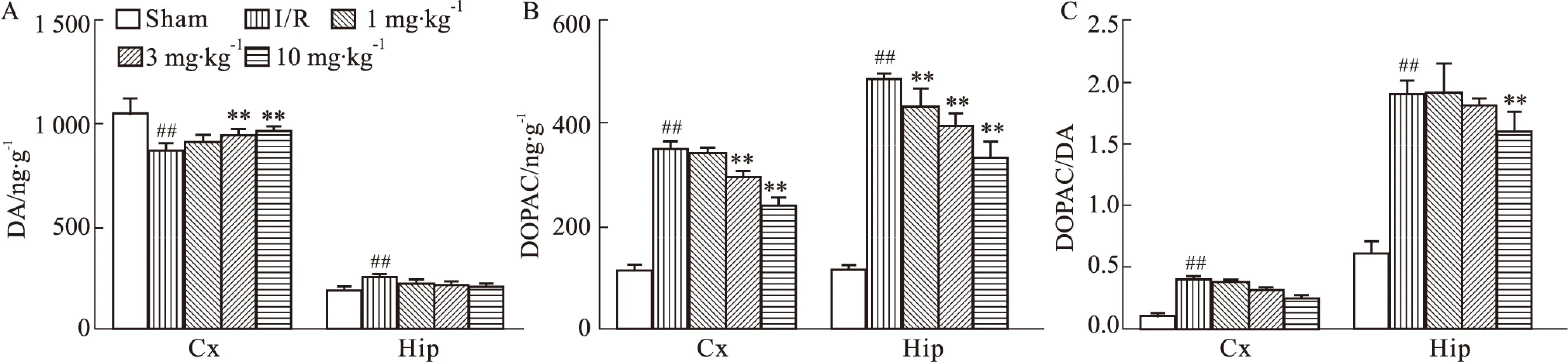
Fig 7 Effects of DGMI treatment on levels of DA (A); DOPAC (B) and DOPAC/DA (C) in cortex and hippocampus after 1.5 h of MCAO followed by 24 h reperfusion


Fig 8 Effects of DGMI treatment on levels of 5-HIAA (A); 5-HT (B) and 5-HIAA/5-HT (C) in cortex and hippocampus after 1.5 h of MCAO followed by 24 h reperfusion

2.3.4 DGMI对MCAO/R大鼠脑组织内5-HT类递质含量的影响 如Fig 8所示,与正常对照组相比,模型组缺血侧皮层和海马5-HIAA含量均明显升高;与模型组相比,DGMI高剂量组能够降低5-HIAA含量(Fig 8A)。脑缺血1.5 h再灌注24 h,缺血侧皮层和海马5-HT含量均明显升高,与模型组相比,DGMI中、高剂量组都能够明显降低5-HT含量(Fig 8B)。同时,对各组大鼠皮层、海马中的5-HIAA/5-HT的值进行比较。结果显示,与正常对照组相比,模型组海马中5-HIAA/5-HT水平明显升高;与模型组相比,DGMI治疗组对5-HIAA/5-HT水平没有明显影响(Fig 8C)。
2.3.5 DGMI对MCAO/R大鼠脑组织去甲肾上腺素与肾上腺素含量影响 如Fig 9所示,与正常对照组相比,模型组缺血侧皮层、海马NE和E的含量均明显升高,而与模型组相比,DGMI高剂量组,能够降低NE含量。与模型组相比,DGMI治疗组缺血侧皮层和海马中E的水平均没有明显变化。
2.3.6 脑组织中单胺类神经递质PCA分析 对各组大鼠脑组织皮层和海马中单胺类神经递质进行PCA分析,由两个主成分采用SIMCA-P做出平面图。如Fig 10所示,正常对照组、MCAO/R组以及DGMI治疗组各自出现在PCA图谱的相近位置,由此表示各组内样本含有的单胺类递质浓度相近,具有相似生理状态。MCAO/R组远离正常对照组样品点,说明MCAO/R引起皮层(Fig 10A)和海马(Fig 10B)中单胺类神经递质含量变化。DGMI治疗组能够不同程度降低样品点离散程度,向正常对照组聚集。
3 讨论
脑缺血/再灌注可以导致一系列继发性病理、生理变化,其中脑内兴奋与抑制性氨基酸递质浓度失衡是造成脑组织损伤的重要因素之一[1]。兴奋性氨基酸(EAA)是广泛存在于哺乳动物中枢神经系统的正常兴奋性神经递质,参与突触兴奋传递、学习记忆形成[17]。由于缺血/缺氧,神经元去极化,释放大量EAA。EAA毒性作用对脑组织的损伤主要表 现为:过多的EAA引起突触后神经元去极化,大量K+外流,Na+内流,Cl-及H2O被动内流引起以神经元渗透性水肿为主的急性损伤,诱导细胞坏死和凋亡;通过刺激EAA受体,启动Ca2+通道,Ca2+大量内流,激活一系列依赖于Ca2+的酶系统,造成迟发性神经元变性坏死[18-19]。
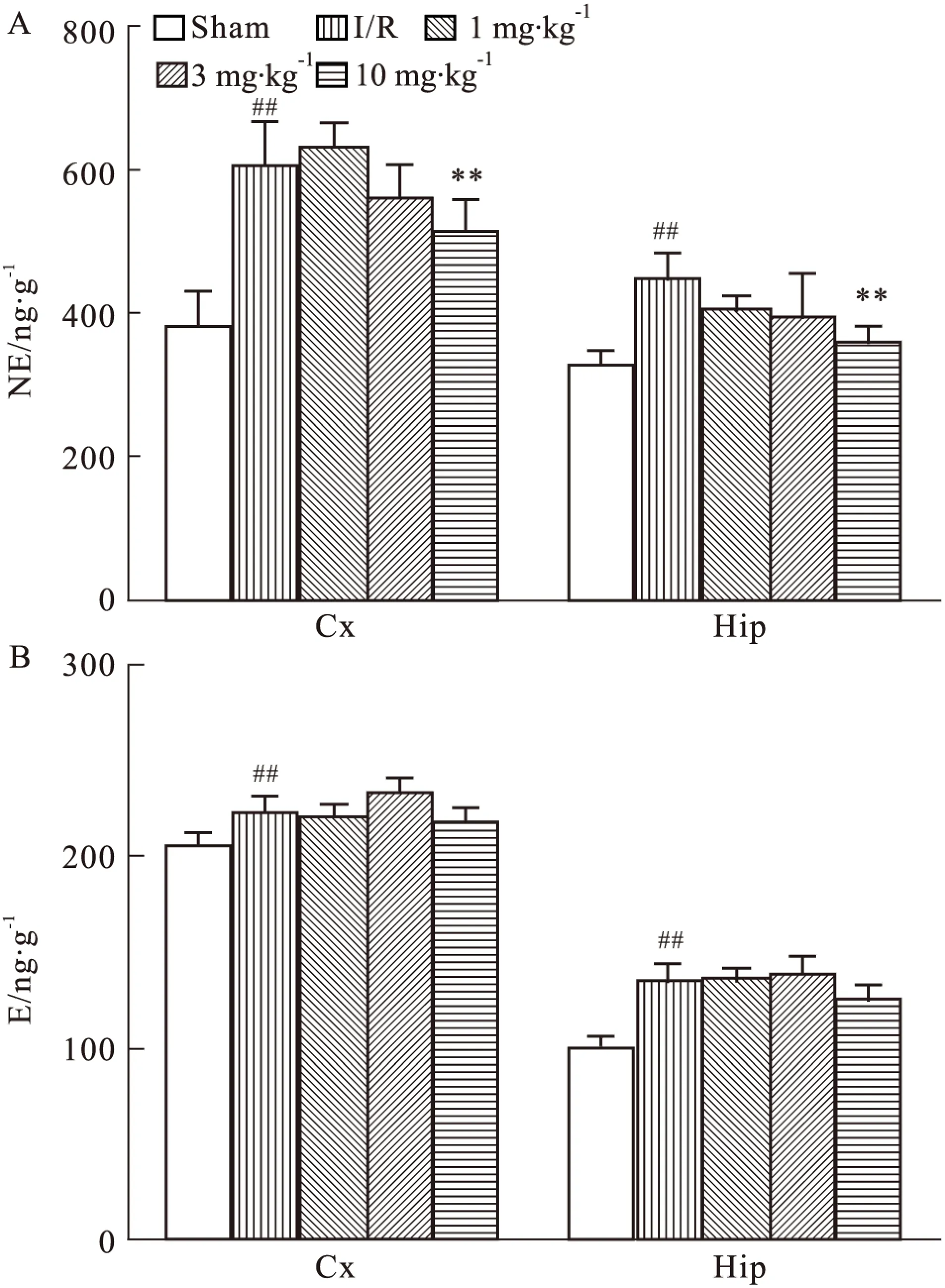
Fig 9 Effects of DGMI treatment on levels of NE (A); and E (B) in cortex and hippocampus after 1.5 h of MCAO followed by 24 h reperfusion
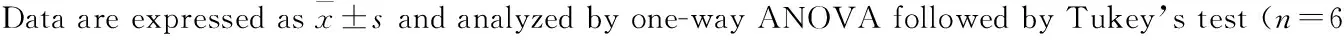
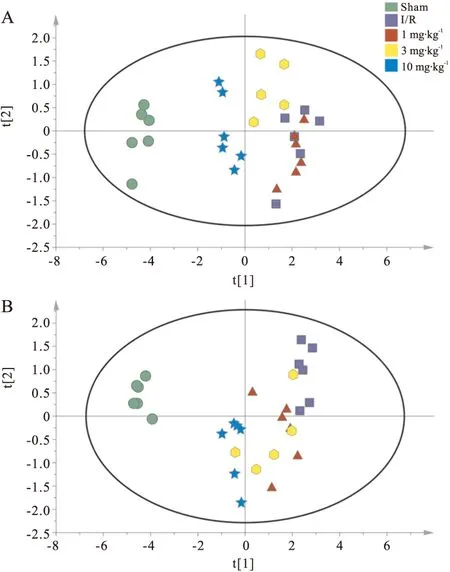
Fig 10 PCA for effects of DGMI on levels of monoamine neurotransmitters in cortex (A) and hippocampus (B) after 1.5 h of MCAO followed by 24 h reperfusion
作为中枢神经系统内的IAA,GABA是三羧酸循环中Glu在谷氨酸脱羧酶诱导生成的产物,GABA可通过突触后膜超极化、减少离子内流、降低细胞代谢及氧消耗,使突触后神经元处于保护性抑制状态,抑制神经元兴奋,减轻细胞损伤;并通过突触前抑制减少Glu的释放,减轻EAA毒性作用[20-21]。
MCAO/R损伤后,EAA局部浓度升高,Na+、Cl-和水大量流入细胞内,造成神经元的急性肿胀,产生兴奋性毒性[22]。同时MCAO/R引起的能量缺乏,导致神经和胶质细胞摄取功能下降,造成细胞外EAA浓度升高;钙离子超载,自由基及腺苷酸含量升高将进一步刺激Glu和Asp浓度升高,使细胞外堆积大量的EAA。同时为了达到机体内兴奋—抑制平衡,IAA水平升高[23-24]。DGMI可以调节MCAO/R大鼠脑组织内EAA和IAA的水平,降低EAA含量以减少EAA对神经元产生的兴奋性毒性,降低IAA水平以恢复脑组织中兴奋—抑制平衡。总的来说,DGMI可以调节MCAO/R大鼠脑内EAA、IAA水平,使脑组织中异常升高的EAA和IAA趋向于恢复正常,抑制MCAO/R造成的神经元坏死,改善脑组织损伤。
1974年Wrutman等根据临床和实验资料提出缺血性脑损伤的单胺类递质假说,认为单胺类递质的过度释放是脑缺血后脑血管痉挛、血流障碍的主要原因。同时单胺类递质释放增加又可加速组织脂质过氧化,促使线粒体氧化磷酸化分离,加重脑缺血,最后产生脑水肿,形成恶性循环[6]。但是目前对于单胺类递质在MCAO/R损伤中的具体作用及其过程尚未有明确定论。
本实验结果表明,MCAO/R损伤后DA大量释放,直接发挥神经毒性作用、介导EAA和自由基的毒性作用,导致细胞脂质微环境破坏,微血管损伤,细胞内蛋白质、DNA、RNA、氨基酸及高糖分子氧化、交联、变性,线粒体呼吸功能受到抑制,细胞内钙超载、最终导致神经元损伤坏死、凋亡[25]。DOPAC是DA的代谢产物,其比值反映了DA的代谢率水平。MCAO/R会导致DA代谢加强。再灌注24 h,DOPAC含量明显增加,海马中DA水平略有升高而皮层中DA含量略有下降,并且DOPAC/DA明显增加,说明,DA分解加强大于合成加强,此过程消耗大量能量,能量的过分需求使原本已经损伤的产能系统—线粒体的负荷进一步加重,导致神经元损伤加重或坏死[26]。
脑缺血时,脑组织中大量的E能够引起血管强烈收缩,从而加重脑缺血损伤及血管源性脑水肿。E的释放会加剧神经元代谢,并增加缺血组织血流与代谢需求的失衡[27]。
脑缺血后细胞外5-HT浓度迅速升高。缺血/缺氧后内皮屏障被破坏,5-HT则可进入平滑肌引起血管收缩。同时5-HT能够加强EAA的神经毒性,使EAA引起的兴奋性去极化幅度和时相加强,伴随细胞内钙离子的快速聚集。同时5-HT使花生四烯酸代谢加强,产生多种有毒产物,加重缺血/再灌注损伤[28]。5-HIAA是5-HT的代谢产物,其比值反映了5-HT的代谢率水平。MCAO/R会导致5-HT浓度迅速升高,代谢加强,5-HIAA含量明显增加,并且5-HIAA/5-HT明显升高。
DGMI治疗组能够抑制DA含量增加,并且抑制其代谢。同时可以抑制5-HT的产生,并且降低其代谢产物5-HIAA的含量。
以上实验结果表明,DGMI可以改善由于能量衰竭、去极化导致递质外流和重摄取障碍,抑制MCAO/R导致的脑内Asp、Glu、Gln、Gly、GABA升高;降低缺血脑区皮层和海马内NE、DOPAC、5-HT、5-HIAA的表达,抑制皮层内E的降低,从而对MCAO/R大鼠发挥脑保护作用。
综上所述,MCAO/R导致脑组织中神经递质变化,DGMI可以有效调节其脑内浓度,减轻缺血引起的变化,这种作用可能是DGMI促进损伤组织修复的基础,也可能是由于其他途径促进神经细胞功能恢复影响了递质的变化,其详细机制有待进一步研究。可以确定的是,DGMI治疗脑缺血损伤与神经递质的变化有密切关系。
[1] Vallon M, Chang J, Zhang H, et al. Developmental and pathological angiogenesis in the central nervous system[J].CellMolLifeSci,2014,71(18):3489-506.
[2] 刘青青,郭 虹,王少峡,等.脑缺血损伤机制的研究进展[J]. 中华中医药学刊,2012,30(6):1228-30.
[2] Liu Q Q, Guo H, Wang S X, et al. Research advance on mechanisms of brain ischemic injury[J].ChinArchTraditChinMed,2012,30(6):1228-30.
[3] 王军玲,杨 阳,高 健,等.基于氨基酸代谢的抗脑缺血益气解毒配伍中药协同作用研究[J]. 中国药理学通报,2014,30(5):725-31.
[3] Wang J L, Yang Y, Gao J, et al. Synergistic and protective effects of various combination of major components of YiQiJieDu (YQJD) on focal cerebral ischemia injury based on amino acid metabonomics[J].ChinPharmacolBull,2014,30(5):725-31.
[4] Guo Z L, Zhu Y, Su X T, et al. DanHong injection dose-dependently varies amino acid metabolites and metabolic pathways in the treatment of rats with cerebral ischemia[J].ActaPharmacolSin,2015,36(6):748-57.
[5] 刘宗文,张 艳,贾丹辉,等.阿米替林对脑缺血/再灌注大鼠大脑皮层中氨基酸类神经递质的影响[J]. 中国药学杂志,2008,43(17):1305-8.
[5] Liu Z W, Zhang Y, Jia D H, et al. Effects of amitriptyline on amino acids in ischemic areas in rats subjected to focal cerebral ischemia reperfusion[J].ChinPharmJ,2014,20(17): 1305-8.
[6] Wurtman R J, Zervas N T. Monoamine neurotransmitters and the pathophysiology of stroke and central nervous system trauma[J].JNeurosurg, 1974,40(1):34-6.
[7] 张 艳,贾丹辉,刘宗文,等. 阿米替林对局灶性脑缺血/再灌注损伤脑内单胺类神经递质的影响[J]. 中国药理学通报,2007,23(8):1077-80.
[7] Zhang Y, Jia D H,Liu Z W, et al. Effects of amitriptyline on monoamines of brain tissue in rats with focal cerebral ischemia reperfusion injury[J].ChinPharmacolBull, 2007,23(8):1077-80.
[8] 伍清龙,孙永成,万 琴,等.HPLC-ELSD法测定注射用银杏二萜内酯中银杏内酯A、B、C、K[J]. 现代药物与临床,2014,29(3):255-8.
[8] Wu Q L, Sun W C, Wan Q, et al. Determination of ginkgolide A, B, C, and K in diterpene lactones from ginkgo biloba for injection by HPLC-ELSD[J].DrugsClin,2014,29(3):255-8.
[9] 刘 秋,许治良,周 军,等.银杏二萜内酯葡胺注射液对缺糖缺氧损伤的SH-SY5Y细胞保护作用[J]. 中国药理学通报,2015,31(7):994-9.
[9] Liu Q, Xu Z L, Zhou J, et al. Neuroprotective effects of YXETNZ injection on SH-SY5Y cells against injury induced by oxygen-glucose deprivation[J].ChinPharmacolBull,2015,31(7):994-9.
[10]陈春苗,周 军,陈 健,等. 银杏二萜内酯葡胺注射液对大鼠急性脑缺血/再灌注损伤的影响[J]. 中国实验方剂学杂志,2014,20(17):133-6.
[10]Chen C M, Zhou J, Chen J, et al. Protective effects of ginkgo terpene lactones meglumine injection on focal cerebral ischemia reperfusion injury in rats[J].ChinJExpTraditMedFormul,2014,20(17): 133-6.
[11]章晨峰,曹 亮,邓 奕,等.银杏二萜内酯葡胺注射液对脑缺血/再灌注大鼠行为学和脑脊液成分的影响[J]. 中国实验方剂学杂志,2015,21(20):118-22.
[11]Zhang C F, Cao L, Deng Y, et al. Effect of ginkgo terpene lactones meglumine injection on behavior and cerebrospinal fluid in rats with cerebral ischemia/reperfusion[J].ChinJExpTraditMedFormul,2015,21(20):118-22.
[12]Jin G, He X R, Chen L P. The protective effect of ginkobilboa leaves injection on the brain dopamine in the rat model of cerebral ischemia/reperfusion injury[J].AfrHealthSci, 2014,14(3):725-8.
[13]邢 婕,原曙春,孙惠敏,等.基于1H NMR代谢组学和偏最小二乘法的小柴胡汤证判别研究[J]. 药学学报,2015,50(8):1032-7.
[13]Xing J, Yuan S C, Sun H M, et al. Discrimination of patients with Xiao-Chaihu Tang syndrome using 1H NMR metabonomics and partial least square analysis[J].ActaPharmSin,2015,50(8):1032-7.
[14]Gao J, Zheng X G, Li Z H, et al. Metabonomic study on chronic unpredictable mild stress and intervention effects of Xiaoyaosan in rats using gas chromatography coupled with mass spectrometry[J].JEthnopharmacol,2011,137(1):690-9.
[15]Li X W, Zhang F S, Wang D Q, et al. NMR-based metabonomic and quantitative real-time PCR in the profiling of metabolic changes in carbon tetrachloride-induced rat liver injury[J].JPharmBiomedAnal,2014,89:42-9.
[16]Gao X X, Guo B R, Yang L, et al. Selection and dynamic metabolic response of rat biomarkers by metabonomics and multivariate statistical analysis combined with GC-MS[J].PharmacolBiochemBehav,2014,117:85-91.
[17]Melan A, Panton L, Corsi C, et al. Striatal outflow of adenosine, excitatory amino acids, gamma-aminobutyric acid, and taurine in awake freely moving rats after middle cerebral artery occlusion: correlations with neurological deficit and histopathological damage[J].Stroke,1999,30(11):2448-54.
[18]宋文婷,徐 立,刘建勋.脑缺血后谷氨酸及其受体介导的神经细胞损伤及相关药物研究进展[J]. 中国药理学通报,2012,28(6):747-50.
[18]Song W T, Xu L, Liu J X. Role of plasminogen system in myofibroblast apoptosis and tissue fibrosis[J].ChinPharmacolBull,2012,28(6): 747-50.
[19]梅和珊,王永利.脑缺血时谷氨酸释放机制[J]. 中国药理学通报,2005,21(4):393-6.
[19]Mei H S, Wang Y L. The mechanisms of glutamate release in cerebral ischemia[J].ChinPharmacolBull,2005,21(4):393-6.
[20]Vemuganti R. Decreased expression of vesicular GABA transporter, but not vesicular glutamate, acetylcholine and monoamine transporters in rat brain following focal ischemia[J].NeurochemInt,2005,47(1-2):136-42.
[21]周伟勤.淫羊藿苷对快速老化小鼠SAMP8学习记忆的影响及作用机理研究 [D].北京:北京协和医学院, 2009:29-42.
[21]Zhou W Q. The study on the effects and mechanism of icariin on learning and memory in senescence accelerated mouse prone/8 (SAMP8)[D]. Beijing: PUMC, 2009:29-42.
[22]Wang T, Li Y, Zhao P, et al. Effects of oxysophoridine on amino acids after cerebral ischemic injury in mice[J].AnnIndianAcadNeurol,2014, 17(3):313-6.
[23]Benveniste H. Glutamate, microdialysis, and cerebral ischemia: lost in translation[J].Anesthesiology,2009,110(2):422-5.
[24]Krayznowska W, Pomierny B, Budziszewska B, et al. N-acetylcysteine and ceftriaxone as preconditioning strategies in focal brain ischemia: influence on glutamate transporters expression[J].NeurotoxRes, 2016,29(4):539-50.
[25]Zhang N, Liu P, He X R. Effect of single-use versus combined-use moschus and diazepam on expression of amino acid neurotransmitters in the rat corpus striatum[J].NeuRegeneratRes,2012,7(3):182-6.
[26]钟 明,陈 虹,姜 勇,等.松果菊苷对脑缺血大鼠双侧脑组织中单胺类神经递质的影响[J]. 中国新药杂志,2012,21(11):1283-7.
[26]Zhong M, Chen H, Jiang Y, et al. Effect of echinacoside on monoamine neurotransmitters in bilateral brain tissue of rats with cerebral ischemia[J].ChinJNewDrugs,2012,21(11):1283-7.
[27]陶 冶.急性脑缺血/再灌注皮层单胺类神经递质动态变化及中药干预作用[D].北京:北京中医药大学, 2008:19-34.
[27]Tao Y. Dynamic changes on monoamine neurotransmitter and effects of Chinese medicine after cerebral ischemia and reperfusion in rats[J]. Beijing: Beijing University of Chinese Medicine, 2008:19-34.
[28]Yao J, Shen X N, Shen H, et al. Effects of theanine on monoamine neurotransmitters and related genes in cerebral ischemia-reperfusion injury rats[J].ChinPrevMed,2012,46(7):635-9.
Effects of diterpene ginkgolides meglumine injection on neurotransmitters in cerebral ischemia-reperfusion injury rats
ZHANG Wen1, SONG Jun-ke1, HE Guo-rong1, ZHANG Xue1,ZHOU Qi-meng1,WANG Zhen-zhong2, XIAO Wei2, XIAO Zhi-yong3, ZHOU Wen-xia3,DU Guan-hua1
(1.BeijingKeyLaboratoryofDrugTargetIdentificationandDrugScreening,InstituteofMateriaMedica,ChineseAcademyofMedicalSciencesPekingUnionMedicalCollege,Beijing100050,China; 2.StateKeyLaboratoryofNew-techforChineseMedicinePharmaceuticalProcess,JiangsuKanionPharmaceuticalCo.,Ltd.,LianyungangJiangsu222001,China;3.StateKeyLaboratoryofToxicologyandMedicalCountermeasures,InstituteofPharmacologyandToxicology,AcademyofMilitaryMedicalScience,Beijing100850,China)
Aim To investigate the effects of diterpene ginkgolides meglumine injection (DGMI) on amino acids and monoamine neurotransmitters in rats with cerebral ischemia/reperfusion injury. Methods Intraluminal suture was applied to establish middle cerebral artery occlusion (MCAO/R) model with ischemia for 1.5 h and reperfusion for 24 h. After the administration of DGMI (i.v.), the levels of amino acid and monoamine neurotransmitters in brain tissue were detected through HPLC-ECD. Results DGMI down-regulated the concentrations of aspartic acid, glutamic acid, glycine and γ-aminobutyric acid which were increased in MCAO/R group. DGMI also reduced the levels of norepinephrine epinephrine, glyoxylic acid, serotonin and 5-HIAA in cortex and hippocampus, and increased adrenaline content compared to the model group. Conclusion DGMI exhibits a protective role in rats with cerebral ischemia /reperfusion injury through regulating amino acids and monoamine neurotransmitters.
DGMI; cerebral ischemia-reperfusion; amino acid neurotransmitters, monoamine neurotransmitters; HPLC-ECD; metabonomics
时间:2016-12-5 15:14
http://www.cnki.net/kcms/detail/34.1086.R.20161205.1514.010.html
2016-08-02,
2016-09-20
国家科技部“重大新药创制”科技重大专项资助项目(No 2013ZX09508104,2013ZX09402203);抗毒药物与毒理学国家重点实验室开放课题(No TMC201510);国家自然科学青年基金项目(No 81603100);北京协和医学院研究生创新基金项目(No 2015-1007-07)
张 雯(1990-),女,博士生,研究方向:神经药理学与新药发现,Tel:010-63131571,E-mail:zhangwen9010@imm.ac.cn; 杜冠华(1956-),男,博士,研究员,博士生导师,研究方向:神经药理学、心脑血管药理学与新药发现,通讯作者,Tel:010-63165184,E-mail:dugh@imm.ac.cn
10.3969/j.issn.1001-1978.2016.12.005
A
1001-1978(2016)12-1648-09
R-332;R282.71;R322.81;R341.7;R347;R743.310.531

