甲磺酸伊马替尼治疗手术无法切除的晚期胃肠间质瘤
岳欣 胡均 王家仓
·临床研究与应用·
甲磺酸伊马替尼治疗手术无法切除的晚期胃肠间质瘤
岳欣 胡均 王家仓
目的:探讨甲磺酸伊马替尼用于治疗晚期胃肠间质瘤的疗效及生存获益。方法:收集2004年9月至2015年6月天津医科大学肿瘤医院收治的无法手术切除的61例晚期胃肠间质瘤患者的临床资料,接受初始剂量400 mg/d的口服甲磺酸伊马替尼治疗,定期随访,评价生存获益及药物不良反应。结果:61例患者开始接受治疗1年后,治疗有效率为57.4%(35/61),疾病控制率为88.5%(54/61),Logic二元回归分析显示性别、年龄和腹盆腔多发病灶是影响治疗有效率的因素(P<0.05)。本组患者5年累积生存率为53%,Cox回归模型分析提示腹盆腔的多发病灶是影响患者生存获益的重要因素(P<0.05)。除2例患者出现出血,其余患者不良反应轻微。结论:甲磺酸伊马替尼显著改善晚期胃肠间质瘤的生存获益,可作为无法手术切除的晚期胃肠间质瘤的首选治疗。
胃肠间质瘤 甲磺酸伊马替尼 生存获益 靶向治疗
胃肠间质瘤(gastrointestinal stromal tumors,GIST)的概念最早在1983年被提出,其真正起源是胃肠道间质的Cajal细胞,此前这类肿瘤通常被认为来源于平滑肌组织,所以曾被命名为平滑肌瘤或平滑肌肉瘤[1-2]。GIST多发生于胃肠道,也可以发生于胃肠道外其他部位,如腹膜后、盆底、大网膜、胰腺等。以往GIST的治疗多以手术为主,对放化疗不敏感,对于复发、转移而无法切除的病例往往缺乏有效的治疗手段。随着1998年C-KIT基因突变的发现,21世纪初甲磺酸伊马替尼(imatinib mesylate,IM)的问世为GIST的治疗揭开了新的篇章[3]。目前较多研究证明了IM治疗GIST的有效性,但国内针对晚期GIST的IM治疗的临床数据较少,本研究通过回顾IM治疗晚期无法切除的GIST病例,分析其疗效、生存情况以及影响预后的因素。
1 材料和方法
1.1 临床资料
收集2004年9月至2015年6月在天津医科大学肿瘤医院收治的无法手术切除的61例晚期胃肠间质瘤患者的临床资料。纳入标准:通过手术病理标本或活检病理标本获取明确的组织病理学诊断,免疫组织化学染色CD117(+);病灶可评估;不合并其他恶性肿瘤;血常规生化检查无明显异常;心肺功能无严重疾患;无活动性出血及肠道梗阻症状。本组病例中19例患者治疗前进行基因突变分析,C-KIT突变为18例,其中11号外显子突变16例,9号外显子突变2例,未检测到PDGFRA突变。本研究经天津医科大学肿瘤医院伦理委员会批准通过,所有患者均签署知情同意书。
1.2 治疗方法
初始治疗剂量均为IM 400 mg/d,每日清晨餐间口服,病情出现进展后可逐步增加至600 mg/d、800 mg/d。如遇严重不良反应,可减量至300 mg/d或短暂停药,并对症处理。
1.3 疗效评估
通过超声、CT及MRI等影像检查,参照RECIST标准判定疗效为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。CR+PR+SD为疾病控制率(disease control rate,DCR)。无进展生存(progression-free survival,PFS)定义为从开始IM治疗至疾病进展或死亡的时间。
1.4 随访
所有患者定期随访。随访记录截止至2016年6月,中位随访时间为40个月,最短为4个月,最长为136个月。
1.5 统计学方法
采用SPSS 23软件进行数据统计学分析。计数资料对比采用列联表分析,以Logic二元回归分析影响近期疗效的因素,用寿命表法描述生存获益,Cox回归分析影响预后的因素。以P<0.05为差异具有统计学意义。
2 结果
2.1 晚期GIST患者的临床特征
本组患者共61例,中位年龄58(28~79)岁,其中男性46例,女性15例。初治病例13例,复发病例48例。按原发灶分类,其中胃占32.8%(20/61),小肠占45.9%(28/61),结直肠占8.2%(5/61),腹腔及腹膜后占13.1%(8/61),见表1。
2.2 IM治疗晚期GIST的近期疗效
本组病例以开始IM治疗后1年的复查结果评价近期疗效。61例晚期GIST病例,经治疗达CR为1例,PR为34例,SD为19例,PD为7例。近期疗效有效率(response rate,RR)为57.4%(35/61),DCR为88.5%(54/ 61)。Logic二元回归分析显示,性别、年龄和腹盆腔多灶性病变是影响RR的重要因素(P<0.05,表2)。
2.3 IM治疗晚期GIST的生存状况分析
本组病例中最短PFS为4个月,最长PFS为136个月,中位PFS为40个月。寿命表法分析本组病例的生存状况显示,1~5年的累积无进展生存率分别为89%、80%、69%、57%、53%(图1)。Cox回归模型分析显示,腹盆腔多发转移病灶的存在是影响接受IM治疗的晚期GIST患者PFS的重要因素,而肝转移状态对该类接受IM治疗的患者生存的影响差异无统计学意义(表3、图2)。
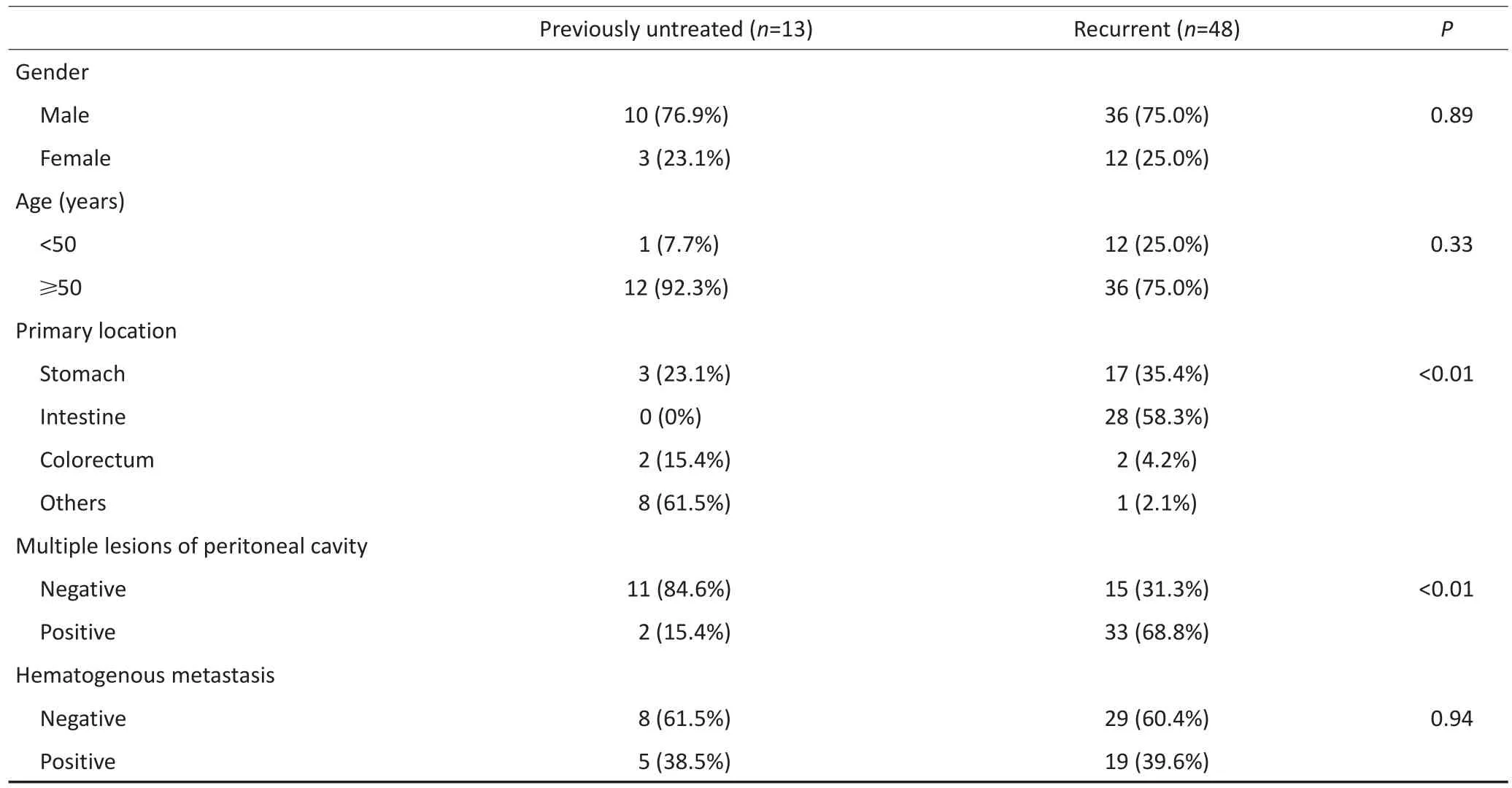
表1 晚期GIST的临床特征(%)Table 1Clinical characteristics of advanced GIST%
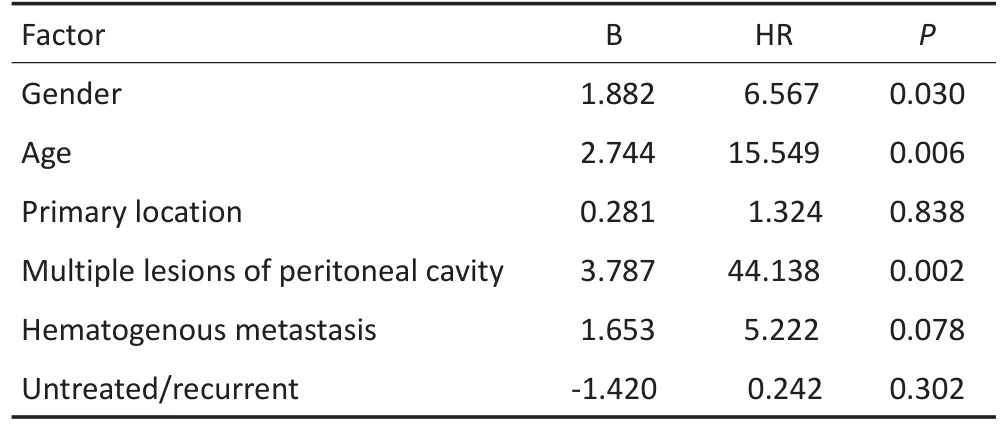
表2 IM治疗晚期GIST有效率的影响因素Logic二元回归分析Table 2Logic regression analysis of IM for advanced GIST

图1 IM治疗晚期GIST的无进展生存分析Figure 1PFS of advanced GIST treated by IM

表3 IM治疗晚期GIST无进展生存的影响因素的Cox回归分析Table 3Cox regression analysis of the factors affecting PFS of advanced GIST treated by IM

图2 有/无腹盆腔多发病灶的晚期GIST经IM治疗后的生存对比Figure 2Comparison of PFS of advanced GIST treated by IM with/without multiple lesions in abdominopelvic cavity
2.4不良反应
本组病例接受IM治疗,最常见的不良反应是水肿,多以眶周颜面水肿为主。其他不良反应包括胃肠道反应(纳差、恶心、呕吐等)、皮疹、白细胞减少、血小板减少、转氨酶升高、皮疹及出血等。除出血外,多数不良反应为轻中度,不影响治疗进行。本组病例中出现2例出血患者,但都是伴随肿瘤进展出现,考虑为瘤内坏死出血(表4)。
2.5 随访转归
本组病例在随访观察期内,32例出现耐药进展,其中5例改用苹果酸舒尼替尼继续治疗,其余均采用最佳支持治疗。本组病例中,1例肝转移性胃肠间质瘤患者在口服伊马替尼的同时配合肝动脉栓塞介入治疗3次,1例胃间质瘤术后复发患者行伊马替尼治疗13个月获得PR后行切除手术并继续行伊马替尼治疗至随访结束。

表4 IM治疗晚期GIST的不良反应Table 4Adverse events of IM for advanced GIST
3 讨论
分子诊断技术的发展,使GIST的诊断得以确立并从本质上阐明了其发病机制,进而影响到其治疗模式的变革[4]。典型的GIST在分子水平的特征是KIT/PDGFRA的基因突变,突变常见的部位是KIT的11和9外显子、PDGFRA的12和18外显子[5]。有研究报道GIST的年发病率为11~19.6/百万人口,占所有胃肠道肿瘤的0.1%~3.0%、小肠肿瘤的10.0%[6-7]。GIST多发生于年龄>50岁的成年人,大部分原发于胃(60%),其次是小肠(30%~35%),此外可见于结直肠、阑尾、食管、大网膜、腹膜后等部位[7-8]。本组病例中,中位年龄为58岁,原发灶分别为胃32.8%、小肠45.9%、结直肠8.2%、腹腔及腹膜后13.1%,与文献比较年龄偏大,非胃来源肿瘤的构成比偏高,应该与本研究中病例构成以复发、转移病例为主相关,同时间接提示胃来源GIST相对预后较好,在晚期GIST中比例降低。
手术切除是GIST的主要治疗方法,但15%~30%患者初诊时已经发生转移,而完整切除后的病例5年生存率仅为40%~50%,约40%最终会发生复发转移,再次手术的中位生存不超过12~18个月[8-10]。IM的临床应用,使晚期GIST的PFS提高至29个月,一项基于SEER研究显示非转移性GIST的3年肿瘤特异性生存率由1998年的75.3%升高至2008年的92.2%,而转移性GIST由15.0%升高至61.9%[11]。本研究61例GTST患者中,11.5%(7/61)为确诊时即已经发生腹盆腔或血行转移,78.7%(48/61)为术后复发或转移。本组晚期病例接受IM治疗,3年和5年的PFS分别为69%和53%,治疗1年的近期疗效RR为57.4%、DCR为88.5%,高于文献报道的RR 52.0%、DCR 75.0%~81.0%,表明晚期GIST显著受益于IM治疗[4]。国内一项多中心研究的结果显示女性、年龄≤60岁、肿瘤长径≤10 cm和Exon 11突变是IM治疗晚期GIST疾病进展生存期(time to progress,TTP)获益的预测因素,本研究发现年龄、性别和腹盆腔的多发转移状况是影响疗效的因素,而针对本组患者生存获益的Cox回归分析显示腹盆腔的多发转移是影响长期生存的重要因素[12]。
IM不良反应的发生率高达90%以上,但多数较轻微,以眶周水肿最为常见,其他包括躯干或肢体的水肿、胃肠道反应、白细胞和/或血小板减少等,最严重的不良反应是出血,但发生率较低[13-15]。本组病例中,多数不良反应均较轻微,2例出血患者均伴随病情进展而发生,其中1例为进展后增加用药剂量再次进展时发生,提示用药剂量增加的同时不良反应的发生风险可能会同时增加。
本研究表明,IM口服用药、耐受良好,在简化晚期GIST患者治疗过程的同时为该类患者获得更好的生存提供了支持。随着对GIST分子水平研究的深入,进一步的临床研究将会开展,通过细分GIST的亚群,精确定位不同的目标人群及治疗靶点,以期更好地提高GIST的治疗水平。
[1]Cao H,Wang M.New challenges in the diagnosis and treatment of gastrointestinal stromal tumor:thinking and practice from evidence-based medicine to precision medicine[J].Chin J Gastrointest Surg,2016,19(1):17-21.[曹晖,汪明.胃肠间质瘤诊断与治疗的新挑战-从循证医学到精准医学的思考与实践[J].中华胃肠外科杂志,2016,19(1):17-21.]
[2]Yang LW,Li B,Chen M,et al.Prognosis analysis of gastrointestinalstromal tumor[J].Chin J of Oncol Prevand Treat,2015,7(6):411-415.[杨利文,李波,陈明,等.胃肠间质瘤的预后因素分析[J].中国癌症防治杂志,2015,7(6):411-415.]
[3]Wu X,Feng L,Liu Q,et al.Partial response to imatinib treatment in a patient with unresectable gastrointestinal stromal tumor:A case report and mini literature review[J].Exp Ther Med,2016,12(4): 2297-2301.
[4]Schlemmer M,Bauer S,Schütte R,et al.Activity and side effects of imatinib in patients with gastrointestinal stromal tumors:data from a German multicenter trial[J].Eur J Med Res,2011,16(5): 206-212.
[5]Ravegnini G,Nannini M,Sammarini G,et al.Personalized medicine in gastrointestinal stromal tumor(GIST):clinical implications of the somatic and germline DNA analysis[J].Int J Mol Sci,2015,16(7): 15592-15608.
[6]Yan L,Zou L,Zhao W,et al.Clinicopathological significance of c-KIT mutation in gastrointestinal stromal tumors:a systematic review and meta-analysis[J].Sci Rep,2015,5:13718.
[7]Pandurengan RK,Dumont AG,Araujo DM,et al.Survival of patients with multiple primary malignancies:a study of 783 patients with gastrointestinal stromal tumor[J].Ann Oncol,2010,21(10): 2107-2111.
[8]Zhang L,Cai MZ,Deng JY,et al.Clinical analysis of 156 patients with gastrointestinal stromal tumors receiving imatinib therapy[J]. Chin J Gastrointest Surg,2014,17(4):331-334.[张李,蔡明志,邓靖宇,等.接受伊马替尼治疗的156例胃肠间质瘤临床分析[J].中华胃肠外科杂志,2014,17(4):331-334.]
[9]Klieser E,Pichelstorfer M,Weyland D,et al.Back to the start:Evaluation of prognostic markers in gastrointestinal stromal tumors[J]. Mol Clin Oncol,2016,4(5):763-773.
[10]Bauer S,Joensuu H.Emerging agents for the treatment of advanced,imatinib-resistant gastrointestinal stromal tumors:current status and future directions[J].Drugs,2015,75(12):1323-1334.
[11]Güller U,Tarantino I,Cerny T,etal.Population-based SEER trend analysis of overall and cancer-specific survival in 5138 patients with gastrointestinal stromal tumor[J].BMC Cancer,2015,15:557.
[12]Liu XF,Li J,Li Y,et al.Analyses of clinical features for responders on imatinib mesylate to Chinese patients with advanced gastrointestinal stromal tumor as first-line treatment:multi-center,eight years followed-up outcome[J].Chinese Clinical Oncology,2016,21(2):97-105.[刘秀峰,李健,李勇,等.伊马替尼一线治疗国人晚期胃肠间质瘤获益人群特征分析:多中心8年随访数据[J].临床肿瘤学杂志,2016,21(2):97-105.]
[13]Shen L,Jin ML.Imatinib mesylate alone for refractory advanced gastrointestinal stromal tumor[J].Chin J Oncol,2004,26(11):697-699. [沈琳,金懋林.甲磺酸伊马替尼治疗复发或转移性胃肠间质瘤[J].中华肿瘤杂志,2004,26(11):697-699.]
[14]Paolino G,Didona D,Clerico R,et al.Skin lesions in patients treated with imatinib mesylate:a 5-year prospective study[J].Cutis,2016, 97(6):E12-16.
[15]Hu XY,Chen W,Chen WJ,et al.Analysis of clinical features and prognostic factors of gastrointestinal stromal tumors with hepatic metastasis[J].Chinese Clinical Oncology,2016,21(4):310-314.[胡雪阳,陈玮,陈文俊,等.胃肠间质瘤肝转移的临床特征及生存分析[J].临床肿瘤学杂志,2016,21(4):310-314.]
(2016-09-12收稿)
(2016-11-15修回)
(编辑:武斌校对:周晓颖)
Imatinib mesylate for unresectable advanced gastrointestinal stromal tumors
Xin YUE,Jun HU,Jiacang WANG
Department of Colorectal Oncology,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin's Clinical Research Center for Cancer,Tianjin 300060,China
Objective:To evaluate the response rate and survival benefit of imatinib mesylate for advanced gastrointestinal stromal tumors(GIST).Methods:Sixty-one patients with unresectable GIST were recruited and given imatinib mesylate with an initial oral dose of 400 mg/day and received regular follow-ups to evaluate the response rate,survival benefit,and adverse effects.Results:The response rate was 57.4%(35/61),and the disease control rate was 88.5%(54/61)one year after initial treatment.Analysis of the Logic regression model shows that gender,age,and multiple lesions in the abdominal and pelvic cavity are factors that affect response rate (P<0.05).The five-year cumulative survival rate is 53%.The status of multiple lesions in abdominal and pelvic cavity affected the survival benefit of the cases(P<0.05).Although adverse effects frequently occur,most of them were mild except for two hemorrhagic cases.Conclusion:The clinical use of imatinib mesylate significantly increases the survival of patients with unresectable or metastatic GIST. The efficacy and safety of imatinib mesylate guarantees it as a treatment choice for advanced GIST.
gastrointestinal stromal tumors,imatinib mesylate,survival benefit,target therapy

10.3969/j.issn.1000-8179.2016.23.043
天津医科大学肿瘤医院结直肠科,国家肿瘤临床医学研究中心,天津市肿瘤防治重实验室,天津市恶性肿瘤临床医学研究中心(天津市300060)
岳欣yuexin@tjmuch.com
岳欣专业方向为胃肠道肿瘤的临床诊治及基础研究。
E-mail:yuexin@tjmuch.com

