8周耐力训练对Nrf2敲除鼠骨骼肌肌浆网钙调控的影响
刘雨佳,毛雅芸,张 缨
体育科学
8周耐力训练对Nrf2敲除鼠骨骼肌肌浆网钙调控的影响
刘雨佳,毛雅芸,张 缨
目的:研究8周耐力训练对Nrf2敲除鼠骨骼肌肌浆网Ca2+调节的作用及机制。方法:8周龄Nrf2敲除鼠和野生鼠各20只,分别随机分为安静组和运动训练组,即野生安静组(WC)、野生运动组(WE)、敲除安静组(KC)和敲除运动组(KE)。运动组动物适应性训练1周后在标准小动物跑台上进行跑台运动。运动方案:坡度0°,12 m/min,60 min/天,5天/周,共持续8周。在最后一次运动48 h后,所有小鼠脱颈椎处死,取两侧腿部骨骼肌。采用甲基百里香酚蓝比色法测定骨骼肌中Ca2+浓度,Western Blot方法测定骨骼肌总蛋白兰尼定受体(RyR)、FK506结合蛋白(FKBP12)、钙调蛋白(CaM)和肌浆网Ca2+-ATP酶(SERCA)的表达。结果:1)KC组RyR、FKBP12、CaM蛋白表达显著高于WC组(P<0.05);KE组CaM蛋白表达显著低于KC组(P<0.05);2)KC组SERCA1蛋白表达显著低于WC组(P<0.05),KE组SERCA1蛋白表达显著高于KC组(P<0.05);3)Nrf2敲除鼠骨骼肌组织中Ca2+浓度与野生鼠无差异,8周耐力训练后也无显著性变化。结论:1)Nrf2敲除鼠骨骼肌钙释放通道RyR和钙调蛋白CaM表达呈现代偿性增加。骨骼肌SERCA1蛋白表达减少,钙回收功能下降;2)8周耐力训练增强了骨骼肌钙释放功能,对于野生鼠增加了钙释放通道RyR的表达,而对于Nrf2敲除鼠CaM对RyR功能的抑制作用减弱。另外,8周耐力训练可以改善Nrf2缺失引起的钙回收功能下降。
耐力训练;Nrf2;Ca2+调控;骨骼肌
1 前言
Ca2+作为生物体内的重要第二信使,参与了细胞内多项生命活动的发生与调节,如:肌肉收缩[20]、腺体分泌[21]、转录调节[13]、细胞凋亡[15]等。在骨骼肌收缩过程中,Ca2+是兴奋收缩耦联的必要物质,肌浆网对胞浆钙离子浓度([Ca2+]i)的调控是保证骨骼肌收缩的必要前提[23]。在长
时间大强度运动中,运动所需能量增加,引起骨骼肌线粒体电子漏增加以及黄嘌呤代谢途径的激活,导致骨骼肌自由基生成增多[16,17]。增多的自由基,一方面可以引起肌浆网钙通道功能失调,造成骨骼肌胞浆内Ca2+超载,影响肌纤维兴奋-收缩耦联功能,从而使骨骼肌的收缩功能下降[8]。另一方面,自由基可攻击线粒体膜,使线粒体钙摄取增加,使能量代谢出现障碍,并进一步刺激自由基的生成,产生恶性循环[27]。因此,过量自由基导致的骨骼肌肌浆网对[Ca2+]i的失调是导致骨骼肌运动性疲劳的一个重要因素[12]。同时,长期适宜的耐力训练可以增强骨骼肌肌浆网钙调控能力[3],但作用机理并不十分清楚。
研究发现,核因子E2相关因子2(nuclear factor-erythroid 2p45-related factor 2,Nrf2)作为转录因子,被认为是细胞抗氧化应激的关键调节者[24]。当机体处于氧化应激状态时,Nrf2被激活,进入细胞核,识别并结合核内大部分抗氧化酶基因中启动子含有的特异DNA序列——抗氧化反应元件(antioxidant response element,ARE),从而可启动一系列抗氧化酶基因转录,上调多种保护性酶的表达,以清除体内过多的自由基[14,19,26]。已有研究证实,Nrf2在运动引起的骨骼肌氧化应激过程中可上调抗氧化酶表达,对骨骼肌细胞起着重要的保护作用[2,25],那么Nrf2是否也介导了对骨骼肌肌浆网Ca2+浓度的调节作用呢?目前国内、外鲜见报道。因此,本研究试图以Nrf2为切入点,探讨长期耐力训练对骨骼肌肌浆网的钙调节的影响及可能的机制。
2 研究对象与方法
2.1 研究对象
8周龄Nrf2敲除小鼠(来自中国医学科学院医学实验动物研究所),及同周龄野生型C57BL/6J小鼠(购自北京维通利华实验技术有限公司)各20只,分别随机分为安静对照组和运动组,每组10只,即野生安静组(WC)、野生运动组(WE)、敲除安静组(KC)和敲除运动组(KE)。保持动物饲养房内灯光 12∶12昼夜循环照明,室内湿度控制在50%~70%,室温保持在22℃~25℃,自由饮食、饮水,以国家标准啮齿类动物常规饲料喂养。
WC组和KC组小鼠正常笼中活动,WE组和KE组小鼠首先进行1周适应性跑台训练,方案为:坡度0°,跑速12 m/min,持续时间15 min/天,运动频率5天/周。之后采用正式训练方案:坡度0°,跑速12 m/min(约75%最大摄氧量强度[11]),运动强度持续时间60 min/天,运动频率5天/周,共8周。
2.2 取材
所有小鼠取材均在最后一次运动后48 h进行。小鼠脱颈椎处死,立即取小鼠两侧腿部骨骼肌,迅速称量,用锡纸包裹,标记,立刻投入液氮中。然后转入-80℃冰箱,保存待用。
2.3 骨骼肌组织钙含量测定
Ca2+含量测定采用甲基百里香酚蓝(MTB)比色法测定,组织中Ca2+在碱性溶液中与甲基百里香酚蓝结合,生成蓝色络合物,通过比色与同样处理的钙标准进行比较,可计算出Ca2+含量。取100 mg骨骼肌,以去离子水为介质匀浆,取上清液。根据试剂盒说明,加入工作液,酶标仪测定吸光度计算出组织中Ca2+含量。
2.4 Western Blot测定钙调控蛋白表达
取100 mg冻存骨骼肌组织,加入1 mL含蛋白酶抑制剂的RIPA蛋白裂解液(碧云天)中。剪碎,高速匀浆;冰上静置 30 min;12 000 r/min,4℃离心 30 min,取上清液于离心管中,-20℃冻存备用。采用美国Pierce公司生产的蛋白浓度试剂盒,BCA方法测定骨骼肌的蛋白浓度。以上样蛋白量20 μg为1次上样量,根据测定的蛋白浓度计算蛋白上样量。采用美国life technologies公司产Bolt 4%~12% Bis-Tris Plus和NuPAGE 3%~8% Tris-Acetate凝胶,电泳分离钙调蛋白(CaM)、FK506结合蛋白(FKBP12)、Ca2+-ATP酶(SERCA)、兰尼定受体(RyR)及内参(β-actin),然后采用美国Invitrogen公司的iBlot Gel Transfer System转移电泳胶将电泳后蛋白从凝胶转移至NC膜上。5%脱脂奶粉封闭1 h,4℃一抗过夜(CaM一抗:Santa Crus 稀释比例1∶200;FKBP12一抗:Santa Crus 稀释比例1∶200;SERCA1一抗:Santa Crus 稀释比例1∶500;SERCA2一抗:Santa Crus 稀释比例1∶200;RyR一抗:Santa Crus 稀释比例1∶200;β-actin一抗:Santa Crus 稀释比例1∶1 000)。次日TBST洗3次,每次10 min。然后用二抗[羊抗兔(中杉金桥) :CaM( 1∶2 000),羊抗小鼠(中科晨宇):FKBP12(1∶1 000),SERCA1(1∶5 000),SERCA2(1∶2 000),RyR(1∶5 000),β-actin(1∶5 000)]室温孵育摇床1 h,后用 TBST 洗膜3次,每次10 min。ECL发光显影,胶片曝光,放入Bio-Rad 凝胶成像仪中进行拍摄得到目的条带图像。用Image Lab软件读取条带的积分灰度值,用公式(1)计算的比值表示最后的结果。
(1)
2.5 统计学分析
3 研究结果
3.1 骨骼肌Nrf2蛋白表达
为了验证Nrf2基因敲除动物模型,本实验用Western Blot方法测定了4组小鼠骨骼肌Nrf2蛋白表达,结果如图1所示:Nrf2 敲除鼠中并未呈现Nrf2抗原-抗体结合反应,而野生鼠中则显示出清晰的Nrf2条带,表明Nrf2基因敲除小鼠模型建立成功;另外,经过8周耐力训练后,野生鼠骨骼肌Nrf2蛋白表达明显升高。

图 1 各组小鼠骨骼肌Nrf2总蛋白表达量Figure 1. The Expression of Nrf2 in Mice Skeletal Muscle among Groups
3.2 耐力训练对细胞内钙离子调节蛋白表达的影响
3.2.1 耐力训练对RyR表达的影响
如图2所示,与WC组相比,WE组RyR表达显著增加(P<0.05),即8周耐力训练显著增加了野生鼠骨骼肌RyR的表达。与KC组相比,KE组RyR表达无显著性差异,8周耐力训练对Nrf2敲除鼠RyR表达作用不明显。与WC组相比,KC组RyR表达显著增加(P<0.05)。

图 2 8周耐力运动对骨骼肌RyR蛋白表达的影响Figure 2. Effects of Eight Weeks Endurance Exercise Training on Protein Expression of RyR in Mice Skeletal Muscle
注:*表示与同种鼠的对照组相比P<0.05,#表示与同种干预方式下的WT鼠相比P<0.05,下同。
3.2.2 耐力训练对FKBP12表达的影响
如图3所示,与WC组相比,KC组FKBP12表达显著增加(P<0.05),而KE组与WE组无明显差异;与相同基因型安静组相比,运动组与安静组无显著变化。在安静状态下,Nrf2的缺失使FKBP12表达增加,而8周耐力训练对FKBP12表达影响不明显。

图 3 8周耐力运动对骨骼肌FKBP12蛋白表达的影响Figure 3. Effects of Eight Weeks Endurance Exercise Training on Protein Expression of FKBP12 in Mice Skeletal Muscle
3.2.3 耐力训练对CaM表达的影响
如图4所示,与WC组相比,KC组CaM表达显著增高(P<0.05),而KE组与WE组相比,无显著性差异。与KC组相比,KE组CaM表达显著降低(P<0.05),而WE组与WC组无显著性变化。Nrf2的缺失使CaM表达增加,而8周耐力训练可以使由于Nrf2的缺失引起的CaM增加得到恢复。
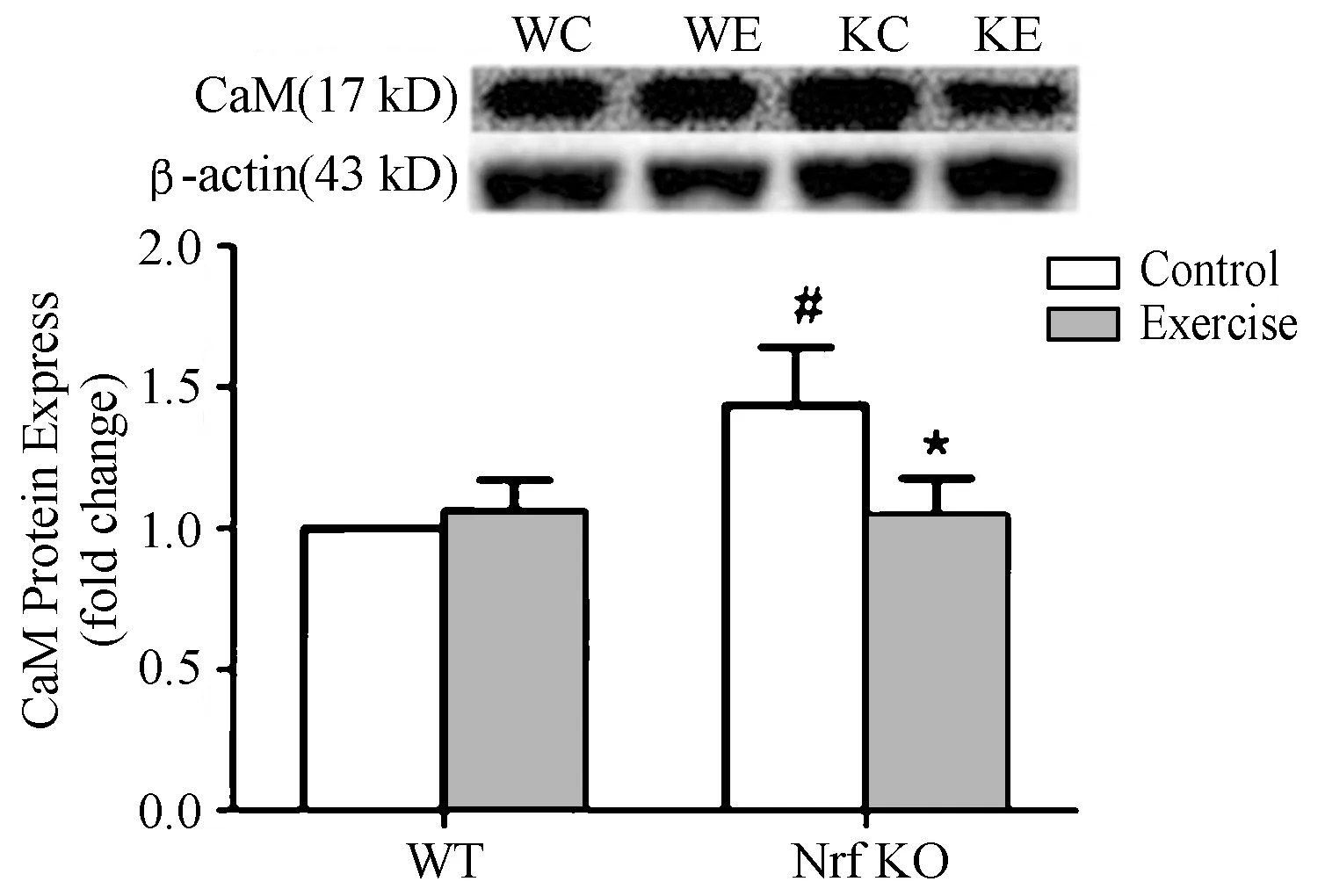
图 4 8周耐力运动对骨骼肌CaM蛋白表达的影响Figure 4. Effects of Eight Weeks Endurance Exercise Training on Protein Expression of CaM in Mice Skeletal Muscle
3.2.4 耐力训练对SERCA表达的影响
如图5所示,KC组SERCA1表达显著低于WC组(P<0.05),而KE组显著高于KC组(P<0.05)。但是,WE组与WC组无差异。KC组SERCA2蛋白表达较WC组有降低趋势,但无显著差异。各组间SERCA2表达均无显著性差异。Nrf2的缺失使SERCA1表达减少,8周耐力训练可以促进Nrf2敲除鼠SERCA1的恢复。
3.3 耐力训练对骨骼肌组织钙离子浓度的影响
如图6中所示,各组骨骼肌的Ca2+浓度无明显差异,Nrf2敲除并未引起骨骼肌组织中钙离子浓度明显变化,8周耐力训练也未对骨骼肌组织中钙离子浓度产生明显影响。

图 5 8周耐力运动对骨骼肌SERCA蛋白表达的影响Figure 5. Effects of Eight Weeks Endurance Exercise Training on Protein Expression of SERCA in Mice Skeletal Muscle

图 6 8周耐力训练对骨骼肌组织钙离子浓度的影响Figure 6. Effects of Eight Weeks Endurance Exercise Training on [Ca2+] in Mice Skeletal Muscle
4 分析讨论
在体实验和离体实验均证实,Nrf2的缺失引起细胞或组织氧自由基(ROS)的生成增多[18,22],出现多器官功能失调。ROS的增加是影响骨骼肌钙信号的重要因素,本研究试图将Nrf2与骨骼肌肌浆网的钙调控相结合,进一步阐述Nrf2在骨骼肌钙调控中的作用机制。
肌浆网对胞浆Ca2+浓度的调控是通过对Ca2+的释放和回收来实现的,这也是兴奋-收缩耦联的基础。如图7中所示,RyR是肌浆网上主要的Ca2+释放通道,介导了肌浆网内Ca2+的快速释放,其活动受到多种蛋白的调控,其中包括FKBP12和CaM等。FKBP12可以与RyR紧密结合,维持RyR 4个亚基之间疏水性区域的相互联系[1],因此,FKBP12被认为是RyR的稳定蛋白,维持RyR的正常结构和功能。CaM对RyR的调节取决于Ca2+的浓度。在低浓度Ca2+(nmol/L)时,促进肌浆网对Ca2+的释放,提高RyR的活化敏感性;在高浓度Ca2+(μmol/L)时,CaM对RyR的活性起抑制作用。SERCA是肌浆网Ca2+转运 ATP酶,其功能是将Ca2+回收至肌浆网。SERCA1主要表达于骨骼肌快肌纤维,而SERCA2表达于慢肌纤维和心肌。

图 7 肌浆网对Ca2+调节作用的分子机制Figure 7. Molecular Mechanism of Regulation of Sarcoplasmic Reticulcon of Calcium
4.1 Nrf2对骨骼肌肌浆网钙调控的作用
有研究发现,H2O2作为氧化应激的刺激剂可以激活肌浆网对Ca2+的释放,增加RyR通道的开放概率[6,10]。本研究中结果显示,Nrf2敲除鼠RyR、FKBP12表达显著增加,与上述文献结果基本一致。由于Nrf2的缺乏,体内ROS积累,使Nrf2敲除鼠骨骼肌钙释放功能长期处于代偿状态,RyR和FKBP12表达呈现代偿性增加。同时,本研究发现,Nrf2敲除鼠CaM表达较野生鼠增多,增加的CaM可能会对RyR活性起到抑制作用。推测由于RyR的表达增加,为了维持肌浆网钙释放功能在正常范围内,CaM也呈现代偿性增加。另外,研究还发现,Nrf2敲除鼠SERCA1表达较野生鼠显著降低。表明Nrf2敲除鼠骨骼肌肌浆网对Ca2+的回收功能降低。Ralf等人[9]关于Nrf2敲除鼠心肌SERCA2a表达显著性降低的结果,与我们骨骼肌的结果相一致,尽管组织不同,但机制可能相同,仍有待于进一步研究。
4.2 有氧运动训练对Nrf2敲除鼠骨骼肌肌浆网钙调控的作用
有氧耐力运动是一种非常普遍的健身方式,对机体多个系统的生理功能都有有益的影响。有研究表明,耐力训练可以增加大鼠骨骼肌肌浆网Ca2+的释放率,推测可能的机制是RyR通道表达和/或活性增加[3,4,5]。本研究发现,野生鼠运动组较安静组RyR表达增加,与前人结果相一致。对于Nrf2敲除鼠,8周耐力训练后RyR表达变化并不明显,但CaM表达显著降低。这说明,由于CaM表达的下降,可减弱CaM对RyR的抑制,从而增强RyR的作用,促进骨骼肌肌浆网Ca2+释放。
前人有研究显示,耐力训练同样可以增强肌浆网Ca2+的回收功能。肌浆网回收Ca2+能力主要通过SERCA活性和SERCA蛋白表达来实现[7]。本研究中SERCA1和SERCA2在运动组中蛋白表达呈现增加的趋势,但是并无显著性。在实验中SERCA1和SERCA2的活性是否得到提高,仍需要验证。对于Nrf2敲除鼠,8周耐力训练可以改善由于Nrf2的缺失引起的SERCA表达降低,恢复肌浆网对Ca2+的回收功能。耐力训练是通过何种途径来影响RyR、CaM、SERCA的表达,目前仍不清楚。
4.3 有氧耐力训练对骨骼肌组织钙浓度的影响
对于骨骼肌组织中Ca2+浓度检测发现,在安静状态下,各组骨骼肌的Ca2+浓度均维持在正常范围,无明显差异。Nrf2敲除并未引起骨骼肌组织中Ca2+浓度明显变化,虽然Nrf2敲除鼠RyR表达增加,但是,由于CaM表达也代偿性增加,因而CaM对RyR的抑制作用也加强,因此整体Nrf2的缺失并未表现出Ca2+浓度的异常。
8周耐力训练也未对骨骼肌组织中Ca2+浓度产生显著影响,说明肌浆网的钙释放和回收功能在8周耐力训练后可能产生了一定的适应,总体钙调控功能得到改善,使得骨骼肌Ca2+浓度在静息状态下能够维持在正常生理范围内。
5 结论
1.Nrf2敲除鼠骨骼肌钙释放通道RyR和钙调蛋白CaM表达呈现代偿性增加。同时,骨骼肌SERCA1蛋白表达减少,钙回收功能下降;
2.8周耐力训练增强了骨骼肌钙释放功能,对于野生鼠增加了钙释放通道RyR的表达,而对于Nrf2敲除鼠CaM对RyR功能的抑制作用减弱。另外,8周耐力训练可以改善Nrf2缺失引起的钙回收功能下降。
[1]韩红梅,尹长城.Ca2+对骨骼肌钙释放通道的调节[J].生理科学进展,2006,(2):132-135.
[2]李铁瑛,何诗依,刘思雪,等.急性运动对小鼠骨骼肌核蛋白Nrf2-ARE结合活性的影响[J].中国运动医学杂志,2015,34(7):649-652.
[3]张葆欣,燕小妮,马增亮.不同耐力训练模式下大鼠骨骼肌钙离子泵和 RyR1 受体功能的实验研究[J].北京体育大学学报,2009,(7):53-55.
[4]ANTTILA K,MANTTARI S,JARVILEHTO M.Effects of different training protocols on Ca2+handling and oxidative capacity in skeletal muscle of Atlantic salmon(Salmo salar L.)[J].J Exp Biol,2006,(Pt 15):2971-2978.
[5]ANTTILA K,MANTTARI S,JARVILEHTO M.Testosterone and Ca2+regulation in skeletal muscle[J].Int J Sports Med,2008,29(10):795-802.
[6]BORASO A,WILLIAMS A J.Modification of the gating of the cardiac sarcoplasmic reticulum Ca2+release channel by H2O2 and dithiothreitol[J].Am J Physiol,1994,(3 Pt 2):H1010-1016.
[7]BUBLITZ M,MUSGAARD M,POULSEN H,etal.Ion pathways in the sarcoplasmic reticulum Ca2+-ATPase[J].J Biol Chem,2013,(15):10759-10765.
[8]CULLY T R,EDWARDS J N,LAUNKIONIS B S.Activation and propagation of Ca2+release from inside the sarcoplasmic reticulum network of mammalian skeletal muscle[J].J Physiol,2014,(17):3727-3746.
[9]ERKENS R,KRAMER C M,LUCKSTADT W,etal.Left ventricular diastolic dysfunction in Nrf2 knock out mice is associated with cardiac hypertrophy,decreased expression of SERCA2a,and preserved endothelial function[J].Free Radic Biol Med,2015,89(6):6548-6555.
[10]FAVERO T G,ZABLE A C,ABRAMSON J J.Hydrogen peroxide stimulates the Ca2+release channel from skeletal muscle sarcoplasmic reticulum[J].J Biol Chem,1995,(43):25557-25563.
[11]FERNANDO P,BONEN A,HOFFMAN-GOETZ L.Predicting submaximal oxygen consumption during treadmill running in mice[J].Can J Physiol Pharmacol,1993,71(10-11):854-857.
[12]GISSEL H.The role of Ca2+in muscle cell damage[J].Ann N Y Acad Sci,2005,(1):166-180.
[13]GOMEZ A M,RUIZ-HURTADO G,BENITAH J P,etal.Ca2+fluxes involvement in gene expression during cardiac hypertrophy[J].Curr Vasc Pharmacol,2013,11(4):497-506.
[14]HARVEY C J,THIMMULAPPA R K,SINGH A,etal.Nrf2-regulated glutathione recycling independent of biosynthesis is critical for cell survival during oxidative stress[J].Free Radic Biol Med,2009,46(4):443-453.
[15]HENGARTNER M O.The biochemistry of apoptosis[J].Nature,2000,(6805):770-776.
[16]JIN C H,PAIK I Y,KWAK Y S,etal.Exhaustive submaximal endurance and resistance exercises induce temporary immunosuppression via physical and oxidative stress[J].J Exerc Rehabil,2015,11(4):198-203.
[17]KERKSICK C M,ZUHL M.Mechanisms of oxidative damage and their impact on contracting muscle[M]//LAMPRECHT M.Antioxidants in Sport Nutrition.Boca Raton(FL):CRC Press,2015.
[18]KOVAC S,ANGELOVA P R,HOLMSTROM K M,etal.Nrf2 regulates ROS production by mitochondria and NADPH oxidase[J].Biochim Biophys Acta,2015,(4):794-801.
[19]LEONARD M O,KIERAN N E,HOWELL K,etal.Reoxygenation-specific activation of the antioxidant transcription factor Nrf2 mediates cytoprotective gene expression in ischemia-reperfusion injury[J].FASEB J,2006,20(14):2624-2626.
[20]MELZER W,HERRMANN-FRANK A,LUTTGAU H C.The role of Ca2+ions in excitation-contraction coupling of skeletal muscle fibres[J].Biochim Biophys Acta,1995,(1):59-116.
[21]MIKOSHIBA K,HISATSUNE C,FUTATSUGI A,etal.The role of Ca2+signaling in cell function with special reference to exocrine secretion[J].Cornea,2008,27(s1):S3-S8.
[22]NARASIMHAN M,RAJASEKARAN N S.Exercise,Nrf2 and antioxidant signaling in cardiac aging[J].Front Physiol,2016,(7):241.doi:10.3389/fphys.2016.00241.
[23]OLSSON K,CHENG A J,ALAM S,etal.Intracellular Ca2+-handling differs markedly between intact human muscle fibers and myotubes[J].Skeletal muscle,2015,5(1):1-14.
[24]OSBURN W O,KENSLER T W.Nrf2 signaling:an adaptive response pathway for protection against environmental toxic insults[J].Mutat Res,2008,(1-2):31-39.
[25]SECHANG O,WARABI E W,YAMAMOTO M Y,etal.Nrf2 activation remarkably improves exercise endurance capacity in mice[J].Free Radic Biol Med,2012,53(1):S36-S37.
[26]ZHONG Q,MISHRA M,KOWLURU R A.Transcription factor Nrf2-mediated antioxidant defense system in the development of diabetic retinopathy[J].Invest Ophthalmol Vis Sci,2013,54(6):3941-3948.
[27]ZOROV D B,JUHASZOVA M,SOLLOTT S J.Mitochondrial ROS-induced ROS release:an update and review[J].Biochim Biophys Acta,2006,(5-6):509-517.
The Effects of Endurance Training on the Regulation of Sarcoplasmic Reticulum Calcium in Nrf2 Knockout Mice
LIU Yu-jia,MAO Ya-yun,ZHANG Ying
Objective:To investigate the effects of eight weeks endurance training on the regulation of sarcoplasmic reticulum calcium in Nrf2 knockout mice.Methods:Eight weeks Nrf2 knock out (KO)mice and wild mice were randomly assigned to a sedentary control group and an exercise training group (n=10):wild control group (WC),wild exercise group (WE),KO control group (KC)and KO exercise group (KE).Mice in exercise groups underwent 60min/day treadmill running at speed of 12m/min for eight weeks.Skeletal muscle was collected 48 hours after training.The concentration of Ca2+([Ca2+])was tested by MTB.The protein expressions of Nrf2,RyR,FKBP12,CaM and SERCA in skeletal muscle were analyzed by Western Blot.Results:1)Campared with WC,the expression of RyR,FKBP12 and CaM in KC were significantly increased (P<0.05); while after eight weeks training decreased the expression of CaM in KE than KC(P<0.05); 2)SERCA1 in KC was decreased than WC (P<0.05),while SERCA1 was increased in KE than KC; 3)There is no difference of [Ca2+] among groups.Conclusion:1)The expression of RyR and CaM were compensatory increased in Nrf2 KO mice; The expression of SERCA1 was decreased in Nrf2 KO mice,inducing the capacity of recruiting Ca2+in sarcoplasmic reticulum was decreased; 2)Eight weeks endurance training increased the capacity of sarcoplasmic reticulum Ca2+release by increasing the expression of RyR in wild mice,while by weakening the inhibition of CaM in Nrf2 KO mice.Eight weeks endurance training can repair the decline of the capacity of recruiting Ca2+in Nrf2 KO mice sarcoplasmic reticulum.
endurancetraining;Nrf2;Ca2+regulation;skeletalmuscle
1000-677X(2016)12-0053-05
10.16469/j.css.201612007
2016-09-06;
2016-11-07
国家自然科学基金资助项目(31471134); 中央高校基本科研业务费专项资金资助课题(2015ZX010)。
刘雨佳(1991-),男,山东聊城人,在读博士研究生,主要研究方向为运动与氧化应激,E-mail:liuyujia89@163.com;毛雅芸(1995-),女,江西上饶人,在读硕士研究生,主要研究方向为运动与氧化应激,E-mail:maoyayun11@163.com;张缨(1961-),女,北京人,教授,博士,博士研究生导师,主要研究方向为运动与骨骼肌代谢,Tel:(010)62989584,E-mail:zhyi9256@126.com。
北京体育大学 运动生物化学教研室, 北京 100084 Beijing Sport University,Beijing 100084,China.
G804.7
A

